Игровые технологии как средство активизации познавательного интереса учащихся на уроках химии
Формирование творческой личности, одна из главных задач современного образования. Федеральный компонент государственного стандарта ориентирован не только на знания учащихся, но в первую очередь на деятельностный компонент, который позволяет в наибольшей степени реализовать способности, возможности, потребности и интересы каждого ребёнка. Поэтому одной из главных целей на ступени общего образования является развитие познавательной активности учащихся. Однако, мы часто сталкиваемся с проблемой снижения мотивации к изучению химии, так как учащиеся сталкиваются с огромным объемом теоретического материала, со сложностью восприятия и осмысления химической терминологии, основополагающих законов, формул, решения задач. В связи с этим становится актуальным совершенствование методов обучения химии, которые стимулируют мыслительную деятельность школьников, развивают их познавательную активность, учат практически использовать химические знания. В решении данной проблемы можно предложить игровые формы организации занятий. Атмосфера игры создает условия, при которых ребята незаметно для себя вовлекаются в познавательную деятельность, начинают понимать, что выиграть можно, если имеешь определенный багаж знаний.
Игра - наиболее знакомый для детей вид деятельности, позволяющий проявлять ученикам свои индивидуальные особенности. Учебные игры способствуют развитию положительной мотивации к процессу познания, развитию любознательности, мышления, внимания, наблюдательности, памяти, сообразительности, расширению кругозора. А также формированию умений применять имеющиеся знания, принимать решения в разнообразных ситуациях. Игровые технологии позволяют разнообразить деятельность учащихся во время всего урока, что позволяет снизить умственную нагрузку и предотвратить их утомляемость. Обычно игра применяется в сочетании с другими методами: наблюдениями, самостоятельной работой, лабораторными опытами, работой с различными источниками.
Во время игры развиваются коммуникативные компетенции учащихся, школьники выполняют различные роли, они вступают в общение с одноклассниками, учатся слушать, прислушиваться к мнению других, отстаивать свое мнение, вырабатывают коллективное решение. Все это оказывает большое воспитательное значение на становление личности.
Игровые технологии могут использоваться на различных этапах урока: во время определения темы урока, на этапе целеполагания, во время проверки знаний, при изучении нового материала или его закреплении, при обобщении и систематизации знаний. Игра может занимать несколько минут или целый урок. При использовании игр необходимо создание таких ситуаций, при которых будут играть не только ученики, но и учитель.
Приведу несколько примеров дидактических игр, которые я использую на своих уроках.
1. Актуализацию знаний по теме «Физические и химические явления» в 8 классе можно провести следующим образом. На экране поочередно высвечиваются изображения явлений, учащиеся определяют физическое оно или химическое.
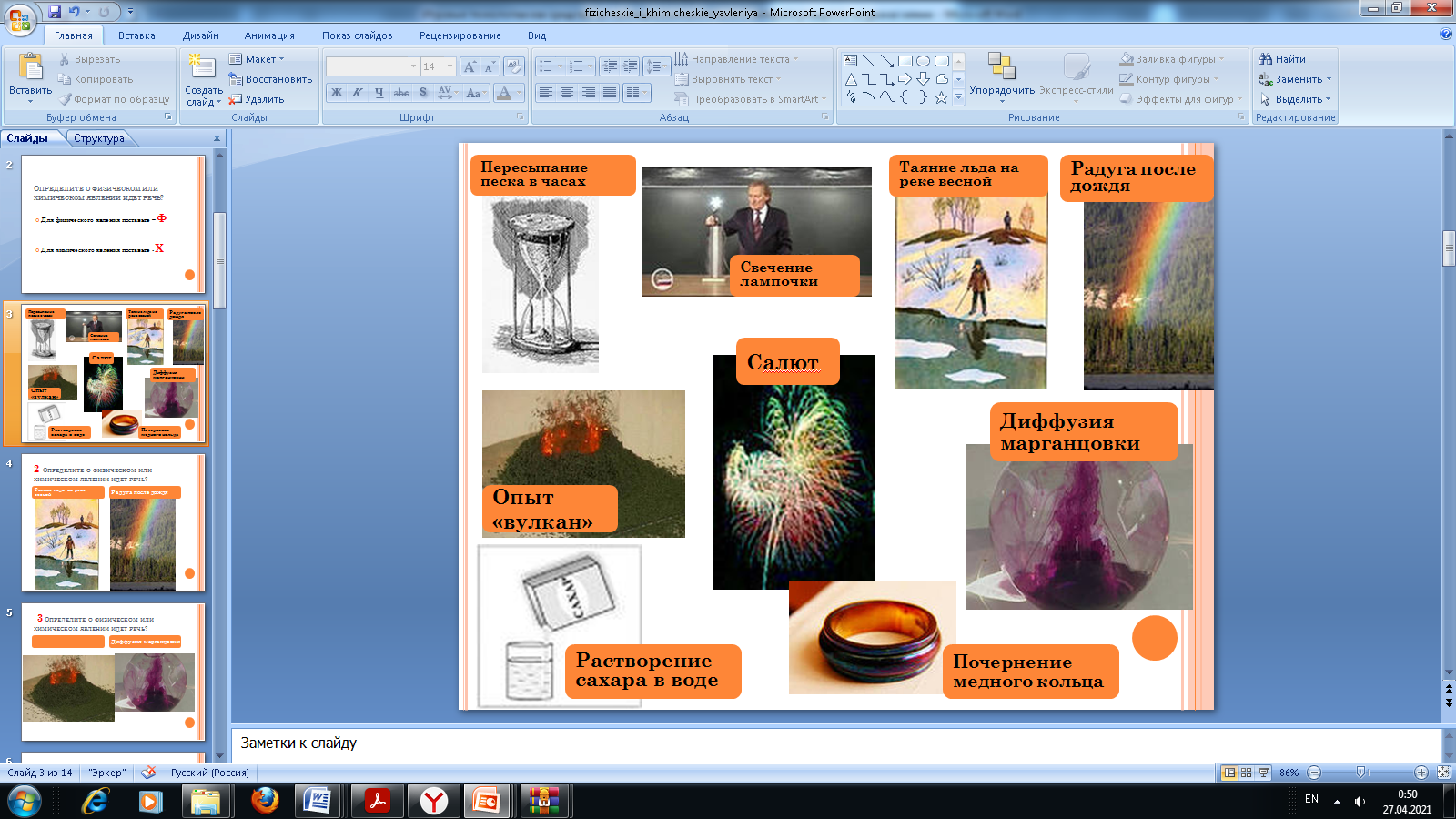

2. Актуализацию знаний по теме «Химический элемент» в 8 классе я провожу в виде игры «Химический элементарий», разбиваю класс на группы и предлагаю выполнить задания. Выигрывает та группа, которая быстрее всех и правильно выполнит все задания:
а) найдите в Периодической системе химических элементов Д.И.Менделеева:
три элемента, в названии которых отражены важнейшие их свойства;
три элемента названные в честь небесных тел;
три элемента названные в честь страны;
три элемента названные в честь городов;
три элемента названные в честь ученых.
Ответы могут быть такие: фосфор, хлор, бром; селен, теллур, уран; галлий, франций, рутений; берклий, дубний, лютеций; менделевий, кюрий, эйнштейний. Возможны и другие комбинации элементов.
б) запишите точный адрес «проживания» в Периодической системе следующих химических элементов: ванадий, натрий, бор, сера, ксенон, марганец, радий, мышьяк, рутений. Например: ванадий – элемент № 23, 4 период, 5 группа побочная подгруппа.
в) В «клетке» справа спрятались 12 химических элементов, каждый из которых играет важную биологическую роль в организме человека. Предлагаем вам «освободить» эти элементы из «клетки» и отыскать их русские названия. Правила освобождения простые: каждая следующая буква в названии элемента находится по соседству с предыдущей, вверху, внизу, справа или слева (но не по диагонали); каждую букву можно использовать только 1 раз; лишних букв остаться не должно.
| Т | Ь | Л | А | Б | Ф | Т | А |
| Ф | С | О | Ф | О | К | О | Р |
| О | З | О | Й | И | Ц | Р | Е |
| Р | Е | К | А | Л | Ь | Р | С |
| Е | Л | К | И | С | Л | О | Л |
| Ж | Й | И | Й | И | О | Д | Х |
| А  | Г | Н | Ц | Л | Р | О | Д |
| М | К | Н | И | А | К | Й | О |
1. Выпишите найденные вами химические элементы (включая подсказанный) в формате «название элемента и его символ».
2. Разделите найденные вами элементы на металлы и неметаллы (сгруппируйте отдельно символы металлов и неметаллов).
3. Выберите из найденных элементов те, которые соответствуют описанию (один элемент для каждой буквы): А) соединения этого металла входят в состав костной ткани, обеспечивая ее прочность; Б) этот элемент VIIA группы Периодической системы химических элементов Д.И. Менделеева входит в состав важных гормонов щитовидной железы; В) этот неметалл входит в состав соляной кислоты, которая является важным компонентом желудочного сока;
Г) этот неметалл входит в состав воздуха; Д) данный металлический элемент содержится в гемоглобине крови.
Ответ: Металлы – Mg, Fe, Ca, Zn, K, Co; Неметаллы – P, S, O, Cl, F, I.
А) кальций Ca; Б) йод I; В) хлор Cl; Г) кислород О; Д) железо Fe.
3. Игра «Найди и исправь ошибки» на примере изучения темы «Химические уравнения».
| 1 вариант (1 ряд) | 2 вариант (2 ряд) | 3 вариант (3 ряд) |
| 2P + Cl2 → 2PCl5 | 4P + О2 → 2P2О5 | 2Al + Cl2 → 2AlCl3 |
| Na + S → Na2S | Na + Cl2 → NaCl | K + S → K2S |
| HCl + Mg → MgCl2 + H2 | HCl + Zn → ZnCl2 + H2 | HBr + Fe → FeBr2 + H2 |
| H2O → H2 + O2 | H2O2 → H2O + O2 | KClO3 → KCl + 3O2 |
| N2 + H2 → 2NH3 | Cl2 + H2 → HCl | N2 + Ca → Ca3N2 |
4. На уроке обобщения и систематизации знаний по теме «Химические свойства основных классов неорганических соединений» предлагаю детям задание «Восстанови уравнение реакции». Ребята работают в группах, получают карточки с химическими уравнениями и выполняют задания. Выигрывает группа, которая быстрее всех справится с заданием.
| 1 вариант | 2 вариант |
| 2HCl + Fe = FeCl2 + …. | H2SO4 + … = MgSO4 + H2 |
| H2SO4 + …= CaSO4 + … | H2SO3 + …= BaSO3 + … |
| HCl + … = AgCl + … | H3РO4 + 3… = Ag3PO4 + 3… |
| Fe2O3 + 6HNO3 = … + 3H2O | MgO + … = Mg(NO3)2 + …. |
| Mg(OH)2 = … + H2O | 2Аl(OH)3 = Al2O3 + … |
| SO3 + … = H2SO4 | P2O5 + … = H3РO4 |
| … + H2SO4 = FeSO4 + 2… | … + … = 2KOH |
| … + … = Са(ОН)2 | Ca(OH)2 + 2…. = Ca(NO3)2 + …. |
| NaOH + … = NaBr + … | FeCl3 + … = Fe(OH)3 + … |
| P2O5 + … = Ва3(РО4)2 | … + HCl = CuCl2 + 2… |
| CuCl2 + … = Cu(OH)2 + … | P2O5 + … = 2Na3РО4 |
| СО2 + … = Na2CO3 + … | SiО2 + … = K2SiO3 + … |
5. На уроке закрепления знаний по теме «Химические свойства железа и алюминия» можно провести игру «Найди пару», в основе которой лежит умение составлять химические реакции. Учащиеся работают в парах, каждой паре выдается конверт с фрагментами уравнений химических реакций, ребята должны правильно соединить левую и правую часть уравнения:
| Химические свойства железа | | Левая часть | Правая часть | | 2Fe + 3Cl2 → | 2FeCl3 | | Fe + 2HCl → | FeCl2 + H2 | | Fe2O3 + 6HCl → | 2FeCl3 + 3H2O | | FeO + 2HCl → | FeCl2 + H2O | | Fe(OH)3 + 3HCl → | FeCl3 + 3H2O | | Fe(OH)2 + 2HCl → | FeCl2 + 2H2O | | Fe + CuCl2 → | FeCl2 + Cu | | 3Fe + 4H2O → | Fe3O4 + 4H2 | | 3Fe + 2O2 → | Fe3O4 | Химические свойства алюминия |
| Левая часть | Правая часть |
| 2Al + 3Cl2 → | 2AlCl3 |
| 2Al + 6HCl → | 2AlCl3 + 3H2 |
| Al2O3 + 6HCl → | 2AlCl3 + 3H2O |
| 2Al + 2NaOH + 6H2O → | 2Na[Al(OH)4] + 3H2 |
| Al(OH)3 + 3HCl → | AlCl3 + 3H2O |
| Al(OH)3 + NaOH → | Na[Al(OH)4] |
| 2Al +3CuCl2 → | 2AlCl3 + 3Cu |
| 2Al(амальг.) + 6H2O → | 2Al(OH)3 + 3H2 |
| 4Al + 3O2 → | 2Al2O3 |
6. На этапе закрепления материала активизировать внимание учащихся и закрепить изучаемые понятия можно применяя игру «Руки вверх». В данной игре учащиеся не только думают, но и совершают действие. Например, такая игра может использоваться при закреплении материала по темам «Вещество и физическое тело», «Основные классы неорганических веществ», «Чистые вещества и смеси», «Физические и химические явления» и т.д. Можно использовать карточки, презентацию, либо озвучивать вслух термин, явление. Например, при закреплении материала по теме «Вещество и физическое тело» называю вещество, ребята поднимают руки вверх, называю физическое тело, руки остаются на парте.
Вещество и физическое тело: железо, мяч, алюминий, тетрадь, кольцо, резина, целлюлоза, золото, линейка, полиэтилен, медь, телефон, колба, яблоко, сахароза, ручка, спирт, автомобиль.
7. Также при закреплении материала я активно применяю игру «Убери лишнее». На экране высвечиваются задания, учащиеся определяют лишнее вещество в ряду:
Оксиды: CaO, CuO, СS2; К2О, KOH, MgO; H2O, H2O2, Al2O3; Fe2O3, BaO, BaO2.
Кислоты: HBr, HNO3, H2O; HCl, HF, H3PO4; H2SO3, H2О2, H2SO4; HI, CH3COOH, HNO3.
Основания: NaOH, KOH, SO3; Al(OH)3, Mg(OH)2, LiOH; Ca(OH)2, NaOH, Fe(OH)2.
Соли: KCl,HCl, NaCl; Na2SO4, Na2SO3, H2SO4; K3PO4, Ca3(PO4)2, NaH2PO4; BaS, Na2S, KCl.
Углеводороды: метан, октан, силан; С2Н6, С4Н8, С5Н12; бензол, толуол, фенол; С5Н8, С4Н6, С5Н10; бутен-1, бутин-1, этилен; С6Н6, С8Н8, С7Н8; пропин, пропен, пропадиен.
Кислородсодержащие органические вещества: метанол, этанол, фенол; этиленгликоль, глицерин, изопропанол; метаналь, этаналь, пропанол-1; ацетон, бутанон, пропанон.
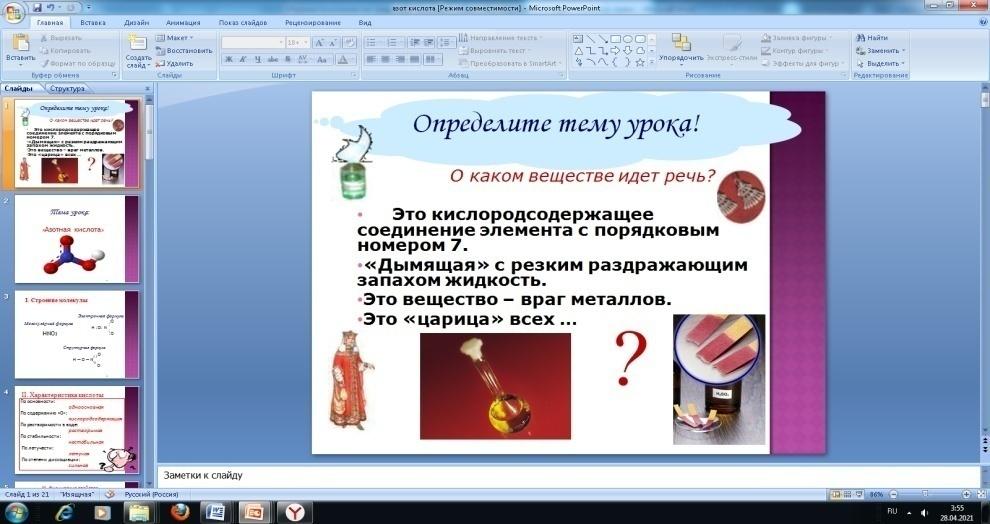
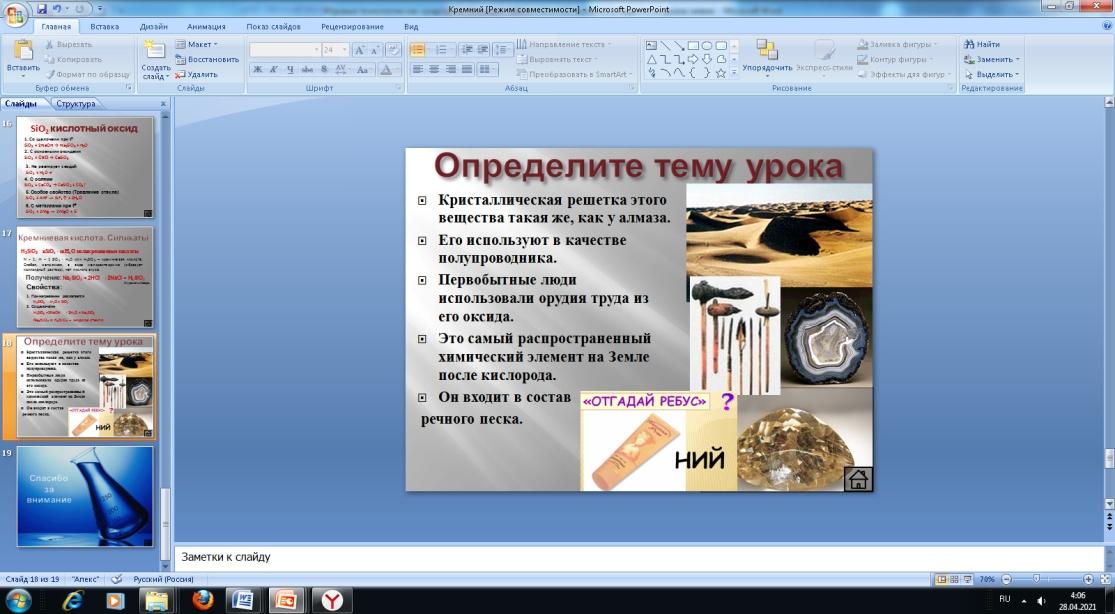
8. Для активизации познавательной деятельности учащихся на этапе определения темы урока и целеполагания я предлагаю ребятам интересные задания (ребусы, загадки, шарады).
У 

 роки по теме «Кислоты», «Щелочные металлы», «Кислород», «Сера», «Железо», «Водород», «Алюминий», «Азотная кислота», «Кремний».
роки по теме «Кислоты», «Щелочные металлы», «Кислород», «Сера», «Железо», «Водород», «Алюминий», «Азотная кислота», «Кремний».




9. Химические кроссворды, филворды:


Кроссворд по теме «Галогены»:
1. Агрегатное состояние фтора и хлора при нормальных условиях.
2. Самый тяжелый галоген, полученный искусственно в 1940 году с помощью ядерной реакции.
3 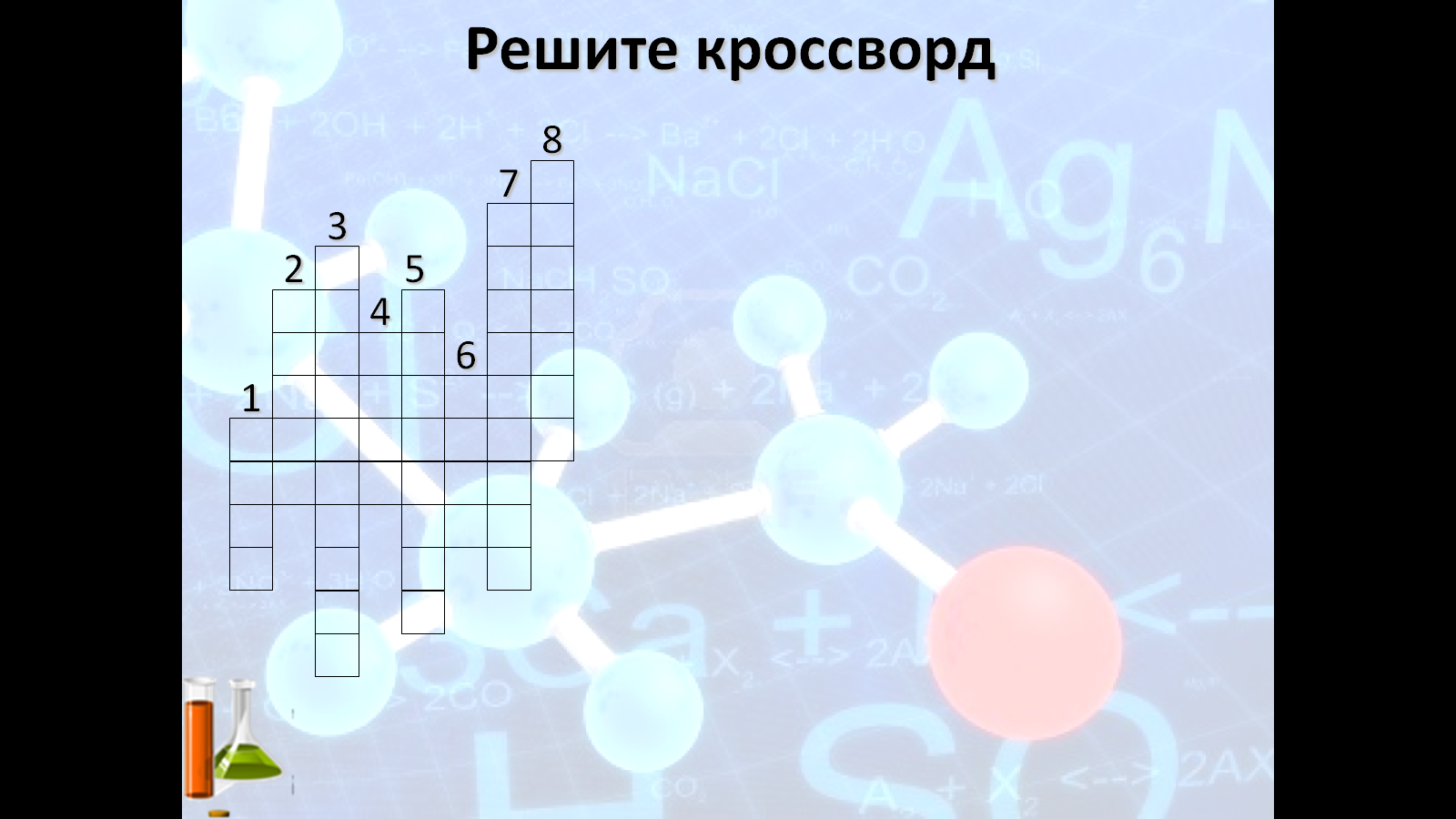
 . Наиболее характерное свойство галогенов, о них говорят: «Галогены – сильные...».
. Наиболее характерное свойство галогенов, о них говорят: «Галогены – сильные...».
4. Самый химически активный галоген. Впервые получен в 1886 году А. Муассаном.
5. Переход из твердого состояния в пар, минуя стадию жидкого состояния. Легко осуществляется для йода.
6. Количество электронов на внешнем энергетическом уровне в атомах галогенов.
7. Значение слова «бром» в переводе с греческого языка на русский.
8. Название солей, которые получаются в результате взаимодействия хлора с металлами.
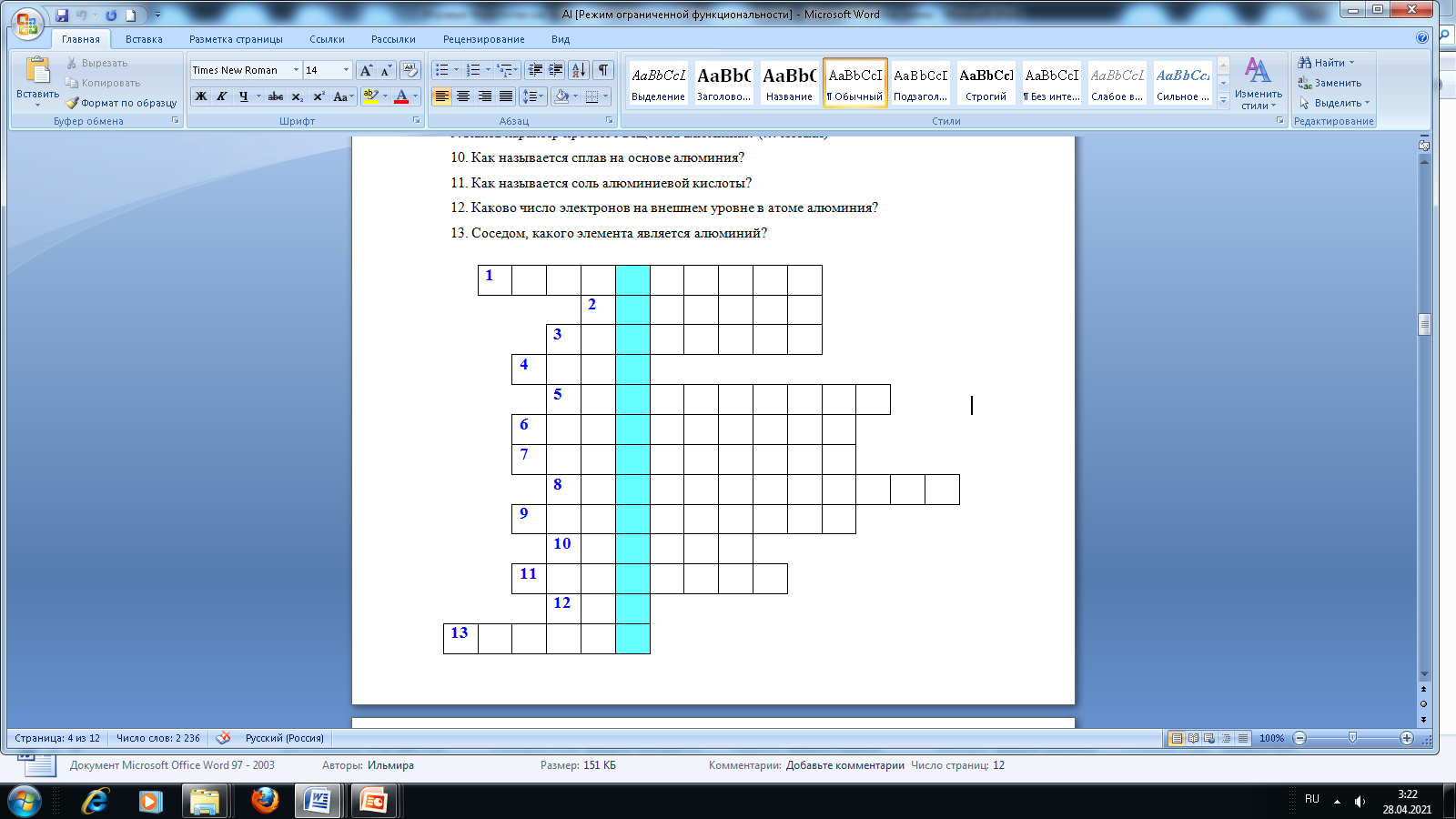
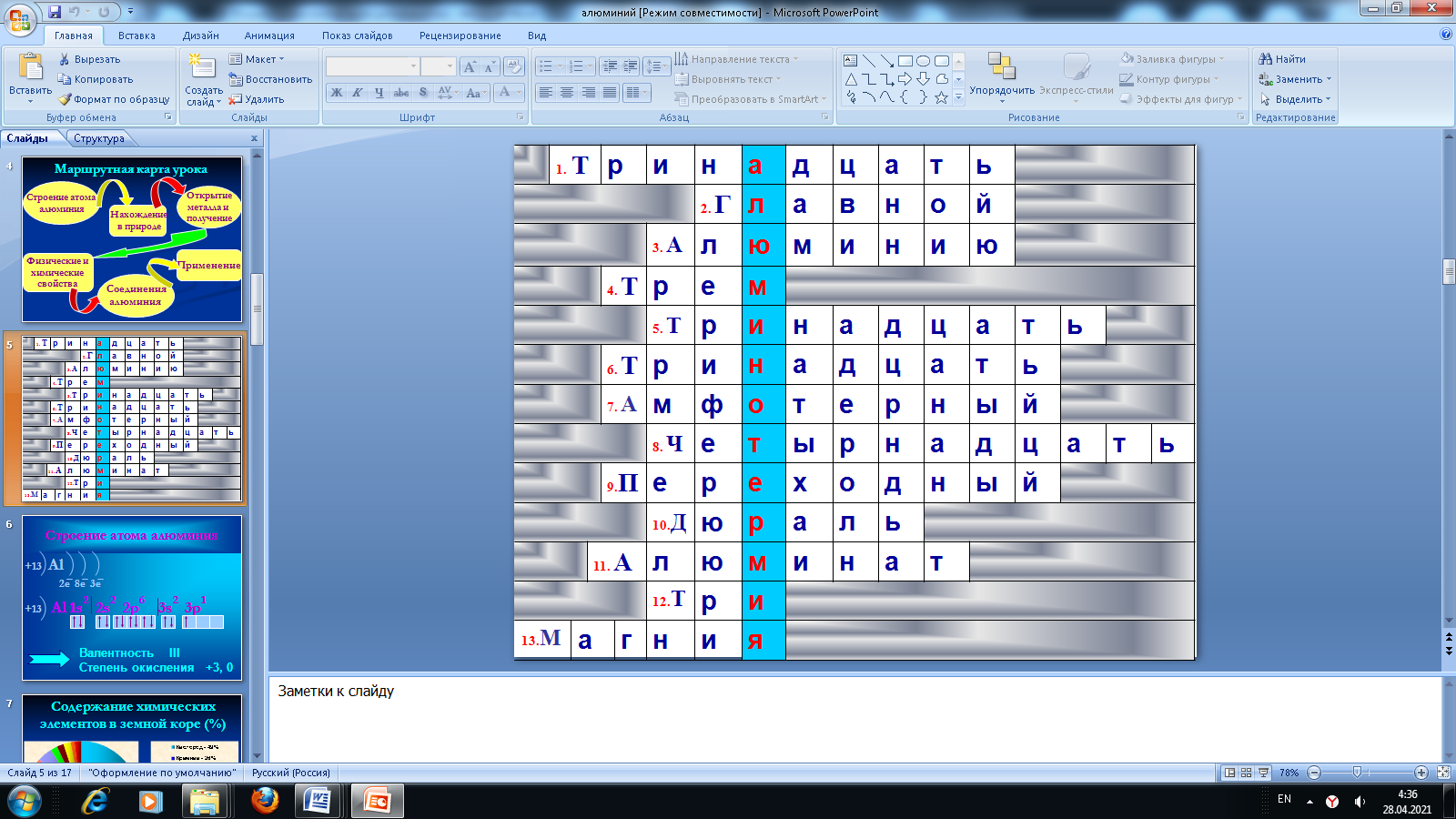
Кроссворд по теме «Алюминий»:
1. Каков порядковый номер алюминия?
2. Алюминий элемент III группы, какой подгруппы?
3. Какому элементу соответствует строение электронной оболочки 2е 8е 3е?
4. Чему равна валентность алюминия?
5. Чему равно число электронов в атоме алюминия?
6. Чему равно число протонов в ядре атома алюминия?
7. Какой характер имеют оксид и гидроксид алюминия?
8. Чему равно число нейтронов в ядре атома алюминия?
9. Каков характер простого вещества алюминия? (… металл)
10. Как называется сплав на основе алюминия?
11. Как называется соль алюминиевой кислоты?
12. Каково число электронов на внешнем уровне в атоме алюминия?
13. Соседом, какого элемента является алюминий?
Кроссворд по теме «Углерод»: заполните кроссворд, отгадав ключевое слово, означающее процесс выделения различных веществ поверхностью угля.
Явление, преломления лучей в кристалле называют…
Латинское название этого элемента «карбонеум»…
Один из сортов аморфного углерода.
В качестве поглотителя токсичных веществ в противогазах применяют…
Алмаз оценивается высшим баллом 10 и служит эталоном …
Реагируя при нагревании с металлами, углерод образует…
Процесс поглощения газов и растворенных веществ называется…
Структура какого вещества напоминает пчелиные соты?
Явление существования нескольких простых веществ, образованным одним элементом называют…


10. Игры с применением практической деятельности. Например, качественно определить в какой пробирке находится вода, раствор кислоты и раствор щелочи. Либо распознать растворы фторида, хлорида, бромида и йодида калия. Экспериментальные задания на качественное определение веществ можно проводить как по неорганической, так и по органической химии. На начальном этапе изучения химии я провожу игру «Знаток химической посуды», где учащимся необходимо определить название и назначение представленной химической посуды и лабораторного оборудования.
Таким образом, игровые технологии выполняют образовательную, развивающую и воспитательную цели. Уроки с использованием дидактических игр и игровых приемов активизируют познавательную деятельность учащихся. Во-первых, такие уроки повышают корпоративное взаимодействие в коллективе, психологически раскрепощают учащихся. При выполнении заданий ребята активно помогают друг другу, подтягивают отстающих, чтобы команда победила. Во-вторых, уроки с использованием игровых технологий позволяют учащимся лучше запоминать понятия, определения, формулы, законы, учат их нестандартно мыслить. Третьим важным результатом внедрения таких уроков, является активизация личностных качеств: памяти, внимания, мышления. Обучающиеся более внимательно подходят к выполнению заданий, анализируют возможные варианты и выбирают правильный ответ, аргументируя его имеющимися знаниями по химии. Подводя итог, следует сказать, что игровые технологии относятся к числу дополнительных методических средств повышения эффективности учебного процесса.














 роки по теме «Кислоты», «Щелочные металлы», «Кислород», «Сера», «Железо», «Водород», «Алюминий», «Азотная кислота», «Кремний».
роки по теме «Кислоты», «Щелочные металлы», «Кислород», «Сера», «Железо», «Водород», «Алюминий», «Азотная кислота», «Кремний».








 . Наиболее характерное свойство галогенов, о них говорят: «Галогены – сильные...».
. Наиболее характерное свойство галогенов, о них говорят: «Галогены – сильные...». 













