Областное государственное бюджетное профессиональное образовательное учреждение
«Димитровградский техникум профессиональных технологий
имени Героя Советского Союза М.С.Чернова»
Патрушев Александр Николаевич,
преподаватель биологии и химии
Контрольно-измерительные материалы по дисциплине «Химия»
Тест по теме «Строение атома»
Какие элементарные частицы входят в состав атомного ядра:
А) только протоны В) только нейтроны
С) протоны и нейтроны Д) нейтроны и электроны
Экспериментально обнаружил электроны в составе атомов и дал им название ученый-физик:
А) Дж.Томсон в конце XIXв. В ) Ж.Перрен в XIXв.
С) Стони в XIXв.
Д) Э.Резерфорд в XXв.
Массу, равную массе атома водорода (принятой в химии за единицу), и заряд +1 имеют следующие элементарные частицы:
А) нейтроны
В ) электроны
С) ионы
Д) протоны
При подаче высокого напряжения на электроды в вакууме было обнаружено явление, названное катодными лучами. Катодные лучи оказались:
А) потоком электронов от анода к катоду В) потоком электронов от катода к аноду С) потоком протонов от анода к катоду Д) потоком протонов от катода к аноду
Определите число электронов в атоме железа:
А) 26
В ) 30
С) 56
Д) 55
В основе ядерных процессов лежит изменение:
А) числа электронов в атоме
В) числа нейтронов в ядре атома С) числа протонов в ядре атома Д) массы атома
Какие частицы принято назвать изотопами:
А) атомы, имеющие одинаковое число протонов и нейтронов в ядре В ) атомы, имеющие одинаковый заряд, но разную массу
С) атомы с разным зарядом ядра, но с одинаковой массой
Д) разновидность атомов одного и того же элемента, имеющую разное число электронов
Тритий - это изотоп:
А) титана
В) водорода С) хлора
Д) гелия
Электроны атомной оболочки находятся на некотором расстоянии от ядра атома, но не притягиваются к положительно заряженному ядру, потому что:
А) электроны в атоме постоянно движутся вокруг ядра В) электроны в атоме не имеют отрицательного заряда С) электроны сильно удалены от ядра
Д) заряд ядра меньше, чем заряд электронов
Число электронов на внешнем энергетическом уровне электронной оболочки атома для химических элементов главных подгрупп равно:
А) номеру ряда в таблице Менделеева В) номеру периода в таблице Менделеева
С) относительной атомной массе химического элемента Д) номеру группы
Определите максимальное число электронов на втором энергетическом уровне в атоме:
А) два
В) восемь
С) четыре Д) один
Выберите верное утверждение:
А) чем меньше запас энергии электрона, тем меньше по размерам его орбиталь В) чем больше запас энергии электрона, тем меньше по размерам его орбиталь
С) размеры орбиталей электронов связаны с количеством электронов на данной орбитали Д) размер орбитали не зависит от энергии электрона
Выберите два элемента, свойства которых будут повторятся, если конфигурации их внешних энергетических уровней:
А) ...2s2 и ...3s23p6
В) ...2s22p6 и ...3s23p6
С) ...2s2 и ...2s22p5
Д) 1s2 и 1s1
Выберите химический элемент, который отличается от остальных по химическим свойствам (активности)
А) №5
В) №18
С) №2
Д) №10
Атом элемента имеет электронную конфигурацию внешнего энергетического уровня 3s1. Для него наиболее характерно:
А) отдавать и принимать электроны В) принимать электроны
С) не изменять степень окисления в химических реакциях Д) отдавать электроны
Укажите неверное утверждение:
А) в пределах одной и той же группы (в главной подгруппе) уменьшается радиус атома
В) в пределах одной и той же группы (в главной подгруппе) увеличиваются заряды атомных ядер
С) в пределах одной и той же группы (в главной подгруппе) увеличиваются металлические свойства элемента
Д) в пределах одной и той же группы (в главной подгруппе) растет число энергетических уровней в атоме
Как называются радиоактивные лучи, которые не несут электрического заряда:
А) бетта-лучи
В) кислородный газ С) гамма-лучи
Д) альфа-лучи
На одном р-подуровне не может находиться:
А) 1 электрон
В) 6 электронов
С) 8 электронов
Д) 2 электрона
Элемент с порядковым номером 15, имеет:
А) пять внешних электронов в конфигурации 3s33p2 В) пять внешних электронов в конфигурации 3s03p5 С) пять внешних электронов в конфигурации 3s23p3 Д) пять внешних электронов в конфигурации 3s13p4
20Какую минимальную и максимальную валентность имеет сера в химических соединениях:
А) II и VI
В) IV и VI
С) II и IV
Д) I и II
Эталон ответов на тест по теме « Строение атома»
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
Вариант |
с |
с |
д |
в |
а |
с |
в |
в |
а |
д |
в |
с |
в |
а |
д |
а |
с |
с |
с |
а |
Тест по теме
« Ионные реакции и реакции окисления-восстановления».
Растворы каких веществ реагируют между собой с выделением газа:
А) карбонат натрия и азотная кислота В) нитрат меди(II) и гидроксид натрия
С) гидроксид кальция и азотная кислота Д) гидроксид натрия и нитрат калия
Сокращенное ионное уравнение H+ + OH- соответствует реакции между:
А) гидроксидом меди(II) и серной кислотой В) газообразным водородом и кислородом С) гидроксидом бария и серной кислотой
Д) гидроксидом калия и кремниевой кислотой
Если к раствору сульфата натрия прилить раствор хлорида бария, то образуется:
А) желтый осадок В) выделится газ С) белый осадок
Д) осадка не образуется
Сокращенное ионное уравнение 2H+ + CO32- = H2O + CO2 соответствует реакции между:
А) карбонатом кальция и раствором соляной кислоты В) растворами соляной и угольной кислот
С) карбонатом натрия и раствором гидроксида кальция Д) растворами карбоната натрия и серной кислоты
Реакция нейтрализации относится: А) к реакциям отщепления В) к реакциям замещения С) к реакциям обмена
Д) к реакциям присоединения
При взаимодействии кислоты с основанием образуется: А) соль и водород
В) соль и вода
С) новая кислота и новая соль Д) соль и углекислый газ
С каким металлом соляная кислота не взаимодействует:
А) медь
В) железо
С) кальций
Д) цинк
Какой цвет имеет раствор сульфата меди(II):
А) зеленый
В) белый
С) красно-бурый Д) голубой
В результате взаимодействия хлорида калия с нитратом серебра образуется:
А) осадок
В) газ
С) соли друг с другом не взаимодействуют Д) вода
10Составьте полное и сокращенное ионное уравнение реакции между гидроксидом железа(II) и азотной кислотой. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях равны соответственно:
А) 12 и 3
В) 8 и 6
С) 10 и 6
Д) 12 и 6
Вычислите количество вещества, выпадающего в осадок при сливании раствора, содержащего 0,2 моль хлорида железа(III) и, и раствора, содержащего 0,3 моль гидроксида натрия:
А) 0,2 моль
В) 0,1 моль
С) 0,3 моль
Д) 1 моль
Определите степень окисления хлора в хлорите натрия NaClO2: Атом водорода, имеющий степень окисления 0, в окислительно-восстановительных реакциях может выступать в качестве:
А) восстановителя
В) как окислителя, так и восстановителя С) правильного ответа нет
Д) окислителя
Чему будет равна степень окисления меди в результате реакции 3CuCl2 + 2Al = 2AlCl3 + 3Cu Как изменится степень окисления азота в результате данной реакции? 8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
А) с 0 до +5
В) с +2 до 0
С) с 0 до +3
Д) с +5 до +2
.Расставьте коэффициенты в схеме реакции: C + HNO3 -- CO2 + NO + H2O. Коэффициент перед формулой восстановителя равен: Математической характеристикой среды является:
А) молярная концентрация В) водородный показатель С) константа диссоциации Д) гидроксидный показатель
Значение водородного показателя рН в растворе серной кислоты: А) = 7
В) = - 7
С) 7
Д) 7
В каком случае возможна реакция гидролиза:
А) в продуктах взаимодействия соли и кислоты находятся малодиссоциированные частицы В) в продуктах взаимодействия соли и воды находятся малодиссоциированные частицы
С) в продуктах взаимодействия кислоты и воды находятся малодиссоциированные частицы Д) в продуктах взаимодействия соли и воды находится газ
Какую среду будет иметь раствор ацетата натрия:
А) рН = 7
В) pH = -7
С) pH 7
Д) рН 7
Эталон ответов на тест по теме « Ионные реакции и реакции окисления-восстановления».
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
Вариант |
а |
с |
с |
д |
с |
в |
а |
д |
а |
с |
в |
д |
в |
а |
д |
с |
в |
с |
в |
с |
Тест по теме: «Превращения веществ. Химические реакции».
При физических явлениях не изменяется: А) размеры тела
В) форма тела
С) состав тел
Д) структура тел
Какое явление не является признаком химических превращений: А) появление запаха
В) появление осадка С) выделение газа
Д) изменение объема
горения - это:
А) реакции, протекающие с выделением теплоты и света В) реакции, протекающие с выделением теплоты
С) реакции, протекающие с образованием осадка Д) реакции, протекающие с поглощением теплоты
Какие условия не являются необходимымидля протекания химических реакций:
А) измельчение твердых веществ В) нагревание смесей
С) повышение давления смесей
Д) растворение (для растворимых веществ)
Закон сохранения массы веществ сформулировал:
А) Д.И.Менделеев В) А.Лавуазье
С) А.Беккерель
Д) М.В.Ломоносов
Как изменится масса магния, сгорающего в колбе с доступом воздуха:
А) правильного ответа нет В) не изменится
С) уменьшится
Д) увеличится
Сумма коэффициентов в уравнении химической реакции SO2 + O2 = SO3 равна:
А) 5
В) 6
С) 2
Д) 4
Укажите химическую реакцию, которая относится к реакциям разложения: А) CaCO3 = CaO + CO2
В) 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4 С) 2H2 + O2 = 2H2O
Д) CuSO4 + Fe = FeSO4 + Cu
К какому типу относится данная химическая реакция CuSO4 + Fe = FeSO4 + Cu
А) разложение
В) соединение
С) обмен
Д) замещение
Реакции, при которых из одного сложного вещества образуются 2 и более простых или сложных, но более простого состава, вещества, называются реакциями:
А) замещения
В) обмена
С) соединения
Д) разложения
Какое уравнение химической реакции соответствует схеме: сульфат меди(II) + гидроксид натрия = гидроксид меди(II) + сульфат натрия:
А) CuSO4 + NaOH = CuOH + NaSO4
В) Cu2SO4 + 2NaOH = 2Cu(OH)2 + Na2SO4 С) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Д) Cu2SO4 +2NaOH = 2CuOH + Na2SO4
Сколько литров водорода получится при взаимодействии 4 моль соляной кислоты с цинком:
А) 2 л
В) 44,8 л
С) 89,6 л
Д) 22,4 л
Какой тип реакции соответствует процессу лабораторного получения кислорода из перманганата калия:
А) соединение
В) разложение
С) обмен
Д) замещение
Кусочки мрамора залили соляной кислотой. Как изменится пламя лучинки, если внести ее в этот стакан:
А) вспыхнет
В) изменит цвет
С) погаснет
Д) не изменится
Сколько кислорода расходуется пр горении 16г метана (схема реакции: CH4 + 2O2 = CO2 + 2H2O):
А) 1 г
В) 64 г
С) 16 г
Д) 32 г
Какой из перечисленных ниже параметров всегда остается неизменным в химических реакциях:
А) объем
В) давление
С) масса
Д) концентрация
Нельзя окислить:
А) Mn+7
В) Mn+6
С) Mn0
Д) Mn+2
В какой реакции сера является восстановителем:
А) H2 + S = H2S
В) H2SO4(раствор) + Zn = ZnSO4 + H2
С) Cu + 2H2SO4(конц.) = CuSO4 + SO2 + H2O
Д) 2SO2 + O2 = 2SO3
Напишите уравнение реакции горения алюминия в хлоре. Коэффициент перед формулой восстановителя равен:
А) 3
В) 2
С) 1
Д) 6
Какая электронная схема соответствует процессу окисления:
А) S+6 S0
В) Mg0 Mg+2
С) S+4 S0
Д) S+6 -- S-2
Эталон ответов на тест по теме
«Превращения веществ. Химические реакции».
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
Вариант |
в |
в |
а |
а |
с |
д |
с |
д |
д |
в |
с |
а |
а |
с |
а |
а |
с |
а |
в |
с |
Тест по теме: «Общие положения теории электролитической диссоциации»
Лампочка прибора для определения электропроводности загорится, если электроды поместить
А) в жидкий азот
В) в гидроксид меди(II)
С) в расплав хлорида калия
Д) в дистиллированную воду
Не является электролитом:
А) расплав гидроксида калия
В) водный растовр соляной кислоты С) жидкий кислород
Д) водный раствор сульфата меди(II)
Раствор какого из данных веществ является электролитом:
А) спирта
В) соли
С) сахара
Д) глюкозы
Молекулы воды представляют собой диполи, так как атомы водорода располагаются под углом:
А) 105,40
В) 105,30
С) 104,50
Д) 103,50
Что такое электролитическая диссоциация:
А) процесс образования ионов
В) самораспад вещества на отдельные молекулы
С) процесс распада электролита на отдельные атомы
Д) процесс распада вещества на ионы при расплавлении или растворении в воде
Какие вещества называют кристаллогидратами:
А) твердые вещества, реагирующие с водой
В) твердые вещества, в состав которых входит химически связанная вода С) твердые вещества, не растворимые в воде
Д) твердые вещества, растворимые в воде
Формула для вычисления степени диссоциации:
А) Na/NB
В) NP/NД
С) N0/NB
Д) NД/NP
Какой цвет имеет гидратированный ион меди Cu2+:
А) голубой В) желтый С) белый
Д) не имеет цвета
Как называется положительный полюс источника тока:
А) катод
В) анион
С) анод
Д) катион
Как называются электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка:
А) оксиды
В) соли
С) кислоты Д) основания
Процесс диссоциации азотной кислоты можно выразить уравнением диссоциации:
А) HNO3 H+ + 3NO- В) HNO3 3H+ + 3NO-
С) HNO3 H+1 + NO3-1 Д) HNO3 H+ + NO3-
Все общие свойства оснований обусловлены наличием:
А) анионов кислотного остатка В) катионов водорода
С) гидроксид-ионов Д) катионов металлов
Процесс диссоциации гидроксида кальция можно выразить уравнением диссоциации:
А) Ca(OH)2 Ca+2 + 2OH-1 В) Ca(OH)2 Ca2+ + 2OH- С) Ca(OH)2 Ca+2 + OH- Д) Ca(OH)2 Ca2+ + OH-
Какая из данных кислот является при обычных условиях жидкостью:
А) кремниевая В) ортофосфорная С) серная
Д) угольная
Какая из данных кислот является сильной: А) угольная
В) ортофосфорная С) серная
Д) кремниевая
Диссоциация угольной кислоты является обратимой реакцией, так как эта кислота:
А) слабый электролит
В) растворима в воде
С) изменяет цвет индикатора Д) сильный электролит
Что означает выражение "степень диссоциации кислоты равна 25 %":
А) 25 % всех частиц в растворе кислоты - молекулы В) 25 % всех молекул кислоты диссоциируют на ионы С) 25 % всех частиц в растворе кислоты - ионы
Д) 25 % всех молекул кислоты не диссоциируют на ионы
Какая из данных формул отражает состав средней соли
А) Na2CO3 В) Mg(HSO4)2 С) NaHCO3
Д) (CuOH)2CO3
Какие ионы не могут присутствовать в растворе одновременно:
А) Cu2+ и OH- В) Cu2+ и SO42-
С) Na+ и SiO32-
Д) H+ и Br-
При диссоциации какого вещества образуется меньше всего ионов:
А) сероводородная кислота В) сульфат железа(III)
С) ортофосфорная кислота Д) угольная кислота
Эталон ответов на тест по теме «Общие положения теории электролитической диссоциации»
».
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
Вариант |
с |
с |
в |
с |
д |
в |
д |
а |
с |
с |
д |
с |
в |
с |
с |
а |
в |
а |
а |
а |
Зачетная работа по органической химии
Вариант 1.
Углеводороды с общей формулой СnH2n+2, не способные присоединять водород и другие элементы, называют:
а) алканами в) алкинами
б) алкенами г) аренами
Атомные орбитали углерода в молекулах аренов находятся в состоянии: а) sp3 гибридизации в) sp гибридизации
б) sp2 гибридизации г) sp3d2 гибридизации
Валентный угол в молекулах с sp2 – гибридизацией равен:
а) 109ْ 28 ′ в) 180ْ
б) 120ْ г) 360ْ
Длина тройной углерод – углеродной связи равна:
а) 0,154 нм в) 0,134 нм
б) 0,140 нм г) 0,120 нм
Взаимодействие металлического натрия с галогеналканами – реакция … а) Зелинского Н.Д. в) Вюрца Ш.
б) Коновалова М.И. г) Кучерова М.Г.
Функциональная группа спиртов:
а) СО в) СОН
б) ОН г) СООН
Правильное название вещества (СН3)3С – ОН:
а) 3-метилбутанол-1 в) 2,2-диметилэтанол
б) 3-метилметанол-1 г) 2-метилпропанол-2
СН3 – СН2 – СН2 – СН3 и СН3 – СН – СН3 – это:
│ СН3
а) гомологи в) геометрические изомеры б) структурные изомеры г) одно и тоже вещество
Присоединение молекулы воды по двойной или тройной связи – это реакция … а) гидратация в) галогенирования
б) гидрирования г) гидрогалогенирования
Этанол образуется при гидратации:
а) ацетилена в) этилена
б) пропина г) пропена
Группа атомов –СО–NH– (пептидная или амидная) входит в состав: а) аминокислот в) сложных эфиров
б) аминов г) белков
Химическая реакция, уравнение которой в общем виде
R – COOH + HOR′ ↔ RCOOR′ + H2О относится к реакциям:
а) обмена в) нейтрализации
б) этерификации г) замещения
С гидроксидом натрия реагирует:
а) пропан в) фенол
б) бензол г) этилен
Для распознавания фенола используют:
а) индикатор и раствор щелочи в) свежеосажденный гидроксид меди (II)
б) бромную воду г) аммиачный раствор оксида серебра (I)
Общая сумма коэффициентов в уравнении реакции СН4 + О2 → СО2 + Н2О а) 35 в) 8
б) 13 г) 6
Гидролизу подвергается:
а) метилацетат в) глюкоза
б) этилен г) пропионовая кислота
Наименее основными свойствами обладает:
а) триметиламин в) метиламин
б) диметиламин г) анилин
Конечные продукты гидролиза жира:
а) глюкоза в) аминокислоты
б) глюкоза и фруктоза г) глицерин и карбоновые кислоты
В реакцию полимеризации вступает:
а) стирол в) фенол
б) бензол г) пропан
Объем кислорода, израсходованного при сгорании 10 л метана (н.у.) равен: а) 12,5 л в) 16,8 л
б) 20 л г) 12 л
Вариант 2.
Углеводороды с общей формулой СnH2n, в молекуле которых имеется одна двойная связь, называют:
а) алканами в) алкинами
б) алкенами г) аренами
Атомные орбитали углерода в молекулах алкинов находятся в состоянии: а) sp3 гибридизации в) sp гибридизации
б) sp2 гибридизации г) sp3d2 гибридизации
Валентный угол в молекулах с sp3 гибридизацией равен: а) 109ْ 28 ′ в) 180ْ
б) 120ْ г) 360ْ
Длина ароматической связи равна:
а) 0,154 нм в) 0,134 нм
б) 0,140 нм г) 0,120 нм
Гидратация ацетилена в присутствии солей ртути (II) – реакция …
а) Зелинского Н.Д. в) Вюрца Ш.
б) Коновалова М.И. г) Кучерова М.Г.
Функциональная группа альдегидов:
а) СО в) СОН
б) ОН г) СООН
Правильное название вещества СН3 – С(СН3)2 – СОН:
а) изопропилэтаналь в) 2-метилпропаналь б) 2,2-диметилпропаналь г) 1,2-диметилбутаналь


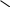
 Н Н Н3С Н
Н Н Н3С Н



 С = С и С = С – это:
С = С и С = С – это:
Н3С СН3 Н СН3
а) гомологи в) геометрические изомеры б) структурные изомеры г) одно и то же вещество
Присоединение HBr по месту кратной связи – это реакция … а) гидратация в) галогенирования
б) гидрирования г) гидрогалогенирования
Этаналь (ацетальдегид) образуется при гидратации: а) ацетилена в) этилена
б) пропина г) пропена
Группа атомов –NH2– входит в состав:
а) спиртов в) аминов
б) углеводов г) карбоновых кислот
Химическая реакция, уравнение которой в общем виде
свет
СН4 + Cl2 → CH3Cl + HCl относится к реакциям:
а) обмена в) нейтрализации
б) этерификации г) замещения
С бромоводородной кислотой реагирует:
а) пропан в) фенол
б) метиламин г) бензол
Для распознавания глюкозы используют:
а) индикатор и раствор щелочи в) бромную воду
б) хлорид железа (III) г) аммиачный раствор оксида серебра (I)
Общая сумма коэффициентов в уравнении реакции С6Н6 + О2 → СО2 + Н2О а) 35 в) 8
б) 13 г) 6
Гидролизу подвергается:
а) глюкоза в) бензол
б) фруктоза г) целлюлоза
Наибольшими основными свойствами обладает:
а) аммиак в) метиламин
б) диметиламин г) этанол
Конечные продукты гидролиза белка:
а) глюкоза в) аминокислоты
б) глюкоза и фруктоза г) глицерин и карбоновые кислоты
В реакцию полимеризации вступает:
а) этанол в) уксусная кислота
б) пропан г) пропилен
Объем кислорода (н.у.), израсходованного при сгорании 78 г бензола равен: а) 12,5 л в) 16,8 л
б) 20 л г) 12 л
Вариант 3.
Углеводороды с общей формулой СnH2n-2, в молекуле которых находится одна тройная связь, называют:
а) алканами в) алкинами
б) алкенами г) аренами
Атомные орбитали углерода в молекулах алканов находятся в состоянии: а) sp3 гибридизации в) sp гибридизации
б) sp2 гибридизации г) sp3d2 гибридизации
Валентный угол в молекулах с ароматической связью равен: а) 109ْ 28 ′ в) 180ْ
б) 120ْ г) 360ْ
Длина двойной углерод – углеродной связи равен:
а) 0,154 нм в) 0,134 нм
б) 0,140 нм г) 0,120 нм
Тримеризация ацетилена на активированном угле – реакция … а) Зелинского Н.Д. в) Вюрца Ш.
б) Коновалова М.И. г) Кучерова М.Г.
Функциональная группа карбоновых кислот:
а) СО в) СОН
б) ОН г) СООН
Правильное название вещества СН3СООСН2СН3:
а) этилформиат в) этилацетат
б) метилформиат г) метилацетат
СН3 – СН2 – СН2 – СН3 и СН3 – СН2 – СН3 – это:
а) гомологи в) геометрические изомеры б) структурные изомеры г) одно и тоже вещество
Присоединение водорода по кратной связи – это реакция … а) гидратация в) галогенирования
б) гидрирования г) гидрогалогенирования
Ацетон образуется при гидратации:
а) ацетилена в) этилена
б) пропина г) пропена
Группа атомов –NH2– входит в состав:
а) спиртов в) нитросоединений
б) аминокислот г) углеводов
Химическая реакция, уравнение которой в общем виде
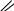 O
O
R – CН2ОН + CuO → R – C + Cu + H2О относится к реакциям:
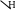
а) обмена в) восстановления альдегидов
б) окисления спиртов г) замещения
С бромоводородной кислотой реагирует:
а) этанол в) фенол
б) пропан г) бензол
Для распознавания этилена используют:
а) хлорид железа (III) в) индикатор и раствор щелочи
б) бромную воду г) аммиачный раствор оксида серебра (I)
Общая сумма коэффициентов в уравнении реакции С2Н4 + О2 → СО2 + Н2О а) 35 в) 8
б) 13 г) 6
Гидролизу подвергается:
а) пентан в) фруктоза
б) глюкоза г) крахмал
Наибольшими основными свойствами обладает:
а) триметиламин в) аммиак
б) анилин г) метиламин
Конечные продукты гидролиза крахмала:
а) глюкоза в) аминокислоты
б) глюкоза и фруктоза г) глицерин и карбоновые кислоты
В реакцию полимеризации вступает:
а) этанол в) этилен
б) пропан г) бензол
Объем кислорода, израсходованного при сгорании 4 л (н.у.) этилена равен: а) 12,5 л в) 16,8 л
б) 20 л г) 12 л
Вариант 4.
Углеводороды с общей формулой СnH2n-6, в молекуле которых имеется единая π-связь, называют:
а) алканами в) алкинами
б) алкенами г) аренами
Атомные орбитали углерода в молекулах алкенов находятся в состоянии: а) sp3 гибридизации в) sp гибридизации
б) sp2 гибридизации г) sp3d2 гибридизации
Валентный угол в молекулах с sp – гибридизацией равен: а) 109ْ 28 ′ в) 180ْ
б) 120ْ г) 360ْ
Длина одинарной углерод – углеродной связи равна:
а) 0,154 нм в) 0,134 нм
б) 0,140 нм г) 0,120 нм
Нитрование алканов нитрующей смесью (HNO3 + H2SO4) – реакция … а) Зелинского Н.Д. в) Вюрца Ш.
б) Коновалова М.И. г) Кучерова М.Г.
Функциональная группа кетонов:
а) СО в) СОН
б) ОН г) СООН
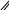
 Правильное название вещества О СН3 – СН2 – СН – С
Правильное название вещества О СН3 – СН2 – СН – С
│ ОН
СН3
а) 2-метилбутановая в) изоэтановая б) 2,3-диметилпропановая г) 1-метилбутановая
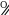
 СН3 – СН2 – С и СН2 – СООН – это:
СН3 – СН2 – С и СН2 – СООН – это:
ОН │ СН3
а) гомологи в) геометрические изомеры б) структурные изомеры г) одно и тоже вещество
Присоединение бромной воды по двойной или тройной связи – это реакция … а) гидратация в) галогенирования
б) гидрирования г) гидрогалогенирования
Пропанол-2 образуется при гидратации:
а) ацетилена в) этилена
б) пропина г) пропена
Группа атомов –NH2– входит в состав:
а) амидов карбоновых кислот в) сложных эфиров
б) нитрилов карбоновых кислот г) ангидридов карбоновых кислот
Химическая реакция, уравнение которой в общем виде
кат.
С2Н6 → C2H4 + H2 относится к реакциям:
а) присоединения в) разложения б) замещения г) обмена
С гидроксидом натрия реагирует:
а) пропан в) этанол
б) бензол г) уксусная кислота
Для распознавания муравьиного альдегида используют:
а) индикатор и раствор щелочи в) хлорид железа (III)
б) бромную воду г) аммиачный раствор оксида серебра (I)
Общая сумма коэффициентов в уравнении реакции С2Н2 + О2 → СО2 + Н2О а) 35 в) 8
б) 13 г) 6
Гидролизу подвергается:
а) этилен в) сахароза
б) пропановая кислота г) глюкоза
Наибольшими основными свойствами обладает:
а) бензол в) триэтиламин
б) анилин г) аммиак
Конечные продукты гидролиза сахарозы:
а) глюкоза в) аминокислоты
б) глюкоза и фруктоза г) глицерин и карбоновые кислоты
В реакцию полимеризации вступает:
а) этан в) ацетальдегид
б) бутадиен-1,3 г) фенол
Объем кислорода, израсходованного при сгорании 5 л ацетилена (н.у.) равен: а) 12,5 л в) 16,8 л
б) 20 л г) 12 л
Ответы
| № |
|
|
| I | II | III | IV |
|
| 1 | А | Б | В | Г |
|
| 2 | Б | В | А | Б |
|
| 3 | Б | А | Б | В |
|
| 4 | Г | Б | В | А |
|
| 5 | В | Г | А | Б |
|
| 6 | Б | В | Г | А |
|
| 7 | Г | Б | В | А |
|
| 8 | Б | В | А | Г |
|
| 9 | А | Г | Б | В |
|
| 10 | В | А | Б | Г |
|
| 11 | Г | В | Б | А |
|
| 12 | Б | Г | Б | В |
|
| 13 | В | Б | А | Г |
|
| 14 | Б | Г | Б | Г |
|
| 15 | Г | А | В | Б |
|
| 16 | А | Г | Г | В |
|
| 17 | Г | Б | А | В |
|
| 18 | Г | В | А | Б |
|
| 19 | А | Г | В | Б |
|
| 20 | Б | В | Г | А |
Контрольная работа № 1 по неорганической химии
Вариант 1
А1. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
4 и + 16 2) 6 и + 32 3) 6 и + 16 4) 4 и + 32
А2. B главных подгруппах периодической системы восстановительная способность атомов химических элементов растет c
увеличением числа энергетических уровней в атомах
уменьшением радиуса атомов
уменьшением числа протонов в ядрах атомов
увеличением числа валентных электронов
А3. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
вода и сероводород
бромид калия и азот
аммиак и водород
кислород и метан
4
А4. Степень окисления азота в ионе NН
+ равна
1) – 1 2) – 3 3) + 3 4) + 5
А5. Атомную кристаллическую решетку имеет каждое из двух веществ:
оксид кремния (IV) и оксид углерода (IV)
алмаз и кремний
хлор и иод
хлорид калия и фторид железа (III)
А6. К основным оксидам относится
ZnO 2) SiO2 3) BaO 4) Al2O3
А7. В ряду натрий – магний – алюминий элементы расположены в порядке увеличения
атомного радиуса
электроотрицательности
металлических свойств
числа энергетических уровней
А8. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
железо 2) хром 3) медь 4) цинк
А9. Оксиды с общей формулой R2O3 и R2O5 образуют элементы подгруппы
углерода 2) азота 3) серы 4) фтора
А10. Наиболее энергично реагирует с водой
Al 2) Mg 3) Ca 4) К
А11. Водород проявляет свойства окислителя при взаимодействии с
кислородом
азотом
кальцием
хлором
А12. При нагревании оксида железа (II) с оксидом углерода (II) образуются углекислый газ и
Fe 2) FeO 3) Fe2O3 4) Fe3O4
А13. При нагревании гидроксида меди (II) образуются
Cu и H2O 2) СuO и Н2 3) CuO и Н2О 4) Сu2O и Н2О
А14.Хлороводородная (соляная) кислота реагирует с
Сu 2) Hg 3) Ag 4) Zn
А15. Соль и щелочь образуются при взаимодействии растворов
K2CO3 и Ba(OH)2
AlCl3 и NaOH
H3PO4 и KOH
MgBr2 и Na3PO4
ОТВЕТЫ (вариант1)
Задание с выбором ответа считается выполненным верно, если студент указал код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует) задание считается невыполненным.
| № задания | Ответ |
| № задания | Ответ |
| А1 | 3 |
| А13 | 3 |
| А2 | 1 |
| А14 | 4 |
| А3 | 3 |
| А15 | 1 |
| А4 | 2 |
|
|
| А5 | 2 |
|
|
| А6 | 3 |
|
|
| А7 | 2 |
|
|
| А8 | 3 |
|
|
| А9 | 2 |
|
|
| А10 | 4 |
|
|
| А11 | 3 |
|
|
| А12 | 1 |
|
|
Вариант 2
А1. Какую электронную конфигурацию имеет атом наиболее активного металла?
1s22s22p1
1s22s22p63s1
1s22s2
1s22s22p63s23p1
А2. B ряду: Na Mg Al Si
увеличивается число энергетических уровней в атомах
усиливаются металлические свойства элементов
уменьшается высшая степень окисления элементов
ослабевают металлические свойства элементов
А3. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
Cl2, NH3, HCl
HBr, NO, Br2
H2S, H2O, S8
HI, H2O, PH3
А4. Высшую степень окисления марганец проявляет в соединении
KMnO4 2) MnO2 3) K2MnO4 4) MnSO4
А5. Молекулярную кристаллическую решетку имеет
CaF2 2) CO2 3) SiO2 4) AlF3
А6. Амфотерным и основным оксидами соответственно являются:
FeO и CaO
Al2O3 и K2O
CO2 и NO
Fe2O3 и CO
А7. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
Al, Zn, Fe
Al, Na, K
Fe, Zn, Mg
Fe, Zn, Al
А8. Верны ли следующие суждения о неметаллах?
А. Все неметаллы являются химически активными веществами. Б. Все неметаллы обладают только окислительными свойствами.
верно только А
верно только Б
верны оба суждения
оба суждения неверны
А9. Химическая реакция возможна между
Cu и HCl
Fe и Na3PO4
Ag и Mg(NO3)2
Zn и FeCl2
А10. Оксид серы (VI) взаимодействует с каждым из двух веществ:
вода и соляная кислота
кислород и оксид магния
оксид кальция и гидроксид натрия
вода и медь
А11. Гидроксид натрия не реагирует с
Al(OH)3 2) ZnO 3) H2SO4 4) Ba(OH)2
А12. Хлорид железа (II) реагирует с каждым из двух веществ:
MgO и HCl
Zn и AgNO3
HNO3 и CO2
CaO и CO2
А13. В схеме превращений
Ca ��HO2�� X1 ��C �O2 � X2
веществами «X1», «X2» являются соответственно
Ca(OH)2, CaCO3
CaO, CaCO3
Ca(OH)2, CaO
Ca(OH)2, CaC2
А22. Диссоциация по трем ступеням возможна в растворе
хлорида алюминия
нитрата алюминия
ортофосфата калия
ортофосфорной кислоты
А23. Сокращенное ионное уравнение реакции Al3+ + 3OH– = Al(OH)3
соответствует взаимодействию
хлорида алюминия с водой
алюминия с водой
хлорида алюминия со щелочью
алюминия со щелочью
ОТВЕТЫ (вариант 2)
| № задания | Ответ |
| № задания | Ответ |
| А1 | 2 |
| А11 | 4 |
| А2 | 4 |
| А12 | 2 |
| А3 | 4 |
| А13 | 1 |
| А4 | 1 |
| А14 | 4 |
| А5 | 2 |
| А15 | 3 |
| А6 | 2 |
|
|
| А7 | 1 |
|
|
| А8 | 4 |
|
|
| А9 | 4 |
|
|
| А10 | 3 |
|
|
П р и м е р н ы е т е м ы р е ф е р а т о в ( д о к л а д о в ) , индивидуальных проектов
Биотехнология и генная инженерия — технологии XXI века.
Нанотехнология как приоритетное направление развития науки и производства в Российской Федерации.
Современные методы обеззараживания воды.
Аллотропия металлов.
Жизнь и деятельность Д.И. Менделеева.
«Периодическому закону будущее не грозит разрушением...»
Синтез 114-го элемента — триумф российских физиков-ядерщиков.
Изотопы водорода.
Использование радиоактивных изотопов в технических целях.
Рентгеновское излучение и его использование в технике и медицине.
Плазма — четвертое состояние вещества.
Аморфные вещества в природе, технике, быту.
Охрана окружающей среды от химического загрязнения. Количественные ха рактеристики загрязнения окружающей среды.
Применение твердого и газообразного оксида углерода (IV).
Защита озонового экрана от химического загрязнения.
Грубодисперсные системы, их классификация и использование в профессиональной деятельности.
Косметические гели.
Применение суспензий и эмульсий в строительстве.
Минералы и горные породы как основа литосферы.
Растворы вокруг нас. Типы растворов.
Вода как реагент и среда для химического процесса.
Жизнь и деятельность С.Аррениуса.
Вклад отечественных ученых в развитие теории электролитической диссоциа ции.
Устранение жесткости воды на промышленных предприятиях.
Серная кислота — «хлеб химической промышленности».
Использование минеральных кислот на предприятиях различного профиля.
Оксиды и соли как строительные материалы.
История гипса.
Поваренная соль как химическое сырье.
Многоликий карбонат кальция: в природе, в промышленности, в быту.
Реакции горения на производстве и в быту.
Виртуальное моделирование химических процессов.
Электролиз растворов электролитов.
Электролиз расплавов электролитов.
Практическое применение электролиза: рафинирование, гальванопластика, гальваностегия.
История получения и производства алюминия.
Электролитическое получение и рафинирование меди.
Жизнь и деятельность Г. Дэви.
Роль металлов в истории человеческой цивилизации. История отечественной черной металлургии. Современное металлургическое производство.
История отечественной цветной металлургии. Роль металлов и сплавов в научно техническом прогрессе.
Коррозия металлов и способы защиты от коррозии.
Инертные или благородные газы.
Рождающие соли — галогены.
История шведской спички.
История возникновения и развития органической химии.
Жизнь и деятельность А. М. Бутлерова.
Витализм и его крах.
Роль отечественных ученых в становлении и развитии мировой органической химии.
Современные представления о теории химического строения.
Экологические аспекты использования углеводородного сырья.
Экономические аспекты международного сотрудничества по использованию углеводородного сырья.
История открытия и разработки газовых и нефтяных месторождений в Российской Федерации.
Химия углеводородного сырья и моя будущая профессия.
Углеводородное топливо, его виды и назначение.
Синтетические каучуки: история, многообразие и перспективы.
Резинотехническое производство и его роль в научно-техническом прогрессе.
Сварочное производство и роль химии углеводородов в нем.
КРИТЕРИИ ОЦЕНКИ ТЕСТОВЫХ ЗАДАНИЙ
с помощью коэффициента усвоения К
К = А:Р, где А – число правильных ответов в тесте Р – общее число ответов
| Коэффициент К | Оценка |
| 0,9-1 | «5» |
| 0,8-0,89 | «4» |
| 0,7-0,79 | «3» |
| Меньше 0,7 | «2» |
КРИТЕРИИ ОЦЕНКИ ПИСЬМЕННЫХ РАБОТ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка Отметка «4»:
работа выполнена не менее, чем на половину, допущена одна существенная ошибка и при этом две-три несущественные
Отметка «2»:
работа выполнена меньше, чем на половину или содержит несколько существенных ошибок
КРИТЕРИИ ОЦЕНКИ РЕФЕРАТОВ
| Оценка | Оформление | Содержание | Речевое | Грамотность |
|
| реферата | реферата | оформление |
|
| «5» | Титульный лист о ф о р м л е н в соответ ствии с требованиями (приложение) Наличие плана 3 . В т е к с т е имеются ссылки на авторство 4. Наличие списка использованной л и т е р а т у р ы в соответ ствии с правилами библиографии. | С о д е р ж а н и е работы полностью соответствует теме. Ф а к т и ч е с к и е ошибки отсутствуют. С т р о й н ы й п о композиции, л о г и ч н о е и последовательное в изложении мыслей. Объем реферата 10-12 листов | 1 . Н а п и с а н правильным литературным я з ы к о м и стилистически соответствует содержанию. 2 . В реферате допускается незначительная н е т о ч н о с т ь в содержании и 1-2 речевых недочета. | Допускается: одна орфографическая. И л и о д н а пунктуационная, и л и о д н а грамматическая ошибка |
| «4» | 1. Оформление в основном соответствует требованиям, но нарушен один из 4 - х п у н к т о в требований. | 1 . С о д е р ж а н и е работы в основном соответствует теме (имеются незначительные отклонения от темы) 2 . С о д е р ж а н и е в основном д о с т о в е р н о , н о имеются единичные фактические неточности. 3.Имеются незначительные нарушения последовательности в изложении мысли. | 1 . Н а п и с а н правильным литературным я з ы к о м и стилистически соответствует содержанию. 2.достоверно: 2-3 неточности в содержании, не б о л е е 3 - 4 речевых недочетов. | Допускаются: 2 орфографические, и л и 2 пунктуационные, и л и 1 орфографическая и 3 пунктуационные ошибки, а также 2 грамматические ошибки |
| «3» | 1. Оформление не соответствует выше перечисленным требованиям. | 1 . В г л а в н о м и основном раскрывается тема, в целом дан верный, но односторонний или недостаточно полный ответ на тему. 2 . д о п у щ е н ы отклонения от темы и л и и м е ю т с я отдельные ошибки в изложении фактического материала. 3.Допущены | 1. Стиль работы отличается единством, обнаруживается владение основами письменной речи. 2.Допускается: н е б о л е е 4 н е д о ч е т о в в содержании и 5 речевых недочетов. |
|
|
|
| отдельные нарушения последовательности. |
|
|
С п и с о к и с п о л ь з о в а н н о й л и т е р а т у р ы :
Габриелян О.С. Лысова Г.Г. Химия. Учебник для образовательных учреждений.10 класс.Москва, Дрофа, 2005.
Габриелян О.С. Лысова Г.Г. Химия. Учебник для образовательных учреждений.11 класс.Москва, Дрофа, 2005.
Габриелян О.С. Березкин П.Н.Химия.10 класс: Контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия.10»-М.: Дрофа,2004.
Котлярова О.С. Учет знаний по химии. Пособие для учителей. М.: «Просвещение»,1977.
Барковский Е. Врублевский А. Домашний репетитор. Тесты по химии. М.: «Айрис-пресс», 1999







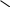
 Н Н Н3С Н
Н Н Н3С Н


 С = С и С = С – это:
С = С и С = С – это: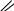 O
O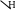
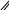
 Правильное название вещества О СН3 – СН2 – СН – С
Правильное название вещества О СН3 – СН2 – СН – С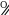
 СН3 – СН2 – С и СН2 – СООН – это:
СН3 – СН2 – С и СН2 – СООН – это:









