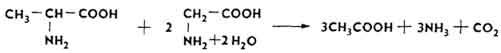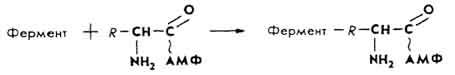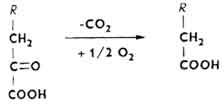Учебная дисциплина: Биохимия (2ч)
Тема Обмен белков: регуляция обмена и синтеза
Тип занятия: КУ
Цель занятия: изучить обменные процессы в организме: обмен белков;
развить представление о сложности и разнообразии биохимических процессов в организме, пластическом обмене; усвоить понятие о взаимосвязи и взаимопревращениях всех веществ в организме; синтез белков;
формировать целостное представление об обмене веществ.
Ход занятия
Организационный момент
Формулирование целей и задач урока
Актуализация знаний по теме
4. Объяснение нового материала с элементами закрепления.
5.Закрепление материала
6.Задание на дом. [ 1 ] c. [ 1 ] c. 423-443
3. Актуализация знаний по теме
3.1.1.Определение обмена веществ
3.1.2. Белки, структура и виды
3.1.3.Роль белков в организме
4.Объяснение нового материала с элементами закрепления.
4.1 Расщепление белков
4.2 Регуляция желудочного пищеварения
4.3 Обмен белков
4.4 Всасывание белков.
4.5 Промежуточный обмен.
4.6 Биосинтез белка
4.7Конечный обмен.
5. Закрепление материала
?Дайте характеристику основных групп и подгрупп аминокислот?
? Полноценные и неполноценные белки
? Основные этапы обмена белков в организме переваривание, всасывание, промежуточный (биосинтез и распад) и конечный обмены.
? Как регулируется белковый обмен в организме и чем проявляется патология обмена белков?
Рефлексия.
Материал к занятию
Обмен белков
Обмен белков - центральное звено всех биохимических процессов, лежащих в основе существования живого организма. Интенсивность обмена белков характеризуется балансом азота, так как основная масса азота организма приходится на белкиБогаты полноценными белками продукты животноводства, %:
| Говяжье мясо постное | 21,5 | Творог | 14,6 |
| Баранина постная | 19,8 | Сыры | 20-36 |
| Баранина жирная | 25 | Яйцо куриное | 12,6 |
| Свинина жирная | 16,5 | Молоко коровье | 3,5 |
| Рыба | 9-20 | Масло коровье | 0,5 |
Эталоном полноценного белка чаще всего служит казеин, содержащий все незаменимые аминокислоты.
Переваривание белков. В пищевом канале белки подвергаются расщеплению до аминокислот и простатических групп. Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
Функции соляной кислоты
денатурация белков пищи,
бактерицидное действие,
высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания,
превращение неактивного пепсиногена в активный пепсин,
снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,
после перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, панкреатического сока и желчи.
Пепсин
Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка
Оптимум рН для пепсина 1,5-2,0.
Связи, расщепляемые пепсином
Соляная кислота создает необходимую кислотность для каталитического действия ферментов. Так, у человека рН желудочного сока равен 1,5-2,0
В желудке происходит гидролитическое расщепление большинства белков
Пепсин легко расщепляет белки животного происхождения (казеин, миоглобин, миоген, миозин) и некоторые растительные белки, построенные в основном из моноаминодикарбоновых кислот (глиадин и глутелин злаков), за исключением кератинов шерсти, фиброинов шелка, муцинов слизи, овомукоидов, некоторых белков костей и хрящей.
Часть белков расщепляется другими протеолитическими ферментами желудочного сока, например, коллагены - желатиназой, казенны - реннином.
Под влиянием составных частей желудочного сока, прежде всего соляной кислоты и ферментов, белки в желудке гидролизуются до простетических групп, альбумоз, пептонов, полипептидов и даже аминокислот.
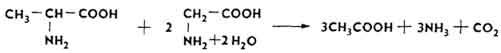
Так, мочевина под влиянием фермента уреазы, , расщепляется до аммиака и углекислого газа:
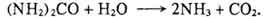
В тонкой кишке гидрокарбонаты секрета поджелудочной железы и кишечного сока нейтрализуют соляную кислоту: HCl + NaHCO3 → NaCl + H2CO3.
Угольная кислота под влиянием фермента карбоангидразы расщепляется до CO2 и H2O.
Около 30% пептидных связей белков расщепляется трипсином. Трипсин расщепляет пептидные связи, образованные - СООН-группами аргинина и лизина и - NН2-группами других аминокислот.
Почти 50% пептидных связей расщепляется химо-трипсином.
В составе сока поджелудочной железы есть коллагеназа (расщепляет коллаген) и эластиназа (гидролизует эластин). Деятельность ферментов активируется микроэлементами: Mg2+, Mn2+, Со2+ и др. Заключительный этап переваривания белков отражает схема:
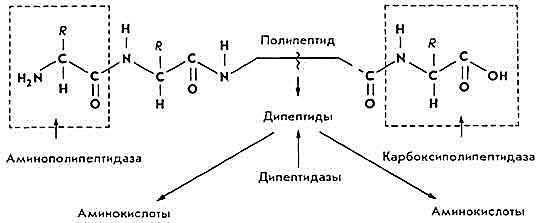
Переваривание белков происходит в полости кишок и на поверхности слизистой оболочки (пристеночное пищеварение).
Белки и их производные, не подвергшиеся расщеплению в тонкой кишке, в дальнейшем в толстой кишке подвергаются гниению
Возникает ряд ядовитых продуктов, которые всасываются через слизистую оболочку кишок в кровеносную и лимфатическую системы и разносятся по всему организму, отравляя его органы, ткани и клетки.
Всасывание белков. Белки всасываются в виде аминокислот, низкомолекулярных пептидов и простетических групп .Место всасывания - микроворсинки ворсинок эпителия слизистой оболочки тонкой кишки. В передвижении аминокислоты по клетке участвует белковый переносчик.
Промежуточный обмен. Продукты всасывания белков через систему воротной вены поступают в печень. Оставшиеся в крови после прохождения через печень аминокислоты из печеночной вены попадают в большой круг кровообращения и разносятся к отдельным органам, тканям и клеткам. В плазме крови содержится определенное количество аминокислот и полипептидов. Их содержание возрастает после приема пищи.
Плазма крови богата глутамином и глутаминовой кислотой.
Большая часть аминокислот расходуется на биосинтез белков, часть - на биосинтез биологически активных веществ (небелковых гормонов, пептидов, аминов и др.), часть, дезаминируясь, используется в качестве энергетического сырья и материала для биосинтеза липидов, углеводов, нуклеиновых кислот и др.
Биосинтез белка
Биосинтез белка протекает во всех органах, тканях и клетках. Наибольшее количество белка синтезируется в печени. Синтез его осуществляют рибосомы. По химической природе рибосомы - нуклеопротеиды, состоящие из РНК (50-65%) и белков (35-50%).
Рибосомы образуются самосборкой из предварительно синтезированных РНК и белков. Они являются составными частями гранулярной эндоплазматической сети, где происходит биосинтез и перемещение синтезированных молекул белка.
Рибосомы в клетке находятся в виде скопления от 3 до 100 единиц - полисом (полирибосом, эргосом). Рибосомы обычно соединены между собой своеобразной нитью, видимой под электронным микроскопом, - иРНК (рис.1)
Каждая рибосома способна синтезировать самостоятельно одну полипептидную цепь, группа - несколько таких цепей и молекул белка.
Рис. 1. Схема строения рибосомы, ассоциированной с иРНК и пептидил-тРНК (по Л. С. Спирину, Л. П. Гавриловой): 1 - 30S субъединица; 2 - 50S субъединица; 3 - иРНК; 4 - аминоацил-тРНК-фермент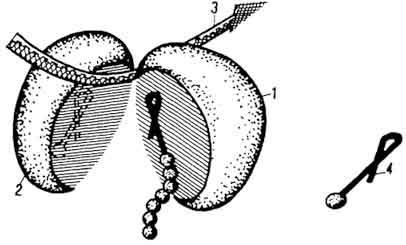
Примером крупной полирибосомной системы могут быть полисомы мышечной ткани, синтезирующие миозин. Полисома состоит из 60-100 рибосом и осуществляет биосинтез молекулы белка, которая состоит из 1800 аминокислотных остатков.
Биосинтез белка в клетке протекает через ряд стадий.
Активация аминокислот. В гиалоплазму из межклеточной жидкости в результате диффузии, осмоса или активного переноса поступают аминокислоты. Каждый вид амино- и иминокислоты взаимодействует со своим активирующим ферментом - аминоацилсинтетазой. Реакция активируется катионами Mg2+, Mn2+ и Co2+. Возникает активированная аминокислота.
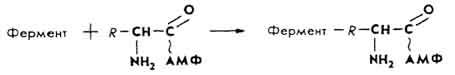
Транспортирование комплекса активированной аминокислоты с тРНК к рибосоме клетки.
Элонгация полипептидной цепи. Так создается первичная структура молекулы белка.
Терминация полипептидной цепи. Рибосома, на поверхности которой синтезировалась полипептидная цепь, достигает конца цепочки иРНК и "соскакивает" с него; к противоположному концу иРНК на ее место присоединяется новая рибосома, осуществляющая синтез очередной молекулы полипептида. Полипептидная цепь отсоединяется от рибосомы и выделяется в гиалоплазму.
Формируются вторичная, третичная и в ряде случаев четвертичная структуры белковой молекулы.
Обновление белков в организме. Белки находятся в динамическом состоянии, подвергаясь постоянным процессам синтеза и распада. В зависимости от степени повреждения белковой молекулы происходит ее частичное или полное обновление. Белки организма человека в целом обновляются в течение 135-155 сут. Белки печени, поджелудочной железы, стенки кишок и плазмы крови обновляются в течение 10 сут, мышц - 30, коллагена - 300 сут. Синтез молекулы белка в клетке протекает быстро - в течение 2-5 с. В организме взрослого человека ежесуточно синтезируется 90-100 г белка (1,3 г на 1 кг
Обмен отдельных аминокислот имеет определенные особенности.
Глицин. Участвует в ряде важнейших реакций биосинтеза. Так, из него образуются(Схема 1.)
В тканях печени глицин участвует в процессе обезвреживания ядовитых соединений - бензойной,
фенилуксусной кислот и фенолов, образует парные соединения, которые выводятся с мочой.
Аланин. Образуется трансаминированием пировиноградной кислоты Существует в виде α- и β-форм. Участвует в биосинтезе(Схема 2.).
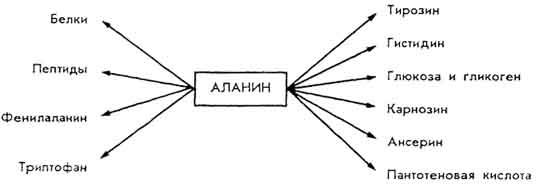
Часть аминокислот, не использованных в синтезе белков, и их производных, подвергается процессам распада до аммиака и карбоновых кислот. Аммиак обезвреживается в печени в орнитиновом цикле.
Из липопластических аминокислот (лейцин, изолейцин, аргинин, орнитин, лизин и др.) после дезаминирования образуется ацетоуксусная кислота - источник биосинтеза высших жирных кислот.α-Кетокислоты, образовавшиеся при окислительном дезаминировании аминокислот, декарбоксилируются и одновременно окисляются в жирные кислоты.
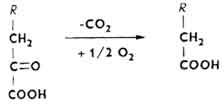
Образовавшаяся жирная кислота может подвергаться β-окислению, возникает ацетил-КоА - источник химической энергии или сырье для биосинтеза многих веществ.
Особенности промежуточного обмена сложных белков
Биосинтез сложных белков протекает аналогично биосинтезу протеинов. При этом формируются первичная, вторичная, третичная и четвертичная структуры белковой молекулы с присоединением соответствующей простетической группы.
Обмен хромопротеидов. В организме животных содержится ряд хромопротеидов: гемоглобин, миоглобин, цитохромы, геминовые ферменты и др.
Для них характерно наличие в составе молекулы гема. Наиболее подробно изучен биосинтез гемоглобина.
Основные компоненты молекулы гемоглобина образуются в органах кроветворения: красном костном мозгу, селезенке, печени. Глобин синтезируется из аминокислот обычным для белков путем. Образование гема происходит при участии ферментов через ряд стадий.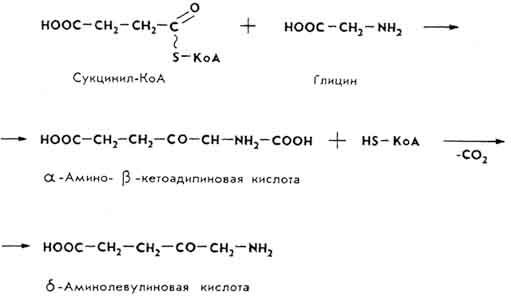
Из двух молекул δ-аминолевулиновой кислоты образуется порфобилиноген, который содержит пиррольное кольцо.(Рис.2.)
Порфобилиноген затем образует циклическое соединение из четырех пиррольных колец - уропорфирин.
В дальнейших превращениях из уропорфирина образуется протопорфирин. В молекулу протопорфирина под влиянием фермента гемосинтетазы включается железо (Fe2+) и возникает гем, который через остаток гистидина связывается с простым белком глобином, образуя субъединицу молекулы гемоглобина.
Гемоглобин составляет 90-95% сухой массы эритроцитов.
Обмен липопротеидов, гликопротеидов и фосфопротеидов мало чем отличается от обмена простых белков. При распаде молекулы сложного белка белковая часть расщепляется до аминокислот, а простетические группы (липид, углевод, фосфорные эфиры аминокислот) - до простых соединений.
Конечный обмен. У. газ выделяется легкими, вода - почками, с потом, в составе кала, с выдыхаемым воздухом, другие продукты обмена белков, особенно азотистые, выделяются в виде мочевины, парных соединений и т. д.
Превращение аммиака. Аммиак образуется при дезаминировании аминокислот, пуриновых и пиримидиновых оснований, никотиновой кислоты и ее производных, других азотсодержащих соединений. За сутки в организме человека дезаминируется 100-120 г аминокислот, образуется 16-19 г азота или 18-23 г аммиака.
Патология белкового обмена. Причиной нарушений белкового обмена бывает неправильно составленный рацион.Патология белкового обмена проявляется в различных формах.
Белковое голодание. Различают два вида белкового голодания: первичное, нет достаточного количества незаменимых аминокислот, и вторичное, вызванное заболеваниями пищевого канала, печени, поджелудочной железы. Нарушение обмена аминокислот. Проявляется в нескольких видах. Так, при некоторых болезнях печени (гепатитах, циррозах, острой желтой дистрофии) в крови и моче резко увеличивается содержание аминокислот - наступает алкаптонурия. При фенилкетонурии в моче появляется большое количество фенилпировиноградной кислоты. Часто причиной таких нарушений бывают авитаминозы.
Нарушение обмена сложных белков. Чаще всего они проявляются в виде нарушений нуклеинового и порфиринового обменов. В последнем случае нарушается обмен гемоглобина, миоглобина и других белков. Так, при различных поражениях печени (гепатитах, фасциолезе и др.) возникает гипербилирубинемия - содержание билирубина в крови возрастает до 0,3 - 0,35 г/л. Моча становится темной, в ней появляются большие количества уробилина, возникает уробилинурия.
Всемирная организация здравоохранения рекомендует принимать не менее 42 г полноценного белка в сутки – это физиологический минимум. Только в этом случае в организме наступает азотистое равновесие