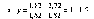Лекция.2. Основные законы химии
Закон постоянства состава веществ
Закон сохранения массы веществ
Закон Авогадро и следствия из него.
Расчетные задачи
Изучая состав различных веществ, французский ученый Ж. Пруст пришел к выводу, что массовые соотношения между элементами в сложных веществах всегда постоянны, независимо от способа их получения. Это значит, что атомы химических элементов взаимодействуют друг с другом только в определенных количественных соотношениях. Например, поваренная соль NaCl может быть получена разными способами, но она всегда состоит из атомов натрия и хлора, при этом массовое соотношение этих элементов будет всегда постоянное — 23 : 35,5.
На основании экспериментов был сформулирован закон постоянства состава (Ж. Пруст, 1799):
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Зная формулу вещества и атомные массы элементов, можно проводить различные вычисления по химическим формулам.
Пример 1. Вычислите массовую долю ω (%) меди в оксиде меди (II) СuО.
Решение. Имеем Мr(СuО) = 64 + 16 = 80, тогда ω(Си) = 64/80*100 % = 80 %.
Пример 2. Вычислите состав гидроксида меди(II) Сu(ОН)2 в массовых долях ω (%).
Решение. Имеем Mr (Cu(OH)2) = 98, тогда ω (Си) = 64 : 98* 100 % = 65,4 % Сu, ω (О) = 2*16 : 98* 100 % = 32,6 % О, ω (Н) = 2 * 1: 98 * 100 % = 2 % Н.
Пример 3. Выведите формулу вещества, содержащего фосфор (массовая доля 56,4%) и кислород (массовая доля 43,6%).
Решение. Пусть х — число атомов фосфора в соединении, у — число атомов кислорода. Так как масса атома фосфора равна 31 а.е.м., а масса атома кислорода — 16 а.е.м., масса всех атомов фосфора, содержащихся в молекуле, будет равна 31х, атомов кислорода — 16у. Отношение этих масс выражает состав всего вещества. Этот же состав выражается соотношением 56,4:43,6.

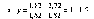
Приравняв оба отношения, получаем пропорцию:
Чтобы выразить отношение х:у целыми числами, разделим оба члена отношения на меньший из них:
Приведем эти соотношения к целым числам — 2:3. Таким образом, х = 2, у = 3. В молекуле вещества на каждые два атома фосфора приходится три атома кислорода; получаем формулу — Р203.
Основываясь на количественном методе изучения химических реакций, М.В.Ломоносов в 1748 г. открыл закон сохранения веса веществ. В настоящее время говорят о сохранении при химических реакциях массы веществ, и закон формулируется следующим образом:
Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
При химических реакциях изменяются вещества, т. е. одни молекулы превращаются в другие, но число атомов и их общая масса не изменяются. Правильно составленное уравнение реакции имеет большое значение. По уравнению реакции можно рассчитать, сколько нужно взять исходного вещества для получения строго определенного количества необходимого продукта, или узнать, сколько получится нового продукта из данного количества вещества.
Пример 4. При растворении в серной кислоте загрязненного магния массой 6 г получен водород объемом 4,48 л при нормальных условиях. Определите массовую долю ω (%) примесей.
Решение. Записываем уравнение реакции
Mg + H2S04 = MgS04 + Н2
По уравнению реакции видно, что при растворении 1 моля магния выделяется 1 моль, или 22,4 л, водорода (н.у.), тогда

m(Mg) = Mn, где n = х; m(Mg) = 24 г/моль • 0,2 моль = 4,8 г.
Следовательно, в 6 г смеси содержится 6 г — 4,8 г = 1,2 г примесей, что составляет: ω (примесей) = 12 : 6 • 100 % = 20 %.
В 1811 г. итальянский ученый А. Авогадро выдвинул гипотезу, которая была впоследствии подтверждена большим числом экспериментальных данных и названа законом Авогадро: в равных объемах газов при одинаковых условиях (давлении и температуре) содержится равное число молекул. Из закона Авогадро можно вывести следствие: при нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л.
Следствия из закона Авогадро:
1 следствие: Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 * 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л. Нормальные условия – это давление 1 атм, температура 0о.
Такой объём называется молярным объёмом и обозначается Vm.
Молярный объём – это отношение его объема к количеству вещества.
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
n = V / Vm = N / Na = m / M
M = ρVm
Следствие 2: Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью
D=M1/M2
Пример 5. Рассчитайте относительную плотность хлора по аммиаку.
Решение. Имеем М(С12) = 71 г/моль, M(NH3) =17 г/моль, следовательно,
D(NH3) = 71г/моль/17 г/моль =4,18.
Пример 6. Относительная плотность аммиака по воздуху равна 0,586. Рассчитайте молярную массу аммиака.
Решение. Имеем M(воздух) = 29 г/моль, Dвоздуx(NH3) = 0,586, следовательно
М(NH3) = 29 г/моль*0,586 = 17 г/моль.
![]()