
Определите, о каком элементе и его разновидностях идёт речь? Он имеет несколько аллотропных модификаций, бывает мягким и хрупким, серым и малопривлекательным, а может быть очень твёрдым и сверкающим.





Каждый из живущих вблизи Неаполя хоть раз слышал о Собачьей пещере (Grotta del Cane), а многие и бывали в ней. Слава пещеры построена на костях собак, принадлежащих слишком любопытным владельцам. Человек мог беспрепятственно войти в неё и выйти, а его четвероногий спутник – нет. И чем дольше животное находилось в пещере, тем больше был шанс, что оно погибнет. Это место известно с давних пор. В XX веке люди поговаривали о злых духах, скрывающихся от солнечного света во мраке подземелья, что душили собак. В чём-то суеверия были верны. Собаки и правда были задушены, но не нечистой силой, а природной аномалией.
Почему при входе в эту пещеру животные гибнут, а люди остаются невредимыми???

Кислородные соединения углерода
Химик не такой должен быть, который дальше дыму
и пеплу ничего не видит, а такой, который на основании
опытных данных может делать теоретические выводы.
М.В. Ломоносов

Цель урока: познакомить со свойствами кислородных соединений углерода, их способами получения и применением.
Задачи:
1 . Обучающая: исследовать и усвоить физические, химические, специфические свойства оксидов углерода и способы их получения.
2 . Развивающая: формировать научное мировоззрение, умение устанавливать взаимосвязь состава, строения и свойств изучаемых веществ, физиологическое действие на организм человека.
3. Воспитательная: формировать навыки самостоятельной работы, умение аргументировано высказывать свое мнение, продолжить развитие навыков самообразования.

Заполните таблицу
Свойства
Оксид углерода ( II)
Формула
Оксид углерода (IV)
Агрегатное состояние
Цвет
Запах
Токсичность
Характер оксида
Тип связи
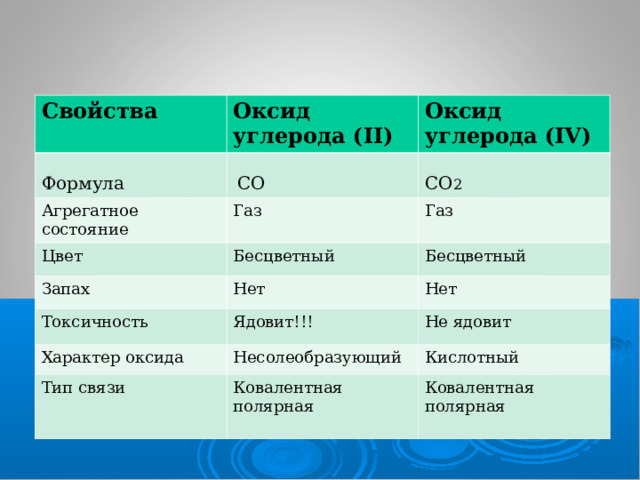
Свойства
Оксид углерода ( II)
Формула
Оксид углерода (IV)
СО
Агрегатное состояние
СО 2
Газ
Цвет
Бесцветный
Запах
Газ
Токсичность
Бесцветный
Нет
Нет
Ядовит!!!
Характер оксида
Не ядовит
Несолеобразующий
Тип связи
Кислотный
Ковалентная полярная
Ковалентная полярная
+

Химические свойства
Угарного газа
Углекислого газа
2 СО+О 2 = 2 СО 2
2. С оксидами металлов
СО +С uO= Cu+CO 2
3. c хлором
CO +Cl 2 = COCl 2
CaO + CO 2 = CaCO 3
2. с основаниями
CO 2 + Ca(OH) 2 → CaCO 3 +H 2 O
3. c водой
CO 2 + H 2 O = H 2 CO 3

Физкультминутка

Опыт 1. Получение углекислого газа:
CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2

Получение
CO угарный газ
CO 2 углекислый газ
2 C +O2( недо c т) = 2CO
2. Восстановление углекислого газа
CO2 + C= 2CO
C +O2( избыток) = CO 2
2. Действие кислот на соли карбонаты
CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2
3. Разложение карбонатов
MgCO 3 = MgO + CO 2

Качественная реакция:
CO 2 + Ca(OH) 2 → CaCO 3 + H 2 O
CaCO 3 + CO 2 + H 2 O → Ca(HCO 3 ) 2


В результате какой химической реакции формируются в пещерах СТАЛАКТИТЫ И СТАЛАГМИТЫ?

При содержании 0,08 % этого газа во вдыхаемом воздухе человек чувствует головную боль и удушье. При повышении его концентрации до 0,32 % возникает паралич и потеря сознания (смерть наступает через 30 минут). При концентрации выше 1,2 % сознание теряется после двух—трёх вдохов, человек умирает менее чем через 3 минуты.
О каком газе идёт речь?

Угарный газ (СО)содержится в выхлопных газах автомобилей

Воздух, окутывающий Землю, содержит около 3 млрд. т. СО 2

Горение угарного газа

«Сухой лед» для хранения мороженного

Для тушения пожаров

Создание «дыма» на сцене

Производство газированных напитков

Угольная кислота ( Н 2 СО 3 )
- Кислородосодержащая, нестойкая кислота, легко разлагается на исходные компоненты – углекислый газ и воду:
- Н 2 СО 3 ↔СО 2 + Н 2 О

Соли угольной кислоты
- Карбонаты( CaCO 3 , Na 2 CO 3 )
- Гидрокарбонаты (Ca(HCO 3 ) 2 , NaHCO 3 )



Домашнее задание
- Параграф 21
- Творческое задание: составить ментальную карту, придумайте загадку о практическом применении любого из кислородных соединений углерода.













































