Просмотр содержимого документа
«Периодическая система элементов.»

Периодическая
система элементов

Все элементы в системе расположены в порядке увеличения заряда ядра (= количеству протонов, следовательно, = количеству электронов)
Горизонтальные ряды — это ПЕРИОДЫ .
Их 7 штук — по числу энергетических уровней атома.
Номер периода


Первый период состоит из атомов, в которых электронная оболочка состоит из одного уровня (элементы выделены красным)
во втором периоде — из двух («красные» и «желтые»)
в третьем — из трех («красные», «желтые» и один пустой слой) , в четвертом — из четырех и т.д.
Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень

В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют
один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем уровне имеют 2 (в первом периоде) или 8 электронов
(во всех последующих) — атомами благородных газов.
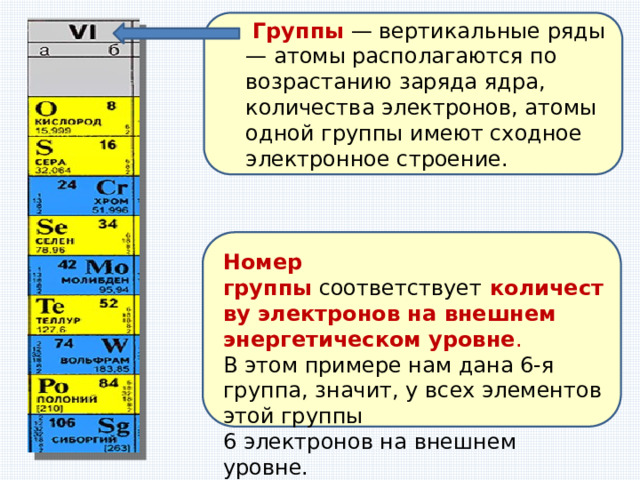
Группы — вертикальные ряды — атомы располагаются по возрастанию заряда ядра, количества электронов, атомы одной группы имеют сходное электронное строение.
Номер группы соответствует количеству электронов на внешнем энергетическом уровне .
В этом примере нам дана 6-я группа, значит, у всех элементов этой группы
6 электронов на внешнем уровне.
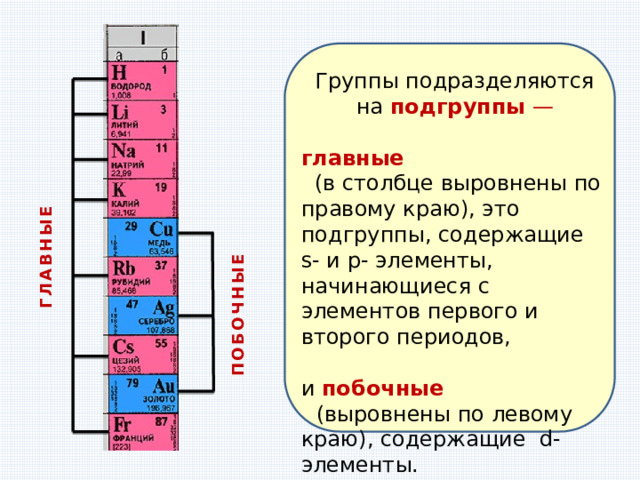
ГЛАВНЫЕ
ПОБОЧНЫЕ
Группы подразделяются на подгруппы —
главные
(в столбце выровнены по правому краю), это подгруппы, содержащие s- и p- элементы, начинающиеся с элементов первого и второго периодов,
и побочные
(выровнены по левому краю), содержащие d-элементы.

Максимальное число электронов на энергетическом уровне — 8 . Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Максимальное число электронов на уровне:
S - 2 электрона p - 6 d - 10
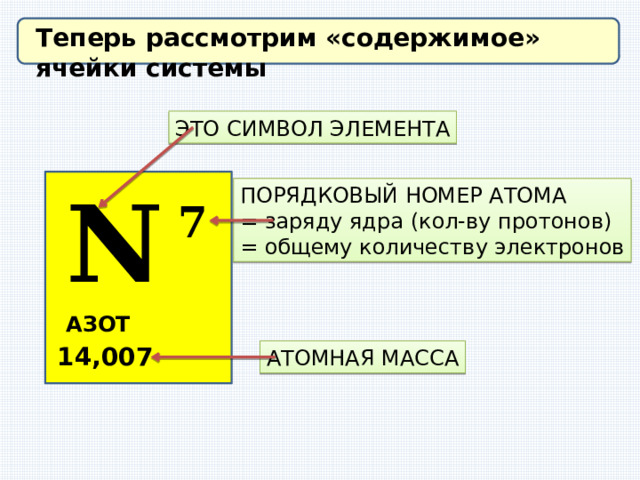
Теперь рассмотрим «содержимое» ячейки системы
ЭТО СИМВОЛ ЭЛЕМЕНТА
N
ПОРЯДКОВЫЙ НОМЕР АТОМА
= заряду ядра (кол-ву протонов)
= общему количеству электронов
7
АЗОТ
14,007
АТОМНАЯ МАССА

располагается в 5-ой группе, значит, на внешнем энергетическом уровне у него 5 электронов
находится во 2-ом периоде, значит в атоме
2 энергетических уровня
Так по содержимому периодической системы можно проанализировать любой элемент — определить заряд его ядра, количество электронов, количество энергетических уровней и атомную массу.


























