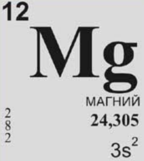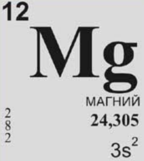Просмотр содержимого документа
«Tema: Magniý elementi.»
Tema:Magniý.
Meýilnamasy:
1.Magniýniň açylyşy.
2.Magniýniň fiziki häsiýetleri.
3.Magniýniň himiki häsiýetleri.
4.Magniýniň izotoplary.
5.Magniýniň alnyşy.
6.Magniýniň ulanylyşy.
7.Magniý elementiniň önümleri.
Magniý elementi tebigatda. Bu elementiň atomynda iki sany walent elektronlary bolup, olar s- orbitalda ýerleşendirler. Magniý elementiň emele getirýän birleşmeleriniň ösümlikleriň we haýwanlaryň ýaşaýşy üçin ähmiýeti örän uludyr(hlorofil).
Bu elementiň senagat ähmiýetli minerallarynyň birnäçesi(magnezit, dolomit, hek daşy, gips we beýlekiler) Türkmenistanda hem duş gelýärler.
Magniý elementiň suwda ereýän duzlary tebigy suwuň düzüminde duş gelýär we suwuň talhlygyny emele getirýär.
Magniý elementiň alnyşy. Magniý elementi 1808-nji ýylda iňlis alymy G. Dewi tarapyndan açyldy. Bu elementi almagyň iki dürli usullaryndan peýdalanylýar.
1. Magniý we kalsiý hloridleriniň rasplawyny elektroliz etmek usuly bilen alynýar:

2. Magniý we kalsiý elementleri ýokary temperaturada(1200–2000 °C) olaryň birleşmelerinden gaýtaryjylary täsir etdirmek bilen hem alynýar:


Şonda emele gelen gaz halyndaky metallar sowadylyp, kondensirlenýär. Reaksiýa inert gurşawda geçirilýär.
Magniý elementiň fiziki häsiýetleri. Magniý kümüşsöw ak reňkli, ýalpyldawuk metaldyr. Magniý howada durnuklydyr. Sebäbi bu metalyň üstünde ýukajyk we dykyz oksid gatlagy emele gelýär. Şol gatlak magniý metalyny mundan beýläk okislenmekden gorap saklaýar.
Magniý elementiniň himiki häsiýetleri. Magniý himiki taýdan işjeň metaldyr. Ol birleşmelerinde walentliligi hemişe II we okislenme derejesi+2-ä deň. Bu elementiň
Magniý we aşgar- ýer metallary kislorod bilen reagirleşýärler. Olar gyzdyrylanda howada ýanýarlar. Olar howada ýananda, adatça, nitritleriniň we oksidleriniň garyndysy emele gelýär:
2Mg + O2 → 2MgO (600–650°С);
2Ca + O2 → 2CaO (300°С).
Magniý we aşgar-ýer metallary gyzdyrylanda (150–400°С), galogenler we kükürt bilen hem reagirleşýärler. Şonda olaryň degişli elementler bilen birleşmeleri emele gelýär:
Mg + Cl2 → MgCl2 (çygly şertde, otag temperaturasynda:

Magniý we aşgar- ýer metallary metallaryň elektrohimiki güýjenme hatarynda wodoroddan öňde ýerleşendirler. Şonuň üçin olar kislotalaryň gowşadylan erginlerinden wodorody gysyp çykarýarlar. Şonuň ýaly- da, magniý gyzdyrylanda we beýleki elementler otag temperaturasynda suwuň düzüminden hem wodorody gysyp çykarýarlar:

Magniý azot kislotasynyň ergini bilen reagirleşýär:
4Mg + 10HNO3 (gowş. ergin) → 4Mg(NO3)2 + N2O↑ + 5Н2О;
Magniý elementiniň RMgX we R2Mg düzümli magniorganiki birleşmeleri emele getirmek häsiýeti bar. Şol birleşmelerden Grinýaryň reaktiwiniň ähmiýeti uludyr. Grinýaryň reaktiwi birnäçe organiki maddalaryň sintezinde ulanylýar. Grinýaryň reaktiwi magniý bilen alkilgalogenidleriň dietilefirdäki ergininiň özara reaksiýasy netijesinde alynýar:
RX + Mg → RMgX;
C3H7Cl (suwuk) + Mg(gaty) → C3H7MgCl(gaty),
bu ýerde: R – uglewodorod radikaly; X – galogen atomy.
Magniý elementiň möhüm birleşmeleri we olaryň häsiýetleri. Magniý we aşgar-ýer metallarynyň möhüm birleşmelerine olaryň oksidleri, gidroksidleri we duzlary degişlidirler. Olaryň oksidleri EO we gidroksidleri E(OH)2 düzümli bolup, olaryň esas häsiýeti bardyr.
Olaryň birleşmeleriniň, aýratyn-da, metalloorganiki birleşmeleriniň durmuşda ähmiýeti uludyr. Ol ösümliklerdäki we käbir mikroorganizmlerdäki hlorofiliň düzümine girýär (39- njy surat).