Разработка урока химии в 8 классе
Автор: Тукач Марина Михайловна, учитель химии ЧОУ СОШ «ООЦ «Школа»
г.Тольятти Самарской области
Урок-обобщение «Уравнения химических реакций»
Цель урока. Обобщить знания о химических реакциях, об условной записи химической реакции с помощью химических формул, систематизировать умение составлять уравнения химических реакций, провести диагностическую работу.
Оборудование и реактивы. Две колбы, мячики из фольги, магниевая лента, Zn , Cu, Fe металлические, MnO2,р-ры HCl, CuSO4, FeSO4, NaOH, H2SO4, KOH, Na2CO3, Na2SO4, Н2О2, пробирки, спиртовка, спички.
План урока.
1. Организационный момент.
2. Проверка домашнего задания.
3. Вводное слово учителя о цели и задачах урока.
Учитель. Мы с вами знаем, что в природе происходят физические и химические явления. Давайте проверим, научились ли вы их отличать друг от друга. Вспомним, какие явления называют химическими, а какие физическими с помощью игры: « Кто забросит больше мячей?» Для этого разделимся на команды мальчиков и девочек. Правильным будет ответ с указанием признаков явления. В чьей команде будет последний правильный ответ, та команда и выиграет. ( На столе две колбы и мячики из фольги)
Сформулируем определения.
Какие явления называются физическими?
Какие явления называются химическими?
Чем же они отличаются друг от друга?
Вывод - главный признак химических реакций - образование новых веществ с новыми свойствами.
Учитель. У вас у всех на столе задание №1, пожалуйста, выполните в парах, дописав недостающие признаки химических реакций.
Признаки химических реакций
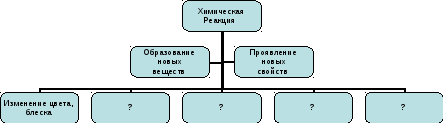
Вывод: химические реакции сопровождаются определенными признаками.
Учитель. Для протекания реакций нужны определенные условия. Какие? Перечислим условия протекания химических реакций.
Учитель. В чем состоит сущность химических реакций? Посмотрите, пожалуйста, на задание №2 и ответьте на вопрос – почему сохраняется равновесие на картинке?

Кто первым открыл закон сохранения массы веществ? В чем сущность этого закона?
Вывод: сущность химической реакции состоит в перегруппировке атомов, число атомов каждого элемента остается неизменным, меняется лишь состав молекул.
Учитель. Химические реакции можно выразить с помощью химических уравнений, которые и составляют в соответствии с законом сохранения масс веществ.
А что такое химическое уравнение и каковы правила его составления?
Посмотрите на таблицу №1. Перед вами алгоритм составления химического уравнения. Проговорим его.

 ХИМИЧЕСКИЕ УРАВНЕНИЯ
ХИМИЧЕСКИЕ УРАВНЕНИЯ
| Алгоритм составления химического уравнения |
Уравнение химической реакции между водородом и кислородом |
| 1. Составить схему взаимодействия: слева записать формулы веществ, вступивших в реакцию, справа - получившихся, соединив их знаком «+». | 1. Н2 + О2 = Н2О В реакцию вступают 2 простых вещества, получается 1 сложное вещество. |
| 2. Подобрать коэффициенты для каждого вещества так, чтобы число атомов каждого элемента в левой части было равно числу атомов этого элемента в правой части. |
2. а) уравнять число атомов кислорода, поставив коэффициент 2 перед формулой воды; б) уравнять число атомов водорода, поставив коэффициент 2 перед формулой водорода. 2Н2 + 02 = 2Н2О |
| 3. Проверить число атомов каждого элемента в левой и правой частях уравнения. Поставить знак равно «=». | n (Н) = 2∙2=4 n (0) =1∙2=2 2Н2 + 02 = 2Н2О |
Учитель. По числу, составу исходных веществ и продуктов реакции какие типы реакций различают?
Основные признаки химических реакций мы вспомним на демонстрационных опытах. Ваша задача определить тип реакции, написать химическое уравнение этой реакции, уравнять ее, расставив коэффициенты. (К доске вызываются по одному ученику, они записывают уравнения химических реакций, которые демонстрирует учитель, и отвечают на вопросы, в случае сомнения или ошибки помогает весь класс)
Mg + O2 =
Zn + HCl =
Cu + HCl =
Почему нельзя осуществить? 1-ое правило использования электрохимического ряда металлов
CuSO4 + Fe =
Cu + FeSO4 =
Почему нельзя осуществить? 2-ое правило использования электрохимического ряда металлов
NaOH + H2SO4 =
Только ли щелочи вступают в реакцию нейтрализации? Как получить нерастворимое основание?
Cu SO4 + KOH =
Cu(OH)2 + H2SO4 =
Cu(OH)2 =
Н2О2 =
Что надо сделать, чтобы ускорить реакцию?
Na2CO3 + HCl =
Идет ли эта реакция до конца? Какие еще реакции обмена идут до конца?
Na2SO4 + HCl =
Идет ли эта реакция до конца? Почему?
Учитель. Чтобы выяснить, усвоился ли материал по определению типа реакций, выполним в парах задание №3: «Куча мала»
4Al + 3O2 = 2Al2O3 MgCO3 = Mg + CO2 Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3 Cu + 2AgNO3 = Cu(NO3)2 + 2Ag 2HgO = 2Hg + O2 2Na + S = NA2S 2KClO3 = 2KCl + 3O2 CuO + H2SO4 = CuSO4 + Н2О Fe2O3 + 3Mg = 3MgO + 2Fe Na2O + + Н2О = 2NaOH
| Укажите цифрами а) уравнения реакций соединения: …………. б) уравнения реакций разложения:………… в) уравнения реакций замещения:…………. г) уравнения реакций обмена:……………..
|
В это время у доски один ученик по рисунку выполняет задание №4 « Написать уравнения происходящих реакций».
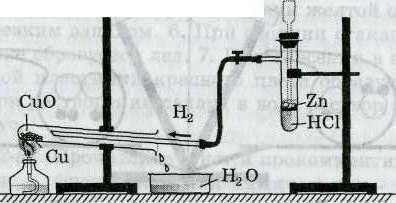
Учитель проверяет выполнение заданий, комментирует ошибки.
Учитель совместно с учащимися формулирует выводы по уроку: в природе происходят физические и химические явления. Химические явления (реакции) сопровождаются определенными признаками. Для протекания реакций необходимы определенные условия. Сущность химических реакций состоит в перегруппировке атомов. Химические реакции можно выразить с помощью химических уравнений, которые составляют в соответствии с законом сохранения массы. В химической реакции число атомов каждого химического элемента остается неизменным: сколько их было до начала реакции, столько же будет и по окончании. По числу, составу исходных веществ и продуктов реакции различают реакции соединения, разложения, замещения и обмена. Составляя уравнение реакции, нельзя забывать о расстановке коэффициентов, каждый из которых можно рассматривать как количество вещества, участвующего в реакции.
Учитель сообщает, что по уравнению химических реакций можно производить расчеты, что и будут учащиеся изучать на последующих уроках.
6. Задание на дом: к усвоению темы «Расчеты по химическим уравнениям» повторить §15 «Количество вещества» и § 16 «Молярный объем газов».
Учитель. Сейчас все полученные знания по теме «Уравнения химических реакций» используем при выполнении заданий диагностики (7-10 минут). Не забываем об уровнях сложности заданий.
Диагностика
Вариант 1.
1. Перепишите схему уравнения реакции, расставьте коэффициенты, укажите тип:
KClO3 → KCl + O2
2. Перепишите схему уравнения реакции, вместо знака вопроса напишите формулу соответствующего вещества, расставьте коэффициенты, укажите тип:
P + ? → P2O5
3. Напишите уравнение химической реакции по следующей схеме, расставьте коэффициенты, укажите тип: оксид хрома (ΙΙΙ) + алюминий → хром + ?
4. Напишите уравнение химической реакции по следующей схеме, расставьте коэффициенты, укажите тип: нитрат серебра + хлорид магния → ? + ?
Вариант 2.
1. Перепишите схему уравнения реакции, расставьте коэффициенты, укажите тип:
Li + N2 → Li3N
2. Перепишите схему уравнения реакции, вместо знака вопроса напишите формулу соответствующего вещества, расставьте коэффициенты, укажите тип:
AgCl → Ag + ?
3. Напишите уравнение химической реакции по следующей схеме, расставьте коэффициенты, укажите тип: оксид кремния(ΙV) + магний → кремний + ?
4. Напишите уравнение химической реакции по следующей схеме, расставьте коэффициенты, укажите тип: хлорид бария + сульфат натрия → ? + ?










 ХИМИЧЕСКИЕ УРАВНЕНИЯ
ХИМИЧЕСКИЕ УРАВНЕНИЯ










