Многоатомные спирты.
(Глицерин)
МАОУ ДСОШ №2 Омельянчук Т.Е.
Цели урока:
Закрепить полученные знания о спиртах.
Сформировать понятие об особых свойствах многоатомных спиртов через организацию исследовательской деятельности на уроке
Познать новое (многоатомные спирты) в сравнении с одноатомными, найти, в общем частное, в частном общее.
Задачи урока:
определение сущностных характеристик многоатомных спиртов
развитие навыков анализа, прогностических качеств ума при выполнении химического эксперимента по распознанию функциональных групп многоатомных спиртов
создание условий для применения знаний и умений в практической деятельности и повседневной жизни
создание условий для осознания необходимости грамотного отношения к своему здоровью и окружающей среде.
Реактивы: растворы сульфата меди (II), гидроксида натрия, глицерин, жев. резинка, вода.
Оборудование: медиапроектор, презентация, пробирки.
Учебная задача урока: Изучение свойства многоатомных спиртов во взаимозависимости от строения и свойств данных вещества.
Тип урока: изучение нового материала.
Ведущие методы обучения: проблемно-поисковая беседа, химический эксперимент, частично-поисковое исследование.
Дидактическое обеспечение: карточки “Инструктивная карта ”, оборудование для проведения лабораторных и демонстрационных опытов, тесты
Формируемые общеучебные знания и умения:
знание правил по технике безопасности при проведении химических опытов
развитие умений способов умственной деятельности;
знания важнейших органических веществ, используемых человеком в жизни.
развитие умения проводить простейший химический эксперимент, владеть методологией учебного исследования; использовать свои знания в повседневной жизни.
План урока
1. Состав и классификация многоатомных спиртов.
2. Получение глицерина и этиленгликоля.
3. Физические свойства глицерина и этиленгликоля.
4. Химические свойства глицерина:
а) сходство с одноатомными спиртами,
б) качественная реакция на многоатомные спирты.
5. Применение.
Ход урока
I. Организационный момент. Актуализация знаний учащихся.
Учитель: Итак, ребята, мы начали изучать кислородсодержащие органические соединения. И первый класс, с которым вы познакомились – это класс спирты.
- Какие вещества относятся к спиртам?
- Какие спирты вы уже изучили? Или
Учащимся предлагается тест с последующей самопроверкой (Приложение 1,2)
(ключ на доске)
II. Изучение нового материала на уроке химии. Слайд 1
Учитель химии: Сегодня на уроке мы познакомимся с многоатомными спиртами, с их представителями, с особенностями их химических свойств, узнаем, где применяют многоатомные спирты. Слайд 3
Определение: Многоатомными называются спирты, содержащие две или несколько гидроксильных групп. Слайд 4
Классификация многоатомных спиртов.
двухатомные трехатомные многоатомные
диолы триолы полиолы
(гликоли) (глицерины)
(слайд презентации по химии сопровождается комментарием учителя о классификации спиртов и названии групп спиртов)
В корень названия ставится «имя» предельного углеводорода – этан, пропан
алкана с таким же числом атомов углерода, что и в спирте.
Приставкой –ди, -три, и т.д. указывают число гидроксильных групп.
( по ходу рассказа учителя на слайде появляются соответствующие приставки, суффиксы, числа.)
Указывают суффикс – «визитную карточку» спиртов – ол.
Через черточку показывают положение гидроксильных групп.
Как вы уже заметили. Некоторые многоатомные спирты имеют исторические названия
Этандиол – называют этиленгликолем Слайд 4
Пропантриол – глицерином. Он был открыт в 1779 году шведским химиком Шееле.
Получение многоатомных спиртов
3. Физические свойства многоатомных спиртов.
У каждого на столе есть пузырек с глицерином. Рассмотрите это вещество и опишите его физические свойства по плану на столе Слайд 7 кроме последнего пункта
агрегатное состояние
подвижность
прозрачность
цвет
наличие запаха
растворимость
(Обсуждение физических свойств до растворимости)
Лабораторный опыт: Физические свойства глицерина
К одному мл воды в пробирке прилейте равный объем глицерина и взболтайте смесь. Затем добавили еще столько же воды. Что можно сказать о растворимости его в воде? Опишите свойства, которые вы наблюдаете.
Глицерин – бесцветная, сиропообразная жидкость сладковатого вкуса, хорошо растворимая в воде. Слайд 8
Сравниваем со свойствами одноатомных спиртов – аналогичны
Почему?
Есть ли различия в физических свойствах одноатомных и многоатомных спиртов?
Да! Слайд 9
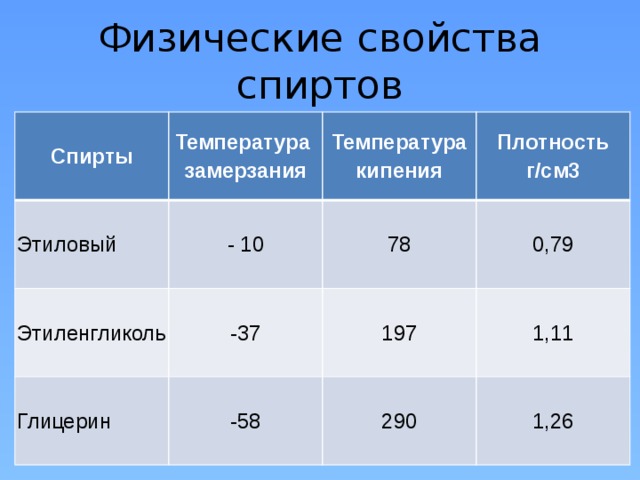
| Спирты | Температура замерзания | Температура кипения | Плотность г/см3 |
| Этиловый | - 10 | 78 | 0,79 |
| Этиленгликоль | -37 | 197 | 1,11 |
| Глицерин | -58 | 290 | 1,26 |
Учитель. Подумайте в чем причина различия физических свойств одноатомных и многоатомных спиртов?
Следует вывод: число гидроксогрупп в спирте оказывает влияние на их физические свойства (за счет водородных связей).
В молекуле глицерина имеются 3 гидроксогруппы, значит число атомов водорода, способных к образованию водородной связи в 3 раза больше, чем в молекулах одноатомных спиртов. Поэтому, сила межмолекулярной связи в случае глицерина гораздо больше, чем в молекулах одноатомных спиртов. В случае глицерина необходимо более сильное нагревание, более высокая температура, для того чтобы ослабить связи между молекулами до такой степени, чтобы они перешли в газообразное состояние. По этой причине многоатомные спирты более вязкие и температуры кипения их выше, чем у соответствующих одноатомных спиртов.
Вывод: число гидроксогрупп обуславливает физические свойства (за счет водородных связей).
Учитель. Как вы думаете, какие физические свойства многоатомных спиртов нашли своё применение в народном хозяйстве и в быту?
Какие?
Сообщение учащегося:
В качестве антифризов Водные растворы этиленгликоля и глицерина замерзают при низких температурах, поэтому их используют в качестве антифризов – жидкостей с низкой температурой замерзания, применяемых для охлаждения двигателей внутреннего сгорания.
В парфюмерной промышленности
В кожевенном производстве
Сорбит и глицерин используется в пищевой промышленности
Химические свойства.
Учитель. Какие химические свойства характерные для одноатомных спиртов?
Учащиеся перечисляют свойства: реакция горения, реакция замещения водорода гидроксогруппы на щелочной металл, реакция обмена всей гидроксогруппы на галоген (с галогеноводородными кислотами и другие).
Учитель. Проблемный вопрос. А будут ли эти свойства характерны для многоатомных спиртов?
Чтобы ответить на это вопрос смотрим видео демонстрационный эксперимент.
1. Взаимодействие глицерина с натрием: ВИДЕО Слайд 10
2СН2ОН–СНОН-СН2ОН + 6Nа = 2СН2ОNа–СНОNa-СН2ОNа +3Н2  глицерат натрия
глицерат натрия
Объясните проявление глицерином слабо выраженных кислотных свойств.
Взаимодействие глицерина с галогеноводородами (происходит замещение гидроксогрупп). Слайд 11
СН2ОН – СНОН – СН2ОН + 3НСI = СН2СI – СНСI – СН2СI + 3Н2О
Трихлорпропан
Прежде чем записать следующее свойство глицерина, послушаем краткую историческую справку...
За год до смерти Нобель сам, без помощи адвокатов, составил завещание. Он считал, что унаследованное богатство плодит бездельников, поэтому друзьям и родственникам завещал немного. «Капитал мои душеприказчики должны перевести в ценные бумаги, создав фонд, проценты с которого будут выдаваться в виде премии тем, кто в течение предшествующего года принес большую пользу человечеству...»
За счет, какого изобретения у Нобеля образовался приличный капитал? (динамит)
Как объяснить следующее четверостишье
Я пью его в мельчайших дозах,
На сахар капаю раствор
А он способен бросить в воздух
Любую из ближайших гор.
О каком веществе идет речь?
Что является основой данного вещества? Трихлорпропан
Реакция этерификации: Слайд 12
СН2ОН – СНОН – СН2ОН + 3НNO3 = СН2NO2 – СН NO2 – СН2 NO2 + 3Н2О
Что нам известно про нитроглицерин? Сообщение учащегося:
Его получают реакцией этерификации глицерина, взрывное действие реакции разложения нитроглицерина объясняется образованием большого объёма газов из небольшого количества исходного вещества. Нитроглицерин – бризантное взрывчатое вещество, он легко взрывается от удара или детонации. Для безопасности его используют в виде динамита – смеси с инфузорной землёй. Открыл его Альфред Нобель. А в медицине применяется однопроцентный спиртовой раствор нитроглицерина как сосудорасширяющее средство.
Производство нитроглицерина разработал русский ученый Николай Николаевич Зинин в 1853 году. Но предложения о строительстве промышленных предприятий по производству снарядов и мин не заинтересовали ни царское правительство, ни артиллерийское ведомство. Только в 1863 году нитроглицерин начали успешно применять для подземных и подводных взрывов. Ученик Зинина – Альфред Нобель – продолжил работы своего учителя и в 1867 году запатентовал способ производства динамита. Будучи членом семьи знаменитых и богатых промышленников он стал организатором и совладельцем многих предприятий по производству взрывчатых веществ в разных странах мира.
Учитель.На основании всего изложенного ранее, какой вывод о химических свойствах многоатомных спиртов можно сделать?
Вывод: Как вещества, содержащие гидроксогруппы, многоатомные спирты имеют сходные свойства с одноатомными спиртами. Обладают более выраженными кислотными свойствами, чем одноатомные спирты.
Качественная реакция на глицерин
Учитель. Проблемный вопрос. Должно ли вызвать появление новых химических свойств увеличение числа гидроксогрупп в молекулах многоатомных спиртов?
Чтобы разрешить эту проблему проведем лабораторную работу:
1. К двум мл раствора щелочи в пробирке прибавьте несколько капель раствора сульфата меди (II). Что наблюдаете? Напишите уравнение реакции.
CuSO4 + 2 NаOH = Cu(OH)2 + Nа2 SO4
+ Nа2 SO4
Наблюдали образование синего осадка гидроксида меди (II).
2. К образовавшемуся осадку гидроксида меди (II) прилейте глицерин и смесь встряхните. Какие изменения произошли?
Ученик. Осадок растворяется и образуется раствор ярко-синего цвета, глицерат меди (II).
Учитель. Это качественная реакция на многоатомные спирты. Слайд 13
Уравнение:

Что обусловливает качественные изменения при переходе от одноатомных спиртов к многоатомным?
Вывод: Особенностью многоатомных спиртов является большая подвижность атомов водорода в гидроксогруппе и легкая окисляемость радикала.
Причина: влияние этих групп друг на друга и на углеводородный радикал.
Ребята, на примере многоатомных спиртов мы убеждаемся в том, что количественные изменения переходят в изменения качественные: накопление гидроксильных групп в молекуле обусловило в результате их взаимного влияния появление у спиртов новых свойств по сравнению с одноатомными.
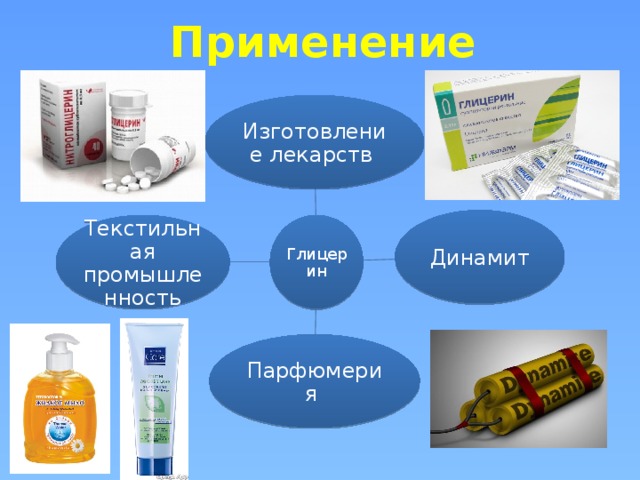
Рассмотрим вопрос о применении глицерина:
Фармацевтической промышленности: Слайд 14
Фенкортозоль – средство противовоспалительное
Ундецен – противогрибковый препарат
Теймурова паста – противопотливая мазь
Парфюмерной промышленности:
Глицерин применяется для смягчения сухой кожи, придает коже мягкость и эластичность. Простейший трехатомный спирт впитывает влагу из воздуха и удерживает её в эпидермисе. Предохраняет кремы от высыхания. Продолжительное использование раствора может вызвать потемнение кожи.
Генетическая связь многоатомных спиртов с другими классами органических соединений
Слайд 15
Итак, мы рассмотрели свойства многоатомных спиртов. Вернёмся к вопросу исследования содержания многоатомных спиртов в жевательных резинках.
Исследование содержания многоатомных спиртов в жевательной резинке
Вопрос: Каким реактивом мы можем обнаружить сорбит, ксилит, маннит?
Ответ: Свежеприготовленным гидроксидом меди (II).
1) Приготовление контрольного образца:
В один хим. стакан + 3-4 капли CuSO4+ 1 мл NaOH → осадок синего цвета
2) Обнаружение сорбита (ксилита, маннита) в жевательной резинке:
В другой хим. стакан + 3-4 капли CuSO4+ 1 мл NaOH → осадок синего цвета + добавить (немного) взвесь из опыта 1→ тёмно-синий раствор.
Вывод: жевательные резинки (любые) содержат многоатомные спирты: сорбит, ксилит, маннит.
Задание: Составьте уравнение реакции взаимодействия ксилита с гидроксидом меди (II).
Подведение итогов урока. Вывод
Во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода;
Число гидроксогрупп влияют на физические свойства спирта (за счет водородных связей);
Общие свойства с одноатомными спиртами обусловлено наличием функциональной группой ОН;
На примере многоатомных спиртов ещё раз убеждаемся в том, что количественные изменения переходят в изменения качественные: накопление гидроксильных групп в молекуле обусловило в результате их взаимного влияния появление у спиртов новых свойств по сравнению с одноатомными спиртами – взаимодействие с нерастворимыми основаниями.
4. Домашнее задание
§ 22, учебника «Химия 10 класс» под редакцией Г.Е.Рудзитиса.
Творческое задание: упр 6 с 92
5. Закрепление учебного материала (тестовый контроль) Приложение 3
или
Заключение(рефлексия):
Что узнали нового на уроке
Что удивило на уроке
Что научились делать
Домашнее задание
Подведение итогов, анализ работы на уроке, выставление оценок.