Просмотр содержимого документа
«Диссоциация, рН-показатель»

ДИССОЦИАЦИЯ
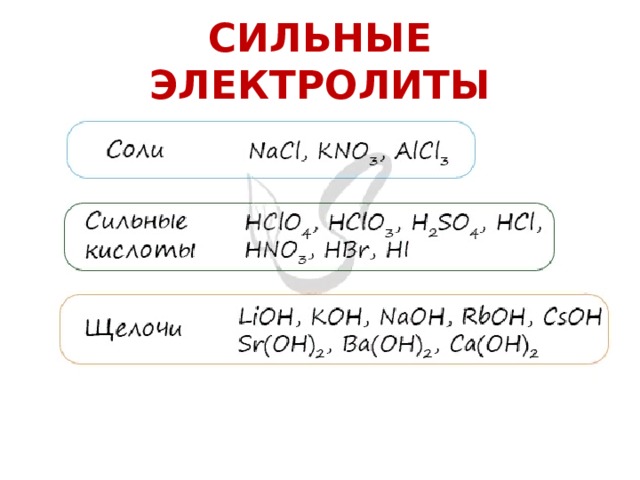
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ

Неэлектролиты - вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
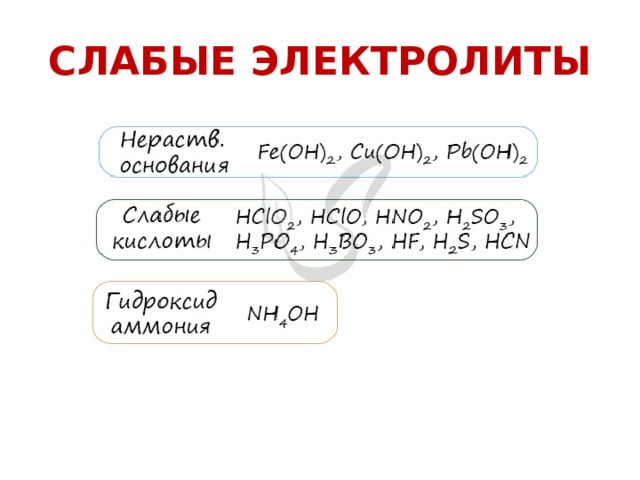
СЛАБЫЕ ЭЛЕКТРОЛИТЫ

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
Слабые электролиты (в их числе вода)
Осадки
Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике - остается только то, что сократить нельзя.
![Сложные ионные уравнения KCl + Fe(ОН) 3 + СО 2 FeCl 3 + K 2 CO3 + H 2 O = Zn + NaOH + H 2 O = Na 2 [Zn(OH) 4 ] + H 2 СaCO 3 + CuCl 2 + H 2 O = Cu(OH) 2 + CaCl 2 + CO 2](https://fsd.multiurok.ru/html/2021/02/14/s_60293979cc99c/img6.jpg)
Сложные ионные уравнения
KCl + Fe(ОН) 3 + СО 2
FeCl 3 + K 2 CO3 + H 2 O =
Zn + NaOH + H 2 O =
Na 2 [Zn(OH) 4 ] + H 2
СaCO 3 + CuCl 2 + H 2 O =
Cu(OH) 2 + CaCl 2 + CO 2

Пройдите тест для закрепления знаний
1. Наибольшее количество хлорид ионов образуется при диссоциации 1 моль
NaCl CaCl2 FeCl3 BaCl2
2. Диссоциации не подвергаются
Осадки Соли Кислоты Основания
3. Меньше всего ионов образуется на ... ступени диссоциации ортофосфорной кислоты
Первой Второй Третьей Четвертой
4. Уксусная кислота относится к
Электролитам Неэлектролитам
5. Раствор поваренной соли является
Неэлектролитом Электролитом
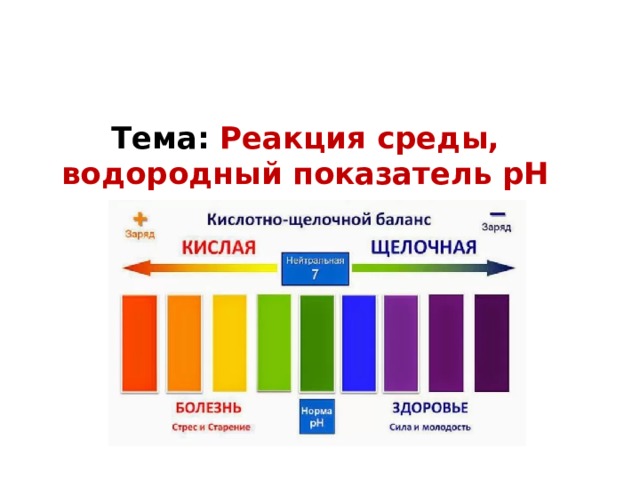
Тема: Реакция среды, водородный показатель pH
 [OH−], рН В щелочной среде рН[H+]рН7 " width="640"
[OH−], рН В щелочной среде рН[H+]рН7 " width="640"
Водородный показатель pH – это отрицательный десятичный логарифм концентрации ионов водорода: pH=−lg[H+], величина, количественно характеризующая кислотность среды.
В чистой воде [H+]=[OH−], pH=7 ( нейтральная среда )
В кислотной среде рН[H+][OH−], рН
В щелочной среде рН[H+]рН7

Методы определения значения pH
– индикаторы
- pH-метром или определять аналитическим путём
- кислотно-основное титрование












![Сложные ионные уравнения KCl + Fe(ОН) 3 + СО 2 FeCl 3 + K 2 CO3 + H 2 O = Zn + NaOH + H 2 O = Na 2 [Zn(OH) 4 ] + H 2 СaCO 3 + CuCl 2 + H 2 O = Cu(OH) 2 + CaCl 2 + CO 2](https://fsd.multiurok.ru/html/2021/02/14/s_60293979cc99c/img6.jpg)


 [OH−], рН В щелочной среде рН[H+]рН7 " width="640"
[OH−], рН В щелочной среде рН[H+]рН7 " width="640"











