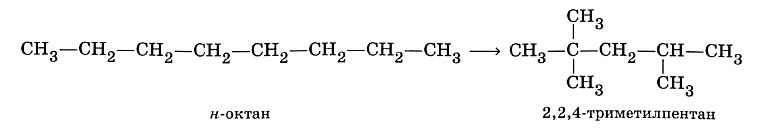Классификация химических реакций- https://multiurok.ru/files/distantsionnyi-urok-po-khimii-8-klass-po-teme-tipy.html
Химические реакции
Вспомните, чем отличаются химические явления или химические реакции от физических.
| Процессы превращения одних веществ в другие, отличающиеся от исходных по составу или строению, а следовательно, и по свойствам, называются химическими реакциями. |

Химические реакции, протекающие
без изменения состава веществ.
Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения.
Если качественный и количественный состав реагентов и продуктов реакций не меняется, то, очевидно, изменяется их строение. В курсе органической химии такие вещества называются изомерами, а процессы их взаимного перехода — реакциями изомеризации. Например, известно, что детонационную стойкость бензина характеризует октановая шкала, в которой устойчивость к детонации 2,2,4-триметилпентана (изооктана) принята за 100. А октановое число его изомера, углеводорода С8Н18 нормального строения, равно 20. Получить изооктан из н-октана можно с помощью реакции изомеризации: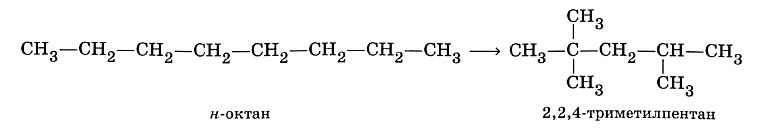
В неорганической химии одинаковый качественный, но разный количественный состав простых веществ иллюстрируют, например, аллотропные видоизменения кислорода: этот элемент образует два простых вещества — кислород и озон, которые связаны взаимопревращениями. Процесс образования озона происходит при электрических разрядах:
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Вспомните, какое строение имеют алмаз и графит. У обоих веществ — атомная кристаллическая решётка, только у алмаза она объёмная тетраэдрическая, а у графита — плоскостная. Поэтому алмаз — очень твёрдое вещество, а графит мягок. Алмаз прозрачен и обладает высоким светопреломлением, а графит непрозрачен, тёмно-серого цвета, в отличие от алмаза проводит электрический ток. Тем не менее обе модификации связаны взаимопревращениями: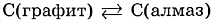
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах.
В настоящее время искусственные алмазы получают из графита также при низких давлениях. Такие алмазы значительно уступают природным по ювелирным показателям, но сравнимы с природными по твёрдости, а потому
применяются в технических целях.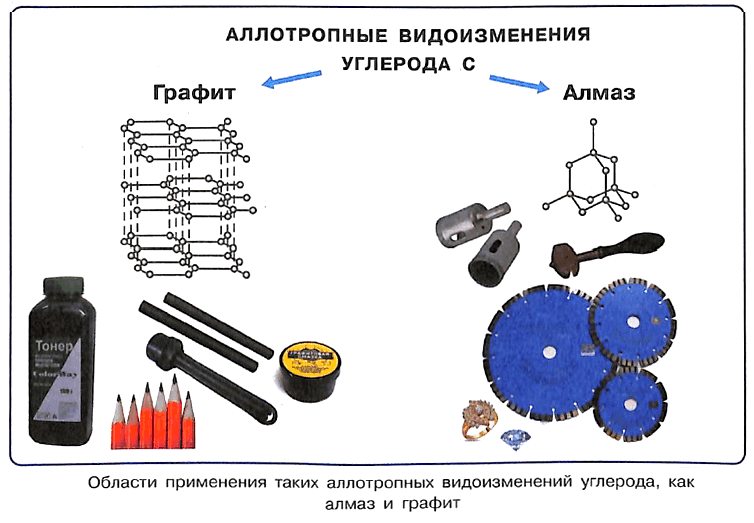
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный.
Химические реакции, протекающие
с изменением состава веществ
(по признаку числа и состава реагентов и продуктов реакции).
Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена.
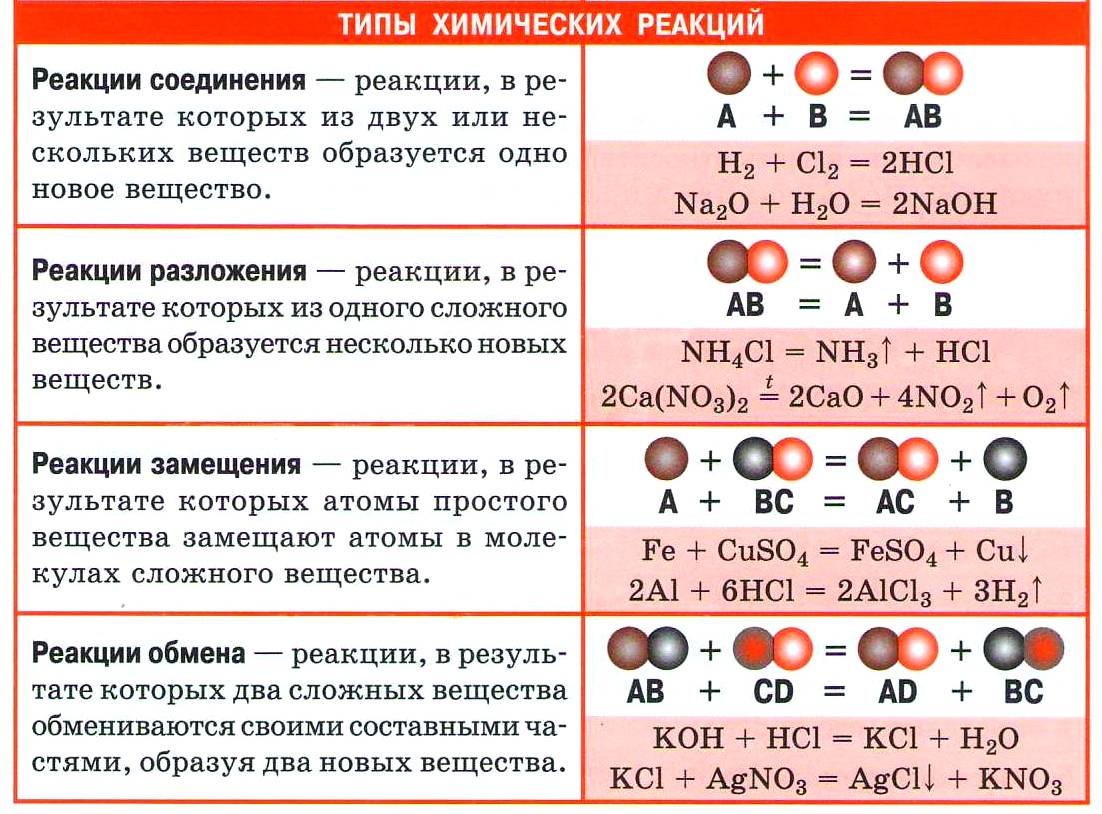
1. Реакции соединения (присоединения)
| Реакции, в результате которых из двух и более веществ образуется одно сложное вещество, называются реакциями соединения. |
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов:
Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5
В этом процессе участвуют два простых вещества и получается одно сложное.
Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4 (сложное вещество образуется в результате взаимодействия двух сложных веществ).
На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 + O2 + 2Н2O = 4HNO3
В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия:
гидрирование — присоединение водорода;
галогенирование — присоединение галогенов;
гидрогалогенирование — присоединение галогеноводородов;
гидратация — присоединение воды.
Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера.
2. Реакции разложения (отщепления)
| Реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ, называются реакциями разложения. |
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами.
Электролиз воды: 
Термическим разложением оксида ртути(II) англичанин Джозеф Пристли получил кислород.
Разложение пероксида водорода: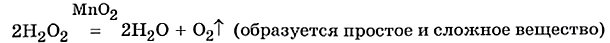
Разложение нитратов:
Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш.
В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций).
3. Реакции замещения
| Реакции, в результате которых атомы простого вещества замещают атомы другого элемента в сложном веществе, называются реакциями замещения. |
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 Вг2 I2.
Аналогично, этот тип реакций характеризует химические свойства металлов:
Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑
С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑
Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe + CuSO4 = Сu + FeSO4
Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl + Fe2O3 = Аl2O3 + 2Fe
Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 – СН3Сl – СН2Сl2 – СНСl3 – ССl4.
Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 — C6H5NO2 + Н2O
В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества.
4. Реакции обмена
| Реакции, в результате которых два сложных вещества обмениваются своими составными частями, называются реакциями обмена. |
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода).
Приведём примеры.
Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца:
2NaI + Pb(NO3)2 = Pbl2↓ + 2NaNO3
Pb2+ + 2I– = Pbl2↓
Лабораторный способ получения аммиака:
2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O
NH4+ + ОН– = NH3↑ + Н2O
Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей:
NaOH + НСl = NaCl + Н2O
OH– + H+ = H2O