МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Хакасский государственный университет им. Н.Ф. Катанова»
(ФГБОУ ВО ХГУ им. Н.Ф. Катанова)
Институт естественных наук и математики
Кафедра математики, физики и информационных технологий
Направление подготовки 44.03.05 Педагогическое образование
Направленность (профили) Математика, Физика
ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ
по дисциплине «Информационно-коммуникативные технологии в образовании»
Выполнила
Балыкова Д. П.
Группа МФ-41
Форма обучения очная
Научный руководитель:
Ахпашева И.Б.
Абакан, 2024
Оглавление
Введение 3
Электрический ток и его основные характеристики 4
Электрический ток в жидкостях 7
Проводимость электролитов 8
Электролиз 8
Законы Фарадея 9
Практическое применение электролиза 11
Контрольные вопросы 12
Список литературы 13
Введение
Актуальность. Объединение явлений и закономерностей, связанных с электрическим током в различных средах, в одну тему для их изучения произошло в начале 70-х годов. Исследованиям на данную тему посвящено большое количество научной и технической информации, т.к. она связана со множеством областей человеческой деятельности от электроники до тиражирования книг и произведений искусства.
Изучение электрического тока в различных средах позволяет понять такие важные процессы, как электрофорез, электролиз, электрохимические реакции и другие явления, которые широко применяются в научных и практических областях. Этот аспект исследования имеет большое значение для развития современных технологий, как в области материаловедения, так и в электроэнергетике, электронике.
Электрический ток может протекать в жидкостях (прохождение тока сопровождается химическими реакциями на электродах, что приводит к выделению на них химических элементов, входящих в состав электролита); в металлах (при прохождении тока металлы нагреваются, что приводит к увеличению сопротивления движению электронов); в газах (проводником может стать ионизированный газ, содержащий электроны, положительные и отрицательные ионы); в вакууме (распространение электрического тока возможно благодаря явлению термоэлектронной эмиссии — испусканию веществом электронов при нагревании).
Электрический ток и его основные характеристики
Электрический ток используется во множестве современных технологий. Чтобы понять, что это такое, можно представить ток воды, бегущий по трубам с определенной скоростью. В этом случае роль воды исполняет электрический заряд, под скоростью понимается его сила, а функцию трубы выполняет проводник — среда, вещество или материал, способные проводить электрический ток.
Самым простым проявлением электрического тока являются: способность янтаря притягивать мелкие предметы после натирания шелком; искрящаяся под воздействием расчески кошачья шерсть.
Электрическим током называется любое упорядоченное (направленное) движение электрических зарядов.
В проводнике под действием приложенного электрического поля свободные электрические заряды перемещаются: положительные — по полю, отрицательные — против поля, т.е. в проводнике возникает электрический ток, называемый током проводимости.
В металлах и полупроводниках такими частицами выступают электроны, в газах — электроны и ионы, в электролитах — анионы и катионы.
Источники электрического тока бывают:
1. Механическими. Это генераторы, которые при помощи падающей воды, газового или парового потока преобразуют механическую энергию в электрическую.
2. Тепловыми. В этом случае ток возникает из-за разности температур двух контактирующих термопар — чем больше разность, тем сильнее ток.
3. Световыми. Здесь речь идет о превращении энергии света в электричество при помощи солнечных батарей.
4. Химическими, основанными на особенностях взаимодействия разных элементов.
Во всех случаях для существования постоянного тока необходимо наличие свободных зарядов, электрического поля, обеспечивающего их движение, замкнутой электрической цепи. В каждом источнике происходит работа по разделению отрицательно и положительно заряженных частиц, скапливающихся на его полюсах.
Виды тока, классификация
В физике различают следующие виды тока:
- постоянный — не меняющий величину, направление во времени;
- переменный — меняющий свои параметры;
- периодический — повторяющий свои мгновенные значения через определенные временные промежутки в одинаковой последовательности;
- синусоидальный — изменяющий свою величину по синусоидальному закону;
- высокой частоты;
- пульсирующий.
Если речь идет о движении макроскопических заряженных тел (к примеру, дождевых капель), то ток принято называть конвекционным. Если же имеется в виду движение заряженных частиц внутри макроскопических тел, то говорят о токе проводимости.
Электрическому току свойственны такие характеристики, как сила, плотность, мощность, частота.
Сила — это физическая величина, отображающая отношение прошедшего за некоторое время количества заряда к величине этого временного промежутка.
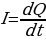 (1.1)
(1.1)
Если сила тока и его направление не изменяются со временем, то такой ток называется постоянным. Для постоянного тока:
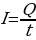 , (1.2)
, (1.2)
где Q - электрический заряд, проходящий за время t через поперечное сечение проводника. Единила силы тока - ампер (А).
Плотность — это векторная величина, определяемая количеством заряда, переносимого за единицу времени через единичную площадку, перпендикулярную линиям тока.
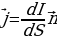 , (1.3)
, (1.3)
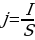 , (1.4)
, (1.4)
где S – площадь сечения проводника. Плотность тока в СИ измеряется в 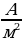 .
.
Мощность — характеристика, показывающая, какая работа была выполнена током за конкретный промежуток времени.
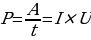 , (1.5)
, (1.5)
где A – работа электрического тока на участке электрической цепи, t – время, в течении которого электрический ток совершал работу, U – электрического напряжение на участке цепи. Единица измерения мощности тока – ватт (Вт).
Частота — это свойство переменного тока, скорость, с которой он меняет свое направление.
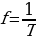 , (1.6)
, (1.6)
где T – период колебаний. Единица измерения частоты – герц (Гц).
Также существует понятие напряжения. Обозначение применяется для определения работы, совершаемой единичным положительным зарядом в момент перемещения вдоль цепи.
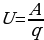 (1.7)
(1.7)
Напряжение тока в СИ измеряется в вольтах (В).
Важный параметр — сопротивление. Оно отображает способность проводника препятствовать прохождению через него заряженных частиц.
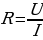 (1.8)
(1.8)
Сопротивление тока в СИ измеряется в омах (Ом).
Исторически сложилось представление о том, что направление тока всегда совпадает с направлением передвижения положительных зарядов. Если носителями в проводнике являются только отрицательные заряды, как, к примеру, происходит в металле, то за направление тока принимают направление, противоположное движению отрицательных зарядов.
Электрический ток в жидкостях
Жидкости, как и твердые тела, могут быть проводниками, полупроводниками и диэлектриками. В этом уроке речь пойдет о жидкостях-проводниках. Причем не о жидкостях с электронной проводимостью (расплавленные металлы), а о жидкостях-проводниках второго рода (растворы и расплавы солей, кислот, оснований). Тип проводимости таких проводников – ионный.
Определение. Проводники второго рода – такие проводники, в которых при протекании тока происходят химические процессы.
Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество NaCl – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы (рис. 1).
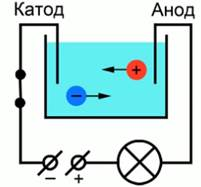
Рис. 1. Схема опыта
Проводимость электролитов
Откуда во втором случае берутся свободные заряды? Как было сказано в одном из предыдущих уроков, некоторые диэлектрики – полярные. Вода имеет как раз-таки полярные молекулы (рис. 2).
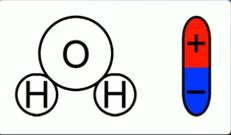
Рис. 2. Полярность молекулы воды
При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора – отрицательный (рис. 3). Именно эти ионы и будут двигаться между электродами под действием электрического поля.
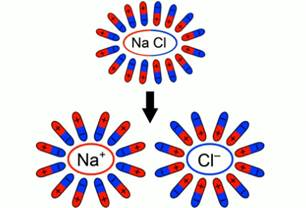
Рис. 3. Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои.
Электролиз
Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза.
Определение. Электролиз – процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество.
Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей (рис. 4).
Электролиз позволяет получать из растворов вещества в достаточно чистом виде, поэтому его применяют для получения редких материалов, как натрий, кальций… в чистом виде. Этим занимается так называемая электролитическая металлургия.

Рис. 4. Майкл Фарадей
Законы Фарадея
В первой работе по электролизу 1833 года Фарадей представил свои два закона электролиза. В первом речь шла о массе вещества, выделяющегося на электродах:
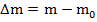
Первый закон Фарадея гласит, что эта масса пропорциональна заряду, прошедшему через электролит:
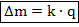
Здесь роль коэффициента пропорциональности играет величина 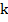 – электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
– электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
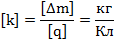
Физический смысл электрохимического эквивалента – масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл.
Если вспомнить формулы из темы о постоянном токе:
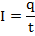
То можно представить первый закон Фарадея в виде:
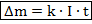
Второй закон Фарадея непосредственно касается измерения электрохимического эквивалента через другие константы для конкретно взятого электролита:
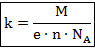
Здесь: 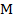 – молярная масса электролита;
– молярная масса электролита; 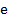 – элементарный заряд;
– элементарный заряд; 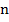 – валентность электролита;
– валентность электролита; 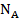 – число Авогадро.
– число Авогадро.
Величина  называется химическим эквивалентом электролита. То есть, для того чтобы знать электрохимический эквивалент, достаточно знать химический эквивалент, остальные составляющие формулы являются мировыми константами.
называется химическим эквивалентом электролита. То есть, для того чтобы знать электрохимический эквивалент, достаточно знать химический эквивалент, остальные составляющие формулы являются мировыми константами.
Исходя из второго закона Фарадея, первый закон можно представить в виде:
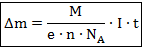
Фарадей предложил терминологию этих ионов по признаку того электрода, к которому они движутся. Положительные ионы называются катионами, потому что они движутся к отрицательно заряженному катоду, отрицательные заряды называются анионами как движущиеся к аноду.
Вышеописанное действие воды по разрыву молекулы на два иона называется электролитической диссоциацией.
Помимо растворов, проводниками второго рода могут быть и расплавы. В этом случае наличие свободных ионов достигается тем, что при высокой температуре начинаются очень активные молекулярные движения и колебания, в результате которых и происходит разрушение молекул на ионы.
Практическое применение электролиза
Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора. Такое применение электролиза получило название гальванопластика. Другой сферой применения является гальваностегия – покрытие одного металла другим (хромирование, никелирование, золочение и т.д., рис. 5).


Рис. 5. Примеры гальванопластики и гальваностегии соответственно
Также электролиз применяется в металлургии для выплавки редких металлов в чистом виде (алюминий, натрий, кальций, магний).
Контрольные вопросы
1. Что такое электролиты?
2. Какие существуют два принципиально разных типа жидкостей, в которых может протекать электрический ток?
3. Какие могут быть механизмы образования свободных носителей зарядов?
4. Почему масса, выделившаяся на электроде, пропорциональна заряду?
Список литературы
1. Тихомирова С. А., Яворский Б. М. Физика (базовый уровень) – М.: Мнемозина, 2012.
2. Генденштейн Л. Э., Дик Ю. И. Физика 10 класс. – М.: Илекса, 2005.
3. Мякишев Г. Я., Синяков А. З., Слободсков Б. А. Физика. Электродинамика. – М.: 2010.
4. Интернет-портал «fatyf.narod.ru» http://fatyf.narod.ru/ELECTRON.htm
5. Интернет-портал «ХиМиК» http://www.xumuk.ru/encyklopedia/2/5304.html
6. Интернет-портал «ens.tpu.ru» http://ens.tpu.ru/POSOBIE_FIS_KUSN/%DD%EB%E5%EA%F2%F0%EE%F1%F2%E0%F2%E8%EA%E0.%20%CF%EE%F1%F2%EE%FF%ED%ED%FB%E9%20%D2%EE%EA/09-4.htm







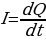 (1.1)
(1.1)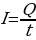 , (1.2)
, (1.2)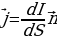 , (1.3)
, (1.3)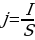 , (1.4)
, (1.4)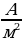 .
.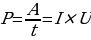 , (1.5)
, (1.5)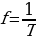 , (1.6)
, (1.6)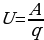 (1.7)
(1.7)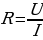 (1.8)
(1.8)















