
ЕГЭ по химии задание 12

План
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
Основные способы получения углеводородов ( в лаборатории)
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии

Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
Предельные углеводороды
Химические и физические свойства циклоалканов
Непредельные углеводороды
Химические и физические свойства диенов
Химические и физические свойства алкинов
Ароматические углеводороды

Углеводороды – это органические соединения, которые состоят из углерода и водорода (иногда замещается на группы). Существует огромное количество углеводородов и для них существует множество классификаций.
По составу углеродного скелета делятся на:
ациклические (алифатические) – определяются по числу атомов, с которыми связан углерод; циклические – имеют замкнутую цепь:
- карбоциклические – в цикле присутствуют только атомы углерода, гетероциклические – присутствуют не только атому углерода.
- карбоциклические – в цикле присутствуют только атомы углерода,
- гетероциклические – присутствуют не только атому углерода.
По наличию кратных связей и открытости цепи:
предельные – не имеют кратных связей:
- алканы, циклоалканы. непредельные – имеют кратные связи: алкены, диены, алкины.
- алканы,
- циклоалканы. непредельные – имеют кратные связи:
- алкены,
- диены,
- алкины.
ароматические – имеют бензольное кольцо:
- бензол, гомологи бензола, арены.
- бензол,
- гомологи бензола,
- арены.

Химические свойства алканов
Алканы (парафины) – это соединения, для которых характерна sp 3 -гибридизация и наличие только σ-связи. Используются как источник энергии в промышленности и помощник в получении белка в микробиологии.
I. Реакции замещения
Реакции замещения являются основным типом реакций, которые характерны для молекул алканов. В связи с высокой энергией ионизации в молекуле алканов очень насыщенные связи, из –за чего химическое взаимодействие затруднено. Общим для реакций замещения являются жесткость условий и наличие сильных окислителей.
В ходе взаимодействия с хлором или бромом получается взрывчатое вещество, имеющее практическое значение. Взаимодействие с фтором провоцирует взрыв, не имеющее промышленного отклика. А реакция с йодом протекает очень медленно, поэтому редко проводится.
Идет под воздействием света.
CnH2n+2 + Hal2 → CnH2n+1-Hal + HHal
Замещение водорода проходит у наименее гидрированного атома углерода.

2. Нитрование
1888 год – Коновалов открыл реакцию взаимодействия алканов с азотной кислотой (13-14 %) под воздействием температуры в 140°С. Она используется для производства ракетного топлива и взрывчатых веществ.
CnH2n+2 + HO-NO2 → CnH2n+1-NO2 + H2O
3. Сульфирование
CnH2n+2 + HO-SO3H → CnH2n+1-SO3H + H2O
4. Сульфахлорирование
CnH2n+2 + SO2 + Cl2 → CnH2n+1-SO2-Cl + HCl
Эту реакцию используют при мыловарении и в производстве синтетических моющих средств.

II. Реакции с разрывом углерод-углеродной связи
Энергия связи «углерод-углерод» высокая, поэтому она достаточно прочная. Реакций, сопровождающихся разрывом этой связи, немного и все они проходят в жестких условиях.
1. Окисление
При нормальных условиях алканы не реагируют с сильными окислителями, такими как серная кислота, перманганат или дихромат калия.
C n H 2n+2 + О 2 → СО 2 + Н 2 О
Алканы горят бесцветным или голубоватым пламенем. У метана, этана, пропана, бутана и пентана копоть не наблюдается, а у соединений с длинными углеродными цепями она есть.
- Медленное окисление
- Медленное окисление
Идет в присутствии катализатора.
2 CH 4 + O 2 → 2 СH 3 OH
4 C 4 H 10 + 5 O 2 → 4 CH 3 -COOH + 2 H 2 O

2. Крекинг
Это химический процесс, протекающий при действии высоких температур. В результате углеродная цепь рвется, и образуются молекулы алкана и алкена.
С 7 Н 16 → СН 3 -СН 2 -СН 2 -СН 3 + СН 3 -СН=СН 2
Крекинг бывает: термическим; каталитическим.
Для каталитической реакции используются катализаторы и меньшие температуры.

III. Реакции с разрывом углерод-водородной связи
Алканы – это вещества, с помощью которых можно получить соединения с кратными связями.
1. Дегидрирование
Отщепление водорода осуществляется в присутствии катализаторов и при высоких температурах.
2 CH 4 → C 2 H 2 + 3 H 2
При дегидрировании алканов с длинными углеродными цепями образуются алкены.
СН 3 -СН 3 → СН 2 =СН 2 + Н 2 2. Дегидроциклизация
С 7 Н 16 → С 6 Н 5 -СН 3 + 4 Н 2 3. Изомеризация
Нагревание линейных алканов с катализатором провоцирует образование веществ с разветвленным углеродным скелетом.
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH(CH 3 )-CH 2 -CH 3
Из алканов получают топливо, которое широко используют в микробиологии, биотехнологиях, органическом синтезе.

Химические и физические свойства циклоалканов
Циклоалканы (нафтены) – это насыщенные циклические углеводороды. Циклоалканы по физическим свойствам схожи с линейными алканами. Циклопропан и циклобутан – это газы, а начиная с циклопентана – жидкости с температурой кипения и плотностью выше, чем у соответствующих парафинов. Не растворяются в воде, но растворимы в эфирах.
I. Реакции присоединения
Реакционная способность зависит от размера цикла. Низшие циклоалканы напоминают алкены, а высшие – алканы.
Галогенирование
Действие галогена различно в зависимости от условий.
- Малые циклы под действием света Малые циклы в нормальных условиях Средние циклы под воздействием света (реакция замещения)
- Малые циклы под действием света
- Малые циклы в нормальных условиях
- Средние циклы под воздействием света (реакция замещения)

2. Взаимодействие с галогеноводородами
Реакция протекает в водном растворе.
В случае несимметричных молекулах соблюдается правило Марковникова.
3. Гидрирование
Реакция проходит при высоких температурах и под действием таких катализаторов как никель, платина.
II. Дегидрирование
Высокие температуры (500°С) по-разному действуют на малые и большие циклы.
III. Горение
Устойчивость к окислителям повышается по гомологическому ряду.
C 6 H 12 + 9 O 2 → 6 CO 2 + 6 H 2 O + Q
Циклоалканы содержатся в нефтяных продуктах, и вырабатывается некоторыми видами растений.
В природе они способны подвергаться микробиологическому окислению.

Непредельные углеводороды
Химические и физические свойства алкенов
Алкены (этиленовые углеводороды) – органические соединения, содержащие одну двойную связь. Температура плавления и кипения увеличивается по гомологическому ряду. При нормальных условиях с этена по бутен – газы, с пентена по гептадецен – жидкости, а далее твердые вещества. Они не растворяются в воде, но растворимы в эфирах.
π- связь менее прочная, чем σ-связь. Это связано с тем, что у негибридных облаков глубина перекрывания меньше. Для алкенов наиболее характерны реакции присоединения. Кроме того, алкены – это доноры электронов и их рассматривают как основания Льюиса.
I. Реакции присоединения
Электроны π-связи находятся вне плоскости, поэтому они более доступны для атакующей электрофильной частицы.
1. Гидрирование
Реакция протекает под воздействием температуры и катализатора никеля.
CH 3 -CH=CH 2 + H 2 → CH 3 -CH 2 -CH 3
2. Гидрогалогенирование
CH 2 =CH 2 + HCl → CH 3 -CH 2 -Cl
Реакционная способность уменьшается в ряду HJ-HBr-HCl-HF. В этих реакциях действует правило Марковникова. Он утверждал, что при взаимодействии галогеноводородов или воды с несимметричными алкенами, водород присоединяется к более гидрированному атому углерода, а галоген – к менее.
Правило имеет несколько исключений.
- Перекисный эффект Карыша.Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода. CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 -Br Присутствие в молекуле алкена электроно-акцепторных функциональных групп в sp 3 -части. F 3 C-CH=CH 2 + HBr → F 3 C-CH 2 -CH 2 -Br
- Перекисный эффект Карыша.Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода.
- CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 -Br
- Присутствие в молекуле алкена электроно-акцепторных функциональных групп в sp 3 -части. F 3 C-CH=CH 2 + HBr → F 3 C-CH 2 -CH 2 -Br

3. Галогенирование
CH 2 =CH 2 + Br 2 → Br-CH 2 -CH 2 -Br 4. Гидратация
Спирты образуются при присоединении алкенов с водой в присутствии серной кислоты, высоких температурах и при оксиде алюминия.
CH 2 =CH 2 + HOH → CH 3 -CH 2 -OH
II. Реакции полимеризации
Полимер – это соединение, состоящее из множества мономеров. Полимеризация не приводит к изменению качественного и количественного состава мономеров. Получение полиэтилена из этена имеет цепной или ступенчатый характер.
n CH 2 =CH 2 → (-CH 2 -CH 2 -) n
n CH 3 -CH=CH 2 → (-CH 2 -CH(CH 3 )-) n
III. Реакции замещения (галогенирование)
Реакции замещения водорода могут проходить и у непредельных алкенов, но в их sp 3 -части. Проходят при жестких условиях – температура свыше 500°С.
CH 3 -CH 2 -CH 2 =CH 2 + Cl 2 → CH 3 -CH(Cl)-CH=CH 2 + HCl

IV. Окисление
Идет легко и образует разные продукты в зависимости от условий.
1. Горение
Алкены горят желтым светящимся пламенем.
C n H 2n + O 2 → CO 2 + H 2 O 2. Неполное окисление
Осуществляется в нейтральной среде при окислении с помощью перманганата калия. В результате образуются диолы, причем гидроксильные группы присоединяются к атомам углерода кратной связи.
3CH 2 =CH 2 +4H 2 O + 2KMnO 4 → 3HO-CH 2 -CH 2 -OH + 2MnO 2 + 2KOH

Жесткое окисление
Проходит в кислой среде. При окислении с помощью кипящего раствора перманганата калия происходит полное разрушение кратной связи, и атомы углероды способны создать карбоновую кислоту или углекислый газ.
5 CH 2 =CH 2 +18 H 2 SO 4 + 12 KMnO 4 → 10 CO 2 + 12 MnSO 4 + 6 K 2 SO 4 + 28 H 2 O CH 3 -CH=CH 2 + 3 H 2 SO 4 + 2 KMnO 4 → CH 3 -COOH + CO 2 + 2 MnSO 4 + K 2 SO 4 + 4 H 2 O
В симметричной молекуле алкена образуется две молекулы одной и той же кислоты.
Если в соединении при кратной связи содержится два углеродных заместителя, то при окислении происходит образование кетона.
5 (CH 3 ) 2 -C=CH-CH 3 + 8 KMnO 4 + 9 H 2 SO 4 → 5 CH 3 -COOH + 5 CH 3 -C(O)-CH 3 + 6 MnSO 4 + 3 K 2 SO 4 + 9 H 2 O
Жесткое окисление проходит и в щелочной среде.
CH 3 -CH=CH 2 + 10 KMnO 4 + 13 KOH → CH 3 -COOH + K 2 SO 4 + 10 K 2 MnO 4 + 8 H 2 O
Те же реакции проходят в присутствии дихромата калия.
Алкены – это исходный продукт в производстве полимеров и других органических веществ.

Химические и физические свойства диенов
Алкадиены – это органические соединения, имеющие две двойные связи. Существует несколько видов диенов:
с кумулированными связями – примыкают к одному углеродному атому - СН 2 =С=СН 2;
с изолированными связями – разделены одном атомом углерода – СН 2 =СН-СН 2 -СН-СН 2 ;
с конъюгированными связями – разделены одной одинарной связью – СН 2 =СН-СН-СН 2 .
В нормальных условиях пропадиен и бутадиен-1,3 являются газами, а изопрен – летучей жидкостью. Алкадиены с изолированными связями – жидкости. Высшие диены находятся в твердом состоянии.

I. Реакции присоединения
У кумулированых и изолированных сначала взаимодействует с реагентом одна связь, а затем другая. А у сопряженных кратные связи образуют единую систему в центре молекулы, при этом параллельно идет процесс присоединения.
1. Гидрирование
CH2=CH-CH=CH2 + H2 → CH3-CH=CH-CH3
2. Галогенирование
CH2=CH-CH=CH2 + Br2 → Br-CH2-CH=CH-CH2-Br С помощью этой реакции обесцвечивание бромная вода.
3. Гидрогалогенирование
Реакция идет при нагревании в 60°С.
CH2=CH-CH=CH2 + HBr → Br-CH2-CH=CH-CH3

II. Полимеризация
В процессе этих реакций образуются эластомеры (синтетические каучуки). Проводится в присутствии натрия.
CH 2 =CH-CH=CH 2 → (-CH 2 -CH=CH-CH 2 -) n
Алкадиены могут обесцвечивать раствор перманганата калия.
Из диенов получают каучуки, из которых производят резину различных марок.

Химические и физические свойства алкинов
Алкины – это органические соединения, имеющие одну тройную связь. По гомологическому ряду температура плавления и кипения увеличивается. В нормальных условиях этин, пропин, бутин – газы, с пентина по гексадецентин – это жидкости, а далее, по увеличению молекулярной массы, - твердые вещества. Температуры кипения у алкинов выше, чем у соответствующих алкенов. Плохо растворяются в воде, хорошо – в органических растворителях.
I. Реакции присоединения
В процессе реакции присоединение происходит сначала по одной π-связи, а затем по другой. Идут по механизмам электрофильного и нуклеофильного присоединения.
Электрофильное присоединение
1. Гидрирование
Идет под действием катализатора никеля.
CH≡CH + H 2 → CH 2 =CH 2 CH 2 =CH 2 + H 2 → CH 3 -CH 3

2. Галогенирование
CH≡CH + Cl 2 → Cl-CH=CH-Cl Cl-CH=CH-Cl + Cl 2 → Cl-CH(Cl)-CH(Cl)-Cl 3. Гидрогалогенирование
CH≡CH + HCl → CH 2 =CH-Cl CH 2 =CH-Cl + HCl → CH 3 -CH(Cl)-Cl 4. Гидратация (реакция Кучерова)
Вышеперечисленные реакции могут подразумевать как присоединение одной молекулы, так и нескольких. В гидратации возможно присоединение только одной молекулы воды. Реакция Кучерова проходит при температуре в 70°С и катализатора в виде сульфата ртути.
CH≡CH + H 2 O → CH 3 -CHO

Нуклеофильное присоединение
1. Присоединение синильной кислоты
Проходит в присутствии меди в аммиачном растворе.
CH≡CH + HCN → CH 2 -CH-CN
2. Присоединение уксусной кислоты
CH≡CH + CH 3 -COOH → CH 3 -C(O)-O-CH=CH 2
3. Присоединение спиртов
CH≡CH + R-OH → CH 2 =CH-O-R
![III. Реакции замещения Замещение происходи у водорода, стоящего при углероде с кратной связью. 1. Взаимодействие с амидом натрия CH≡CH + NaNH 2 → NaC≡CH + NH 3 2. Взаимодействие с аммикатами серебра или одновалентной медью CH≡CH + Ag 2 O → Ag-C≡C-Ag + H 2 O CH≡CH + 2 [Ag(NH 3 ) 2 ]OH → CH 3 -C≡C-Ag + 4 NH 3 + 2 H 2 O CH≡C-CH 3 + [Cu(NH 3 ) 2 ]OH → CH 3 -C≡C-Cu + 2 NH 3 + 2 H 2 O Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.](https://fsd.multiurok.ru/html/2022/07/15/s_62d112673bf6d/img22.jpg)
III. Реакции замещения
Замещение происходи у водорода, стоящего при углероде с кратной связью.
1. Взаимодействие с амидом натрия
CH≡CH + NaNH 2 → NaC≡CH + NH 3 2. Взаимодействие с аммикатами серебра или одновалентной медью
CH≡CH + Ag 2 O → Ag-C≡C-Ag + H 2 O CH≡CH + 2 [Ag(NH 3 ) 2 ]OH → CH 3 -C≡C-Ag + 4 NH 3 + 2 H 2 O CH≡C-CH 3 + [Cu(NH 3 ) 2 ]OH → CH 3 -C≡C-Cu + 2 NH 3 + 2 H 2 O
Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.

IV. Окисление
1. Горение
Этин горит с большим выделением тепла.
2 CH≡CH + 5 O 2 → 4 CO 2 + 2 H 2 O + Q
2. Неполное окисление
В нейтральной и слабощелочной средах образуются соли щавелевой кислоты , а окисление гомологов провоцирует разрыв тройной связи с образование солей карбоновых кислот.
3 CH≡CH + 8 KMnO 4 → 3 KOOC-COOK + 8MnO 2 + 2 KOH + 2 H 2 O
3 CH 3 - C≡CH + 8 KMnO 4 → CH 3 -COOK + 8 MnO 2 + 2 K 2 SO 4 + KHCO 3 + H 2 O
В кислой среде окислитель расщепляет кратную связь с образованием карбоновых кислот.
CH≡CH + 2 KMnO 4 + 3 H 2 SO 4 → 2 CO 2 + 2 MnSO 4 + 4 H 2 O + K 2 SO 4 5 CH≡CH + 8 KMnO 4 + 12 H 2 SO 4 → 5 HOOC-COOH+ 8 MnSO 4 + 12 H 2 O + 4 K 2 SO 4 5 CH 3 - C≡CH + 8 KMnO 4 + 5 H 2 SO 4 → 5 CH 3 -COOH + 5 CO 2 + 8 MnSO 4 + 2 K 2 SO 4 + 12 H 2 O
Только ацетилен используется в промышленности, и именно он является важным химическим сырьем.

Ароматические углеводороды
Химические и физические свойства бензола
Наличие ароматического кольца влияет на характер химических реакций. Единая 6π-система электронов устойчива, поэтому ароматическим углеводородам характерны реакции электрофильного замещения.
Бензол – это бесцветная жидкость, имеющая резкий запах. Горит сильно коптящим пламенем. Образует с воздухом взрывчатые смеси.

I. Реакции замещения
Все эти реакции протекают по механизму бимолекулярного нуклеофильного замещения.
II. Реакции присоединения
Протекают только в жестких условиях. Присоединяться способны только богатые энергией реагенты.
Гидрирование
Идет под воздействием температуры и катализаторов в виде платины.
Галогенирование
под воздействием света
Окисление
При нормальных условиях азотная кислота, хромовая кислота и др. не могут окислить бензол. Он окисляется только в жестких условиях под действием кислорода, катализатора оксида ванадия и при температуре в 450°С.

Химические и физические свойства гомологов бензола
У гомологов бензола такие же физические свойства, что и у самого бензола. Во многом и химические свойства схожи.
Радикалы гомологов бензола повышают электронную плотность на кольце в орто- и параположениях.
1. Галогенирование в ядро
Катализатор – хлорид алюминия.
2. Нитрование в ядро
3. Сульфирование в ядро
4. Алкилирование в ядро
![II. Реакции по боковой цепи 1. Галогенирование Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов. C 6 H 5 -CH 3 + Cl 2 → C 6 H 5 -CH 2 -Cl + HCl 2. Окисление В отличие от бензола его гомологи способны вступать в реакции окисления. C 6 H 5 -CH 3 + [O] → C 6 H 5 -COOH + H 2 O C 6 H 5 -CH 2 -CH 3 + [O] → C 6 H 5 -COOH + CO 2 Окисление дизамещенных гомологов происходит по такому же принципу. 3. Получение непредельных соединений Реакция проходит под действием оксида цинка. C 6 H 5 -CH 2 -CH 3 → C 6 H 5 -CH=CH 2](https://fsd.multiurok.ru/html/2022/07/15/s_62d112673bf6d/img27.jpg)
II. Реакции по боковой цепи
1. Галогенирование
Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов.
C 6 H 5 -CH 3 + Cl 2 → C 6 H 5 -CH 2 -Cl + HCl
2. Окисление
В отличие от бензола его гомологи способны вступать в реакции окисления.
C 6 H 5 -CH 3 + [O] → C 6 H 5 -COOH + H 2 O C 6 H 5 -CH 2 -CH 3 + [O] → C 6 H 5 -COOH + CO 2
Окисление дизамещенных гомологов происходит по такому же принципу.
3. Получение непредельных соединений
Реакция проходит под действием оксида цинка.
C 6 H 5 -CH 2 -CH 3 → C 6 H 5 -CH=CH 2

Химические и физические свойства стирола
Стирол – это бесцветная жидкость, имеющая резкий запах. Плохо растворяется в воде, но хорошо в органических растворителях.
I. Реакции присоединения
1. Гидрогалогенирование
C 6 H 5 -CH=CH 2 + HCl → C 6 H 5 -C(Cl)-CH 3 2. Галогенирование
Стирол обесцвечивает бромную воду. Реакция идет не по бензольному кольцу, а по виниловой группе.
C 6 H 5 -CH=CH 2 + Br 2 → C 6 H 5 -CH(Br)-CH2-Br
II. Полимеризация
В ходе реакции образуется полистирол – твердая стекловидная масса.
n C 6 H 5 -CH=CH 2 → (-CH 2 -CH-(C 6 H 5 )-) n
При производстве полимеров активно используется стирол. На его основе создаются полистирол, пенопласт, пластики.

Основные способы получения углеводородов
Крекинг алканов с бoльшей длиной цепи
Процесс, который используется в промышленности и протекает:
в присутствии катализатора при t 450-500 o C
в отсутствие катализатора при t 500-700 o C
можно выразить общей формулой:
C n H 2n+ 2 = C m H 2m+ 2 + C m –n +C 2(n – m)
I. Получение алканов
Парафины линейного строения. C n H 2n+2
1. Гидрирование. Гидрирование каменного угля проводят при повышенном нагревании и давления, в качестве катализатора следует брать никель. Конечным продуктом является метан.
2. Гидрирование непредельных углеводородов.
3. Крекинг с длинной цепью. Такой способ повсеместно используется в лабораторном получении алканов и алкенов. Крекинг проходит в присутствии катализатора при нагревании около 500 o C или при около 600 o C и больше без него.
4. Декарбоксилирование солей карбоновых кислот. Метод Дюма. Проводят сплав твёрдых карбоновых кислот с твёрдыми щёлочами.
5. Реакция Вюрца. Данная способ используется для удлинения углеродной цепи, протекает при воздействии мет-го натрия на галогеналкан при нормальных условиях.
6. Реакция Фишера-Тропша. Этот способ используется для получения парафинов линейного строения. Синтез-газ (CO+H 2 ) под воздействие высокого нагревания пропускают через катализатор.
7. Гидролиз карбида алюминия. Получение метана.Способ получения CH 4 путём реакции между Al 4 C 3 (карбид алюминия (III)) c H 2 O.
Аl 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4 ↑
Аl 4 C 3 + 12HCl = 4AlCl 3 + 3CH 4 ↑

II. Получение алкенов. C n H 2n
1. Дегидрирование алканов.
Парафины пропускают над никелем, палладием, или платиной при нагревании от 400 до 600 о С. В результате от наименее насыщенных водородом углеродных атомов в цепи отрываются два водорода. Реакцию можно продолжить и получить алкин.
2. Дегидрогалогенирование галогеналканов.
Данная реакция происходит при воздействии спиртового рас-ра щёлочи на галогеналкан и при дальнейшем нагревании смеси.
3. Крекинг алканов.
Данная реакция проходит при катализаторе от 450 до 500 o C или от 500 до 700 o C без.
4. Дегалогенирование вицинальных дигалогеналканов.
Винициальными называют те галогеналканы, в которых атомы галогена присоединены к рядом стоящим атомам углерода.
Суть метода во взаимодействии на дигалогеналкан цинком или магнием.
5.Дегидратация спиртов.
Реакция происходит при нагревании спирта около 140-160 O С в присутствии H 2 SO 4 .

III. Получение алкинов. C n H 2n-2
Ацетилен
1. Пиролиз CH 4 .
Две молекулы метанаCH4 нагревают до 1500 О С в результате происходит его дегидрирование и удвоение углеродной цепи.
2. Дегидрогалогенирование галогеналканов.
Реакция происходит при взаимодействии дигалогеналкана со спиртовым раствором щёлочи.
CH 3 —CHCl 2 + 2KOH (спирт.р-р) → CH≡CH + 2KCl + 2H 2 O
CH 2 Cl—CHCl + 2KOH (спирт.р-р) → CH≡CH + 2KCl + 2H 2 O
3. Гидролиз карбида кальция.
Реакция воздействия водой или бескислородных кислот на карбиды щелoчных и щелочноземельных металлов.
CaC 2 + 2H 2 O → C 2 H 2 ↑ + Ca(OH) 2
CaC 2 + 2HCl (р-р) → C 2 H 2 ↑ + CaСl 2
Гомологи ацетилена.
1. Дегидрирование.
Реакция происходит при нагревании от 400 до 600 0 С в присутствии катализатора (никеля или палладия).
2. Дегидрогалогенирование.
Реакция происходит при действии на дигалогеналкан спиртовым раствором щёлочи.

IV. Получение алкадиенов. C n H 2n-2
Пoлучение бутадиена -1,3 из этанола.
2. Дегидрогалогенирование алканов.
Реакция происходит при действии на дигалогеналкан спиртовым раствором щёлочи.
3. Дегидрирование бутана и бутена-1.
Получение дивинила. Для получения дивинила (бутадиен-1,3) в промышленном производстве проводят реакции по методу каталитического дегидрирования бутана и бутена-1. Реакция происходит при температуре от 500 до 600 о С в присутствии катализатора Cr 2 O 3 .
4. Получение изопрена.
Изопрен - мономер для производства синтетического каучука. В присутствии катализаторов (оксида хрома (III) и оксида алюминия (III)) изопентан под высоким давлением нагревают до 150-160 0 С.
V. Получение ароматических углеводородов. C n H 2n-6
1. Тримеризация ацетилена. Реакцию проводят с катализатором в виде активированного угля при нагревании до 400 О С.
2. Тримеризация пропилена. Реакция происходит при тех же условиях, что и тримеризация ацетилена, но в результате получается не бензол, а мезиэтилен (1,3,5-триметилбензол).
3. Алкилирование. Реакция образования гомологов бензола при его взаимодействии с галогеналканами, алкенами и спиртами при нагревании с разными катализаторами.
4. Декарбоксилирование солей ароматических карбоновых кислот. Способ заключается в сплавлении соли ароматической кислоты с твёрдой щёлочью. В результате образуется арен с меньшим количеством углеродных атомов.
5. Дегидроциклизация. Реакция получения аренов из углеводородов линейного строения с условием наличия в цепи от шести углеродных атомов. Реакцию проводят при сильном нагревании в присутствии катализатора (платина, палладий, никель).
6. Дегидрирование циклогексана. Реакция образования ароматического соединения с таким же количеством атомов углерода в цепи из циклического углеводорода. Реакцию проводят при повышенной температуре при воздействии катализатора (никель, палладий).

Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Ионный механизм
Правило Владимира Васильевича Марковникова
Радикальный механизм

Органическая химия вызывает страх при виде формул из этого раздела, но давайте перестанем бояться и углубимся в изучение взаимодействия веществ. Что же из себя представляют механизмы реакций?
Это детальное разъяснение процесса перехода субстрата в продукт. В органике выделяются два типа механизмов химических реакций, ионный и радикальный.
Ионный механизм
Происходит разрыв связи, во время которого, общая пара электронов остается у одного атома, что приводит к возникновению заряженных частиц - ионов (катионов и анионов). Будучи гетероциклическим, этот разрыв возможен при ковалентной связи.
В ходе получаются:
Нуклеофил – обладающая парой электронов на своем внешнем энергетическом уровне частица, которая образует новые ковалентные связи. Примерами могут послужить: SCN - ,Br - , CN - , Cl - ,I - , OH - и другие анионы и соединения с неподеленной электронной парой. Электрофил – обладающая незаполненной на внешнем энергетическом уровне электронную орбиталь частица, являющаяся электронным акцептором. Например: H 3 O + , CH 3 CO + , AlCl 3 ,BF 3 , катионы, карбокатионы, электронодефицитные нейтральные молекулы, а так же молекулы с сильнополяризованной связью.
Типичными представителями ионных реакций отмечают взаимодействия электролитов в растворах, которые знакомы нам с первых шагов познания неорганической химии, реакции присоединения к непредельным углеводородам, дегидрирование спиртов и замещение гидроксильной группы в спиртах.

Правило Владимира Васильевича Марковникова
Формулировка гласит следующим образом: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам, атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Проще говоря, атом водорода присоединяется к тому атому углерода, у которого наименьшее количество связей с водородом, рассмотрим это заключение на примере гидрогалогенирования пропена:
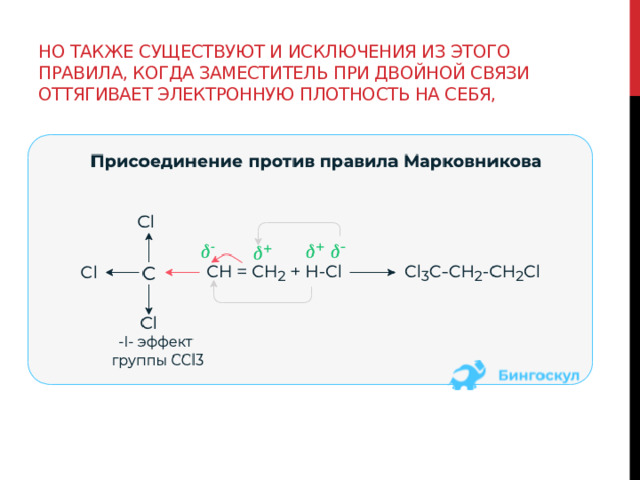
Но также существуют и исключения из этого правила, когда заместитель при двойной связи оттягивает электронную плотность на себя,

или при присоединении в присутствии пероксидов

Радикальный механизм
Происходит деление общей пары электронов между атомами, приводя к образованию нейтрально заряженных частиц (радикалов), которые имеют неспаренные электроны. Будучи гомолитическим, такой разрыв возможен при малополярной ковалентной связи.
Реакции, проходящие по этому механизму, происходят в газовой фазе с огромной скоростью, зачастую сопровождаясь взрывом. Сами радикальные взаимодействия возникают между образовавшимися в ходе взаимодействия нейтрально заряженными частицами и молекулами.
Весьма немалое количество органических реакций протекают по радикальному механизму, например: галогенирование алканов, полимеризация этилена и синтез аммиака.

Задания для подготовки к егэ
Свойства углеводородов. Получение углеводородов
Из предложенного перечня выберите все вещества, которые могут реагировать с каждым из веществ: водой, бромоводородом, водородом.
1) пропан
2) этилен
3) бутен-1
4) этан
5) хлорметан
Ответ: 23.

Пояснение
Из представленных веществ только бутен-1 и этилен имеют кратную (двойную) связь и способны присоединить к себе и воду, и бромоводород, и водород. Алканы (пропан и этан) и галогеналканы (хлорметан) в подобные реакции не вступают.

Задания для подготовки к егэ
Свойства кислородосодержащих соединений. Получение кислородосодержащих соединений
Из предложенного перечня выберите две кислоты, которые будут реагировать с водородом, бромом и бромоводородом.
1) акриловая
2) уксусная
3) пропионовая
4) стеариновая
5) олеиновая
Ответ: 15.

Пояснение
Олеиновая кислота и акриловая кислота — это непредельные кислоты, поэтому для них характерны реакции непредельных углеводородов.

Домашняя работа
Вариант № 5509622
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5509622


























![III. Реакции замещения Замещение происходи у водорода, стоящего при углероде с кратной связью. 1. Взаимодействие с амидом натрия CH≡CH + NaNH 2 → NaC≡CH + NH 3 2. Взаимодействие с аммикатами серебра или одновалентной медью CH≡CH + Ag 2 O → Ag-C≡C-Ag + H 2 O CH≡CH + 2 [Ag(NH 3 ) 2 ]OH → CH 3 -C≡C-Ag + 4 NH 3 + 2 H 2 O CH≡C-CH 3 + [Cu(NH 3 ) 2 ]OH → CH 3 -C≡C-Cu + 2 NH 3 + 2 H 2 O Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.](https://fsd.multiurok.ru/html/2022/07/15/s_62d112673bf6d/img22.jpg)




![II. Реакции по боковой цепи 1. Галогенирование Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов. C 6 H 5 -CH 3 + Cl 2 → C 6 H 5 -CH 2 -Cl + HCl 2. Окисление В отличие от бензола его гомологи способны вступать в реакции окисления. C 6 H 5 -CH 3 + [O] → C 6 H 5 -COOH + H 2 O C 6 H 5 -CH 2 -CH 3 + [O] → C 6 H 5 -COOH + CO 2 Окисление дизамещенных гомологов происходит по такому же принципу. 3. Получение непредельных соединений Реакция проходит под действием оксида цинка. C 6 H 5 -CH 2 -CH 3 → C 6 H 5 -CH=CH 2](https://fsd.multiurok.ru/html/2022/07/15/s_62d112673bf6d/img27.jpg)


























