
ЕГЭ по химии задание 13

План
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)

Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Амины
Аминокислоты

Азотсодержащие соединения
Азотсодержащие соединения – это молекулы, имеющие в строении атомы азота. С помощью инертного газа образуются различные классы органических соединений:
амины (R-NH 2 );
аминокислоты (H 2 N-R-COOH);
нитрилы (R-CN);
нитросоединения (R-NO 2 );
нитрозосоединения (R-NO) и т.д.
Амины
Амины – аммиачные производные, которые рассматриваются как замещенный продукт водородных атомов на органические радикалы (R).
У аминов так же как и в растворе аммиака проявляются слабые основные свойства. Классифицируются по числу катионов водорода, которые заместили, на:
первичные (R-NH 2 );
вторичные (R-NH-R);
третичные (N-(R) 3 ).
Амины разделяют по характеру органических заместителей:
предельные – молекулы без ароматических колец и кратных связей;
непредельные – в молекулах присутствуют ароматические кольца и кратные связи.
В азоте амина находится внешняя электронная пара, за счет которой способен проявлять себя как основание. Но существуют ионы, являющиеся продуктами замещения на радикал всех водородных атомов – NH 4 + .
Когда аминогруппа в ароматических аминах связана с ароматическим ядром, то амины являются более слабыми снованиями по сравнению с аммиаком. Так как неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца, таким образом электронная плотность на атоме азота снижается. Бензольное ядро, обладающее большей энергией ионизации, оттягивает на себя электронную плотность молекулы. В результате основные свойства снижаются в реакциях, например взаимодействия с водой. Так, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.

Способы получения аминов
Амины сохраняют многие особенности аммиака – запах, растворимость в воде, сильные основные свойства.
Реакция Гофмана (алкилирование аммиака и его производных)
- R-Hal + NH 3 → R-NH 2 + HHal R-Hal + R ’ -NH 2 + NH 3 → R-NH-R ’ + NH 4 Hal R-Hal + R-NH-R → N-(R) 3 + NH 4 Hal
- R-Hal + NH 3 → R-NH 2 + HHal
- R-Hal + R ’ -NH 2 + NH 3 → R-NH-R ’ + NH 4 Hal
- R-Hal + R-NH-R → N-(R) 3 + NH 4 Hal
Взаимодействие непредельных аминов со спиртами – способ получения вторичных аминов
- С 6 H 5 -NH 2 + CH 3 -OH → С 6 H 5 -NH-CH 3 + H 2 O
- С 6 H 5 -NH 2 + CH 3 -OH → С 6 H 5 -NH-CH 3 + H 2 O
Пропускание паров спирта и аммиака над катализатором оксида алюминия при температуре в 30°C
- R-OH + NH 3 → R-NH 2 + H 2 O
- R-OH + NH 3 → R-NH 2 + H 2 O
Расщепление амидов при взаимодействии с гипохлоридом калия
- R-CONH 2 + KBrO → R-NH 2 + Cl 2 + KBr
- R-CONH 2 + KBrO → R-NH 2 + Cl 2 + KBr
Восстановление нитросоединений в присутствии катализатора в виде никеля, палладия – способ получения первичных аминов
- R-NO 2 + H 2 → R-NH 2 + H 2 O
- R-NO 2 + H 2 → R-NH 2 + H 2 O
![Химические реакции аминов Химические свойства определяются реакционными центрами (РЦ): первый РЦ, представляющий собой неподеленную пару электронов на азоте; второй РЦ, определяющийся полярностью связи N-H; третий РЦ – это бензольное кольцо. У непредельных аминов роль первого РЦ незначительна, т.к. ароматическое кольцо смещает на себя плотность и неподеленная пара электронов азота в проявлении основных свойств не принимает участия. I. Основные свойства Атом азота в амине принимает участие в образовании ковалентной связи, выступая как донор, благодаря внешней паре электронов. Т.о. амины присоединяют катион водорода и проявлять свойства основания. Взаимодействие с водой R-NH 2 + HOH → [R-N + H 3 ]OH - R-NH 2 + HOH → [R-N + H 3 ]OH - Взаимодействие с кислотами R-NH 2 + HCl → [R-N + H 3 ]Cl - R-NH 2 + HOSO 3 H → [R-N + H 3 ]OS - O 3 H R-NH 2 + HCl → [R-N + H 3 ]Cl - R-NH 2 + HOSO 3 H → [R-N + H 3 ]OS - O 3 H](https://fsd.multiurok.ru/html/2022/07/15/s_62d13793ed304/img6.jpg)
Химические реакции аминов
Химические свойства определяются реакционными центрами (РЦ):
первый РЦ, представляющий собой неподеленную пару электронов на азоте;
второй РЦ, определяющийся полярностью связи N-H;
третий РЦ – это бензольное кольцо.
У непредельных аминов роль первого РЦ незначительна, т.к. ароматическое кольцо смещает на себя плотность и неподеленная пара электронов азота в проявлении основных свойств не принимает участия.
I. Основные свойства
Атом азота в амине принимает участие в образовании ковалентной связи, выступая как донор, благодаря внешней паре электронов. Т.о. амины присоединяют катион водорода и проявлять свойства основания.
Взаимодействие с водой
- R-NH 2 + HOH → [R-N + H 3 ]OH -
- R-NH 2 + HOH → [R-N + H 3 ]OH -
Взаимодействие с кислотами
- R-NH 2 + HCl → [R-N + H 3 ]Cl - R-NH 2 + HOSO 3 H → [R-N + H 3 ]OS - O 3 H
- R-NH 2 + HCl → [R-N + H 3 ]Cl -
- R-NH 2 + HOSO 3 H → [R-N + H 3 ]OS - O 3 H

Предельные первичные амины
Предельные первичные амины реагируют с азотистой кислотой с образованием спиртов, азота N 2 и воды. Например:
C 2 H 5 NH 2 + HNO 2 = C 2 H 5 OH + N 2 + H 2 O
Признаком этой реакции - выделение азота.
Реакция является качественной на первичные амины .
Реакцию проводят поэтапно:
смешивают амин с раствором соли азотистой кислоты (нитрита)
добавляют к этой смеси сильную минеральную кислоту. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая потом реагирует с амином:
- R – NH 2 + KNO 2 + HCl = R – OH + N 2 + KCl + H 2 O
- R – NH 2 + KNO 2 + HCl = R – OH + N 2 + KCl + H 2 O

Вторичные амины дают при похожих условиях маслянистые жидкости с характерным запахом, поэтому и название N-нитрозаминами.
Третичные амины с азотистой кислотой не взаимодействуют.
Сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
4( C 2 H 5 ) 2 NH + 27 O 2 = 16 CO 2 + 22 H 2 O + 2 N 2

II. Слабые кислотные свойства
Первичным и вторичным аминам характерен разрыв связи N-H и замещение атома водорода на другие функциональные группы.
Взаимодействия с металлами
- R-NH 2 + Na → R-NH-Na + H 2
- R-NH 2 + Na → R-NH-Na + H 2
Алкилирование (реакция Гофмана) под действием катализатора в виде аммиака
- R-NH 2 + R’-Hal → R-NH-R’ + HHal
- R-NH 2 + R’-Hal → R-NH-R’ + HHal
Ацилирование
- CH 3 -COCl + CH 3 -NH 2 → CH 3 -NH-CO-CH 3 + HHal
- CH 3 -COCl + CH 3 -NH 2 → CH 3 -NH-CO-CH 3 + HHal

III. Качественная реакция на амины
Она осуществляется с помощью азотистой кислоты, которую необходимо получить непосредственно в момент реакции.
NaNO 2 + HCl → NaCl + HNO 2
HNO 2 + R-NH 2 → R-OH + NH 3 + H 2 O
HONO + R-NH-R → (R) 2 -N-NO + H 2 O
Амины широко применяют в фармакологической промышленности в препаратах с упрощенной адреналиновой структурой, а также в строительной отрасли в качестве компонента полимерных материалов.

Аминокислоты
Аминокислоты – это органические вещества, которые включают в себя аминогруппу (-NH 2 ) и карбоксигруппу (-COOH). Единая формула аминокислот – (NH 2 ) x R(COOH) y , где x и y принимают значения больше одного.
Аминокислоты – это элементарная структура белков, из которых состоят структуры животного тела. В состав белков входят только α-аминокислоты. На планете Земля 20 аминокислот, общая формула которых H 2 N-CH(R)-COOH. Эта двадцатка содержит в себе радикалы – углеводородные, кислородсодержащие, серосодержащие, азотсодержащие и ароматические.
![Способы получения аминокислот Аминокислоты – это бесцветные кристаллы, плавящиеся при 200°C. Они способны растворяться в воде, но нерастворимы в эфирах. 1. Взаимодействие α-галогенпроизводных карбоновых кислот с аммиачным раствором (действие температур) Cl-R-COOH + NH 3 → H 2 N-R-COOH + HCl Cl-R-COOH + NH 3 → H 2 N-R-COOH + HCl 2. Воздействие аммиака и цианистого водорода на альдегиды и кетоны R-CHO + NH 3 → R-CH=NH + H 2 O R-CH=NH + HCN → R-CH(NH 2 )-CN R-CH(NH 2 )-CN + 2H 2 O → R-CH(NH 2 )-COOH + NH 3 R-CHO + NH 3 → R-CH=NH + H 2 O R-CH=NH + HCN → R-CH(NH 2 )-CN R-CH(NH 2 )-CN + 2H 2 O → R-CH(NH 2 )-COOH + NH 3 3. Взаимодействие белка с водой при добавлении кислоты [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-] n + HOH → H 2 N-CH(R)-COOH + H 2 N-CH(R’)-COOH [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-] n + HOH → H 2 N-CH(R)-COOH + H 2 N-CH(R’)-COOH 4. Добывание аминокислот клеточными организмами Микроорганизмы при нарушении нормальной жизнедеятельности начинают синтезировать аминокислоту, вместо того, чтобы накапливать белок.](https://fsd.multiurok.ru/html/2022/07/15/s_62d13793ed304/img12.jpg)
Способы получения аминокислот
Аминокислоты – это бесцветные кристаллы, плавящиеся при 200°C. Они способны растворяться в воде, но нерастворимы в эфирах.
1. Взаимодействие α-галогенпроизводных карбоновых кислот с аммиачным раствором (действие температур)
- Cl-R-COOH + NH 3 → H 2 N-R-COOH + HCl
- Cl-R-COOH + NH 3 → H 2 N-R-COOH + HCl
2. Воздействие аммиака и цианистого водорода на альдегиды и кетоны
- R-CHO + NH 3 → R-CH=NH + H 2 O R-CH=NH + HCN → R-CH(NH 2 )-CN R-CH(NH 2 )-CN + 2H 2 O → R-CH(NH 2 )-COOH + NH 3
- R-CHO + NH 3 → R-CH=NH + H 2 O
- R-CH=NH + HCN → R-CH(NH 2 )-CN
- R-CH(NH 2 )-CN + 2H 2 O → R-CH(NH 2 )-COOH + NH 3
3. Взаимодействие белка с водой при добавлении кислоты
- [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-] n + HOH → H 2 N-CH(R)-COOH + H 2 N-CH(R’)-COOH
- [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-] n + HOH → H 2 N-CH(R)-COOH + H 2 N-CH(R’)-COOH
4. Добывание аминокислот клеточными организмами
Микроорганизмы при нарушении нормальной жизнедеятельности начинают синтезировать аминокислоту, вместо того, чтобы накапливать белок.

Химические свойства аминокислот
В составе аминокислот две функциональные группы, поэтому с одной группой веществ они ведут себя как амины, с другой как карбоновые кислоты, а с третьей – проявляют все свойства сразу.
I. Карбоксильная группа – ее химические реакции
Многие химические свойства, характерные для спиртов, встречаются и у аминокислот. Реакции задействуют только группу –COOH.
1. Кислотные свойства

2.Особые взаимодействия
- H 2 N-CH(R)-COOH + R’-OH → H 2 N-CH(R)-COOR’ + H 2 O2. Особые взаимодействия H 2 N-CH(R)-COOH + SOCl 2 → H 2 N-CH(R)-COCl + SO 2 + HCl
- H 2 N-CH(R)-COOH + R’-OH → H 2 N-CH(R)-COOR’ + H 2 O2. Особые взаимодействия
- H 2 N-CH(R)-COOH + SOCl 2 → H 2 N-CH(R)-COCl + SO 2 + HCl
3. Реакция с аммиаком
- H 2 N-CH(R)-COOH + NH 3 → H 2 N-CH(R)-CONH 2 + H 2 O
- H 2 N-CH(R)-COOH + NH 3 → H 2 N-CH(R)-CONH 2 + H 2 O
4. Элиминирование молекулы диоксида углерода (под действием температур)
- H 2 N-CH(R)-COOH → H 2 N-CH 2 -R + CO 2
- H 2 N-CH(R)-COOH → H 2 N-CH 2 -R + CO 2
![II. Аминогруппа – ее химические реакции Многие химические свойства, характерные для аминов, встречаются и у аминокислот. Реакции задействуют только группу ––NH 2 . 1.Реакции с кислотами H 2 N-CH(R)-COOH + HCl → [H 3 N + -CH(R)-COOH]Cl - H 2 N-CH(R)-COOH + HCl → [H 3 N + -CH(R)-COOH]Cl - 2.Введение ацила в аминокислоту H 2 N-CH(R)-COOH + CH 3 -COCl → CH 3 -C(O)-NH-CH(R)-COOH + HCl H 2 N-CH(R)-COOH + CH 3 -COCl → CH 3 -C(O)-NH-CH(R)-COOH + HCl 3.Введение алкильного остатка в состав аминокислоты H 2 N-CH(R)-COOH + 2СH 3 J → (CH 3 ) 2 -N(R)-CH(R)-COOH + 2HJ H 2 N-CH(R)-COOH + 2СH 3 J → (CH 3 ) 2 -N(R)-CH(R)-COOH + 2HJ 4.Отщепление аминогруппы от аминокислоты под действием температур COOH-CH 2 -CH(NH 2 )-COOH → COOH-CH 2 -CH 2 -COOH + NH 3 COOH-CH 2 -CH(NH 2 )-COOH → COOH-CH 2 -CH 2 -COOH + NH 3](https://fsd.multiurok.ru/html/2022/07/15/s_62d13793ed304/img15.jpg)
II. Аминогруппа – ее химические реакции
Многие химические свойства, характерные для аминов, встречаются и у аминокислот. Реакции задействуют только группу ––NH 2 .
1.Реакции с кислотами
- H 2 N-CH(R)-COOH + HCl → [H 3 N + -CH(R)-COOH]Cl -
- H 2 N-CH(R)-COOH + HCl → [H 3 N + -CH(R)-COOH]Cl -
2.Введение ацила в аминокислоту
- H 2 N-CH(R)-COOH + CH 3 -COCl → CH 3 -C(O)-NH-CH(R)-COOH + HCl
- H 2 N-CH(R)-COOH + CH 3 -COCl → CH 3 -C(O)-NH-CH(R)-COOH + HCl
3.Введение алкильного остатка в состав аминокислоты
- H 2 N-CH(R)-COOH + 2СH 3 J → (CH 3 ) 2 -N(R)-CH(R)-COOH + 2HJ
- H 2 N-CH(R)-COOH + 2СH 3 J → (CH 3 ) 2 -N(R)-CH(R)-COOH + 2HJ
4.Отщепление аминогруппы от аминокислоты под действием температур
- COOH-CH 2 -CH(NH 2 )-COOH → COOH-CH 2 -CH 2 -COOH + NH 3
- COOH-CH 2 -CH(NH 2 )-COOH → COOH-CH 2 -CH 2 -COOH + NH 3

III. Реакции по обеим группам
Ряд химических свойств связан с действием реактивов на все функциональные группы.
Синтез комплексных солей
Нагревание β-аминокислот
H 2 N-CH 2 -CH 2 -COOH → CH 2 =CH-COONH 4 + H 2 O
Нагревание γ и δ-аминокислот

Заключение
Аминокислоты – это звенья, из которых составляются нити белка. Из них строятся живые ткани на планете. Почти все аминокислоты организм использует для построения органики тела. Некоторые играют роль медиаторов в нервных импульсах, другие используются в химической промышленности для проведения синтезов, третьи – в пищевой отрасли.

Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
Жиры
Белки
Углеводы

Жиры
Жиры представляют собой органические соединения, образующиеся в результате взаимодействия глицерина с высшими карбоновыми кислотами. Соединения могут быть природного или синтетического происхождения.
Жиры еще называют глицеридами, так как в реакциях этерификации, продуктами которых они являются, принимают участие карбоновые кислоты и единственный спирт – глицерин.
Общая формула жиров выглядит так:
R 1 , R 2 , R 3 - углеводородные остатки карбоновых кислот.
В состав жиров могут входить насыщенные и ненасыщенные карбоновые кислоты. Жиры имеют твердую консистенцию, если в состав входят углеводородные части предельных кислот. В случае этерификации глицерина с ненасыщенными кислотами образуются жидкие соединения. Природные глицериды содержат оба вида кислот, поэтому животные жиры твердые (кроме рыбьего жира). Глицериды растительного происхождения соответственно имеют жидкую форму, поэтому их называют маслами (кроме пальмового масла, имеющего твердую консистенцию).

Химические свойства жиров
По аналогии можно предположить, что гидрирование двойных связей обеспечит переход в твердую форму. Данное свойство подтверждено опытным путем. Так получают твердый жир маргарин. Реакция гидрирования (гидрогенизация) проходит в присутствии никелевого катализатора:
Жиры – это сложные эфиры, поэтому для них характерны реакции гидролиза.
Гидролиз с водными растворами кислот и щелочей протекает по следующей схеме:
В результате реакций щелочного гидролиза образуются соли высших карбоновых кислот – мыла (реакции омыления):
Жиры, в составе которых содержаться углеводородные остатки непредельных кислот обесцвечивают раствор калия перманганата и бромной воды. Присутствие двойных связей в предельных кислотах лишает глицериды этого свойства.

Биологические функции жиров
Жиры играют важную роль в живых организмах. Основными функциями являются:
строительная;
энергетическая;
защитная;
секреторная;
регулирующая.
Жиры регулируют обмен веществ, участвуют в теплорегуляции, обеспечивают механическую защиту органов, повышают сопротивляемость организма, секретируют гормоны.

Белки
Белки – высокомолекулярные соединения органической природы. Представляют собой цепочку из частей альфа-аминокислот, соединенных пептидными связями.
Двадцать видов аминокислот образуют структуру большинства белков. При этом отдельные виды белков отличаются между собой аминокислотными наборами по наименованию и последовательности соединения.
Структура белков определяет их растворимость. Так, четвертичные соединения в виде глобул образуют коллоидный водный раствор, а четвертичные белки из нитей (фибрилл) имеют твердую структуру и не растворяются в водной среде.
Химические свойства белков
Белковые соединения вступают в реакции гидролитического разложения по схеме:
В результате гидролиза образуется смесь альфа-аминокислот.
При определенных условиях происходит распад сложных белковых структур до первичной линейной формы. Это называется денатурацией.
Денатурация белка может быть обратимой и не обратимой. Ход процесса зависит от условий протекания.
Обратимая денатурация протекает в присутствии щелочей или ионов аммония по схеме:
Необратимая денатурация белка происходит в присутствии кислот, щелочей, солей тяжелых металлов при условии повышенной температуры либо воздействия иного излечения. В таких условиях восстановление структуры белка невозможно.
Реакция взаимодействия белкового раствора с 10% раствором натрия гидроксида и капли 1% раствора сульфата меди называется биуретовой реакцией. В результате образуется биуретовый комплекс фиолетового цвета:
Это качественная реакция для белковых соединений.
Ксантопротеиновой реакцией называют взаимодействие раствора белка с концентрированной азотной кислотой в условиях повышенной температуры. Образуется соединение, придающее раствору желтое окрашивание.

Биологические функции белков
Белковые соединения в организме выполняют такие функции, как:
строительная;
защитная;
регуляторная;
транспортная;
энергетическая;
двигательная.
Белки – строительный материал клеток. Белковые соединения защищают от инфекционных агентов, доставляют важнейшие вещества в органы, насыщают организм энергией.
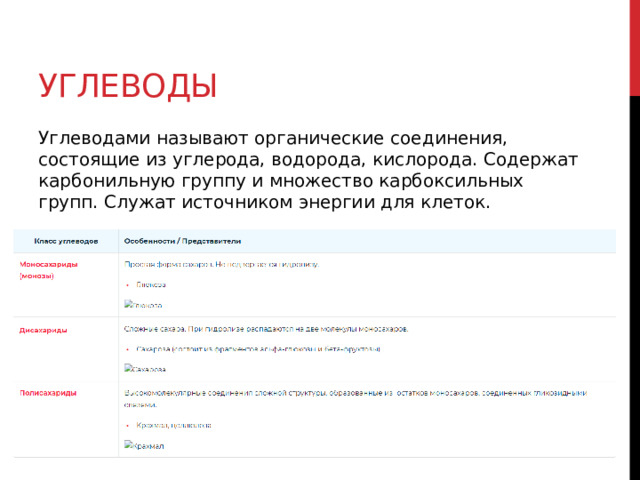
Углеводы
Углеводами называют органические соединения, состоящие из углерода, водорода, кислорода. Содержат карбонильную группу и множество карбоксильных групп. Служат источником энергии для клеток.

Химические свойства углеводов
Химические свойства углеводов обусловлены строением. Соединения вступают в реакции по карбоксильной группе, по спиртовому гидроксилу или кетонной группе в зависимости от природы сахаров в составе.
Реакции гидрирования характерны для сахаров, содержащих карбонильную группу (например, глюкоза), которая в результате восстанавливается до спиртового гидроксила при повышенной температуре в присутствии никелевого катализатора
Альдегидная группа в составе вступает в характерную реакцию с гидроксидом меди. Образуется оксид меди II кирпично-красного цвета
По альдегидной группе проходит и реакция «серебряного зеркала» с серебра нитратом в аммиачной среде. Образуется осадок серебра, глюконат аммония, аммиак и вода
Спиртовой гидроксил в составе определяет взаимодействие с гидроксидом двухвалентной меди. Осадок голубого цвета переходит в насыщенный синий раствор медного комплекса

Процессы брожения
- Процесс ферментативного разложения глюкозы на этиловый спирт и углекислый газ называют спиртовым брожением:
- Продуктом молочнокислого брожения становится молочная кислота. Возможны процессы масляно-кислого, лимонно-кислого брожения:

Растворы моносахаров
В растворе моносахара соединяются между собой через альдегидные группы. Раствор глюкозы содержит две модификации: альфа-форму и бета-форму:
Полисахара сгорают до углекислого газа и воды:
(С 6 H 10 O 5 ) n + 6 n O 2 → 6 n CO 2 + 5 n H 2 O
Характерная реакция крахмала с раствором йода:
Образуется ярко синее окрашивание. При повышении температуры цвет исчезает, при охлаждении снова проявляется.

Биологические функции углеводов
Углеводы выполняют функции в организме такие, как:
энергетическая;
защитная (иммунная);
структурная;
запасающая;
рецепторная.
Углеводы образуют стенки клеток, обеспечивают распознавание клеток, присоединение к ним биологически активных веществ, участвуют в фотосинтезе.

Характерные химические свойства азотсодержащих органических соединений
Задания для подготовки к егэ
Из предложенного перечня выберите два утверждения, которые справедливы для диметиламина.
1) водный раствор диметиламина имеет слабокислую среду
2) реагирует с бромоводородной кислотой
3) при нагревании реагирует с
4) пары диметиламина тяжелее воздуха
5) как и другие амины, не имеет запаха
Ответ: 24.

Пояснение
Диметиламин — это производное аммиака, где два атома водорода замещены на метильный радикал, поэтому по своим свойствам похож на аммиак. Это органическое основание, поэтому возможны реакции присоединения катиона водорода.

Задания для подготовки к егэ
Биологически важные вещества: жиры, белки, углеводы
Из предложенного перечня выберите два вещества, с которыми не взаимодействует глюкоза.
1) водород
2) кислород
3) натрий
4) серебро
5) азот
Ответ: 45.

Пояснение
Глюкоза восстанавливается водородом до сорбита, окисляется кислородом, реагирует с натрием, но не вступает в реакцию с серебром и азотом.

Домашняя работа
Вариант № 5509775
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5509775










![Химические реакции аминов Химические свойства определяются реакционными центрами (РЦ): первый РЦ, представляющий собой неподеленную пару электронов на азоте; второй РЦ, определяющийся полярностью связи N-H; третий РЦ – это бензольное кольцо. У непредельных аминов роль первого РЦ незначительна, т.к. ароматическое кольцо смещает на себя плотность и неподеленная пара электронов азота в проявлении основных свойств не принимает участия. I. Основные свойства Атом азота в амине принимает участие в образовании ковалентной связи, выступая как донор, благодаря внешней паре электронов. Т.о. амины присоединяют катион водорода и проявлять свойства основания. Взаимодействие с водой R-NH 2 + HOH → [R-N + H 3 ]OH - R-NH 2 + HOH → [R-N + H 3 ]OH - Взаимодействие с кислотами R-NH 2 + HCl → [R-N + H 3 ]Cl - R-NH 2 + HOSO 3 H → [R-N + H 3 ]OS - O 3 H R-NH 2 + HCl → [R-N + H 3 ]Cl - R-NH 2 + HOSO 3 H → [R-N + H 3 ]OS - O 3 H](https://fsd.multiurok.ru/html/2022/07/15/s_62d13793ed304/img6.jpg)





![Способы получения аминокислот Аминокислоты – это бесцветные кристаллы, плавящиеся при 200°C. Они способны растворяться в воде, но нерастворимы в эфирах. 1. Взаимодействие α-галогенпроизводных карбоновых кислот с аммиачным раствором (действие температур) Cl-R-COOH + NH 3 → H 2 N-R-COOH + HCl Cl-R-COOH + NH 3 → H 2 N-R-COOH + HCl 2. Воздействие аммиака и цианистого водорода на альдегиды и кетоны R-CHO + NH 3 → R-CH=NH + H 2 O R-CH=NH + HCN → R-CH(NH 2 )-CN R-CH(NH 2 )-CN + 2H 2 O → R-CH(NH 2 )-COOH + NH 3 R-CHO + NH 3 → R-CH=NH + H 2 O R-CH=NH + HCN → R-CH(NH 2 )-CN R-CH(NH 2 )-CN + 2H 2 O → R-CH(NH 2 )-COOH + NH 3 3. Взаимодействие белка с водой при добавлении кислоты [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-] n + HOH → H 2 N-CH(R)-COOH + H 2 N-CH(R’)-COOH [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-] n + HOH → H 2 N-CH(R)-COOH + H 2 N-CH(R’)-COOH 4. Добывание аминокислот клеточными организмами Микроорганизмы при нарушении нормальной жизнедеятельности начинают синтезировать аминокислоту, вместо того, чтобы накапливать белок.](https://fsd.multiurok.ru/html/2022/07/15/s_62d13793ed304/img12.jpg)


![II. Аминогруппа – ее химические реакции Многие химические свойства, характерные для аминов, встречаются и у аминокислот. Реакции задействуют только группу ––NH 2 . 1.Реакции с кислотами H 2 N-CH(R)-COOH + HCl → [H 3 N + -CH(R)-COOH]Cl - H 2 N-CH(R)-COOH + HCl → [H 3 N + -CH(R)-COOH]Cl - 2.Введение ацила в аминокислоту H 2 N-CH(R)-COOH + CH 3 -COCl → CH 3 -C(O)-NH-CH(R)-COOH + HCl H 2 N-CH(R)-COOH + CH 3 -COCl → CH 3 -C(O)-NH-CH(R)-COOH + HCl 3.Введение алкильного остатка в состав аминокислоты H 2 N-CH(R)-COOH + 2СH 3 J → (CH 3 ) 2 -N(R)-CH(R)-COOH + 2HJ H 2 N-CH(R)-COOH + 2СH 3 J → (CH 3 ) 2 -N(R)-CH(R)-COOH + 2HJ 4.Отщепление аминогруппы от аминокислоты под действием температур COOH-CH 2 -CH(NH 2 )-COOH → COOH-CH 2 -CH 2 -COOH + NH 3 COOH-CH 2 -CH(NH 2 )-COOH → COOH-CH 2 -CH 2 -COOH + NH 3](https://fsd.multiurok.ru/html/2022/07/15/s_62d13793ed304/img15.jpg)




































