
Егэ по химии задание 19

План
- Реакции окислительно-восстановительные.
- Понятие о степени окисления (С.О.) Сущность окислительно-восстановительных реакций Типичные окислители Типичные восстановители Разновидности ОВР Составление ОВР методом электронного баланса Значение ОВР
- Понятие о степени окисления (С.О.)
- Сущность окислительно-восстановительных реакций
- Типичные окислители
- Типичные восстановители
- Разновидности ОВР
- Составление ОВР методом электронного баланса
- Значение ОВР

Понятие о степени окисления (С.О.)
С.О. – основная характеристика состояния химических элементов.
Она условно обозначает заряд атома в химическом веществе, приобретенный этим атомом в процессе отдачи или принятия электронов от других элементов.
У элемента, отдавшего электрон, появляется положительная С.О., у принявшего электрон – отрицательная.
Важно помнить. В веществах молекулы электронейтральны, и сумма С.О. всех входящих в эти молекулы атомов будет всегда нулевой.
Это позволяет находить С.О. по формулам соединений.

Сущность окислительно-восстановительных реакций
Взаимодействия веществ с изменением С.О. атомов составляющих их элементов называют окислительно-восстановительными реакциями .
В этой трансформации заключается их главный и характерный признак
Ещё одно определение ОВ-реакций – это химическое преобразование, протекающее с переносом электронов от одних частиц (восстановителей) к другим (окислителям).
2Na 0 + Cl 2 0 = 2Na + Cl -
Приведенный пример ОВР умозрительно можно представить состоящим из двух полуреакций:
2Na 0 – 2e - = 2Na + – здесь идёт отдача электроотрицательных частиц (электронов) от атома натрия, являющимся в данном случае восстановителем. Происходит окисление.
Во втором полупроцессе Cl 2 + 2e - = 2Cl - – окислитель хлор, принимая электрон, участвует в восстановлении .
Усвоению этих процессов и обозначающих их терминов может помочь схема:
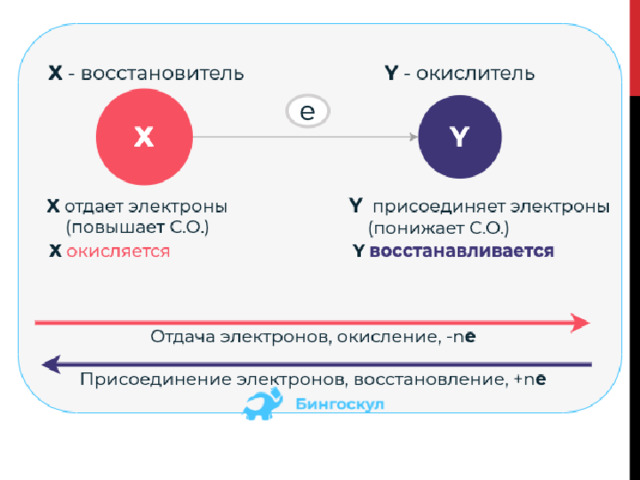

Советы для избежания путаницы в этих понятиях:
Составить аббревиатуру по первым буквам терминов:Окислитель – взял е - - восстановился → ОВВ Восстановитель – отдал е - - окислился → ВОО
Выучить стихотворение: Восстановитель — это тот, кто электроны отдает. Сам отдает грабителю, злодею-окислителю. Отдает — окисляется, сам восстановителем является.

Типичные окислители
Сильными окислителями являются неметаллы в свободном состоянии: фтор F 2 , хлор Cl 2 , бром Br 2 , йод I 2 , кислород O 2 , озон O 3 , сера S и другие.
группа кислородсодержащих кислот, в их числе: азотная HNO 3, концентрированная серная Н 2 SO 4 , хромовая H 2 CrO 4 , а также соответствующие им оксиды N 2 O 5 , Mn 2 O 7 , CrO 3.
к менее сильным окислителям относятся соли вышеназванных кислородосодержащих кислот, например, KMnO 4 (Mn +7 ), K 2 Cr 2 O 7 (Cr +7 ).
Положительно заряженные частицы металлов в самой высокой степени окисления меди Cu 2+ , олова Sn 4+ , железа Fe 3+ , ртути Hg 2+ , свинца Pb 4+ .

Типичные восстановители
Простые вещества группы металлов, например, железо Fe 0 , цинк Zn 0 , алюминий Al 0 и др.
Положительно заряженные частицы металлов в самой низкой С.О., например, олова Sn 2+ , железа Fe 2+ , свинца Pb 2+ и др.
кислородсодержащие кислоты со своими окислами, в которых кислотообразующий элемент находится в низшей степени окисления, к примеру, сернистая кислота H 2 SO 3 , азотистая кислота HNO 2 и т.д.
группа бескислородных кислот и их солей: иодистовородная кислота НI, иодид калия KI, сероводород Н 2 S, сульфид натрия Na 2 S и т.д.
У веществ, содержащих атомы элементов с промежуточной С.О., может возникать окислительно-восстановительная двойственность. Так, азотистокислый натрий будет восстановителем относительно сильных окислителей (K 2 Cr 2 O 7 ) и окислителем относительно типичного восстановителя KI.

Разновидности ОВР
Межмолекулярные . К ним относят ОВ-реакции, в которых С.О. меняются у атомов разных соединений. C 0 + O 2 0 = C +4 CO 2 -2 ; N 2 0 + 3H 2 0 = 2N -3 H 3 +1 .
Внутримолекулярные. В этом случае и окислитель, и восстановитель являются атомами одного элемента: 2H 2 O 2 -1 = 2H 2 O -2 + O 2 0 ; 2H 2 +1 O 2 -2 = 2H 2 0 +O 2 0 ;
Диспропорционирование. Другое название ОВ-реакция самоокисления-самовосстановления. В процессе её один и тот же элемент в одном и том же веществе выступает и как окислитель, и как восстановитель: Cl 2 0 + H 2 + O -2 = H + Cl - + H + Cl + O -2
Хлор Cl 2 здесь и окисляющий и восстанавливающий элемент.

Составление ОВР методом электронного баланса
При написании ОВ-реакций важно соблюдать не только закон сохранения масс веществ до и после взаимодействия, но и равенство (баланс) электрических зарядов исходных реагентов и полученных продуктов.
При способе электронного баланса производится сравнение С.О.в левой и правой части уравнения. При этом необходимо знать формулы получаемых веществ.
Правило . В уравнении ОВР слева сначала записывается восстановитель, отдающий электроны, потом окислитель, их принимающий. Справа , в первую очередь пишут продукт окисления, потом восстановления, после все остальные вещества.Пример составления уравнения ОВР углерода (С) с алюминием (Al).

Al + C → Al 4 C 3
Сначала следует определить элементы, изменившие свои С.О.
Al 0 + C 0 → Al 4 +3 C 3 -4
Алюминий, отдав три электрона, сменил С.О. с 0 до +3
Al 0 → Al +3 1Al 0 - 3e - → 1Al +3
Углерод, приняв четыре электрона, сменил свою С.О. с 0 на – 4
C 0 → C +4 1C 0 + 4e - → 1C -4
Далее уравнение нужно сбалансировать, подбирая множители. Число отданных Al электронов подставить в полуреакцию углерода C, а число принятых углеродом электронов записать в схему полуреакции алюминия:
4| 1Al 0 -3e - → 1Al +3
3| 1C 0 +4e - → 1C -4
В результате алюминий лишился 4×3 = 12 электронов, а углерод принял 3×4 = 12 электронов.
Последний этап – уравнивание количества атомов слева и справа с помощью стехиометрических коэффициентов: реакцию вступило 4·1Al 0 =4Al 0 атома алюминия и 3·1C 0 =3C 0 атома углерода.
Окончательно уравнение выглядит так:
4Al 0 +3C 0 = Al 4 +3 C 3 -4


Значение ОВР
В начале статьи говорилось о значении ОВ - процессов для жизни на Земле.
Люди научились применять их для своих нужд. Используют для получения металлов, необозримого количества веществ и материалов, для очистки окружающей среды от загрязняющих её продуктов своей жизнедеятельности.
Но познание глубин и тайн этих сложнейших явлений природы продолжается…

Задание для подготовки к егэ
Ответ: 3651.

Пояснение

Домашняя работа
Вариант № 5510457
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5510457































