
ЕГЭ по химии задание 21

План
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная

Гидролиз
Гидролиз – самый распространенный химический процесс на нашей Земле, определяющий наличие жизни на нашей планете. В результате гидролиза образуются вещества, которые определяют основной химический состав жидкостей во всех живых системах: крови, плазме, тканевой жидкости. Благодаря гидролизу между мембранами клеток функционирует натрий – калиевый насос и регулируется количество основных ионов Na + и K + .
Самый известный на Земле растворитель – вода. Почти все органические и неорганические соединения готовы растворяться в водном растворе.
По химическим свойствам H 2 O слабый электролит, плохо разлагающийся на ионы. Для водного раствора свойственна нейтральная среда. В данной среде концентрация ионов водорода и гидроксид-ионов равны.
Растворяя всевозможные вещества в воде, возможно получить различные концентрации ионов H + и OH - . Это будет находиться в зависимости от природы вещества и степени его диссоциации.
В зависимости от этого различают слабые и сильные электролиты. К сильным электролитам относятся растворимые соли, кислоты и щелочи.
Соли в водных растворах не просто растворяются, а разлагаются на ионы. Подобный процесс получил название гидролиза .
Состав солей определяется кислотой и основанием, их степенью диссоциации и химическими свойствами. Кислоты и основания могут быть сильными и слабыми.
В зависимости от состава органические вещества относятся к разной степени гидролизуемых веществ: чем выше ионизация в молекуле, тем большему гидролизу подвергается вещество.
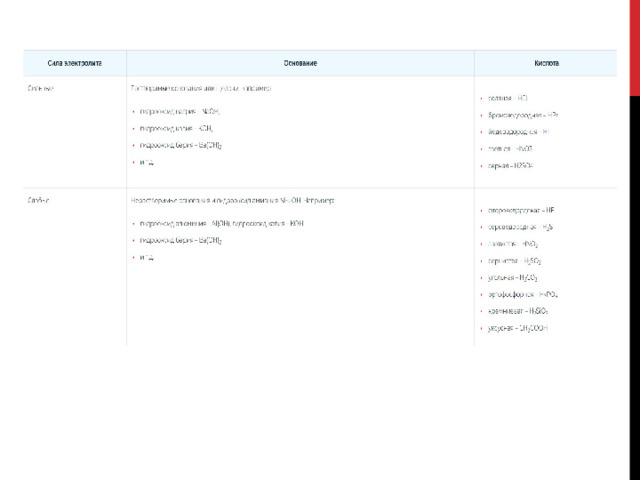
Типы гидролиза солей
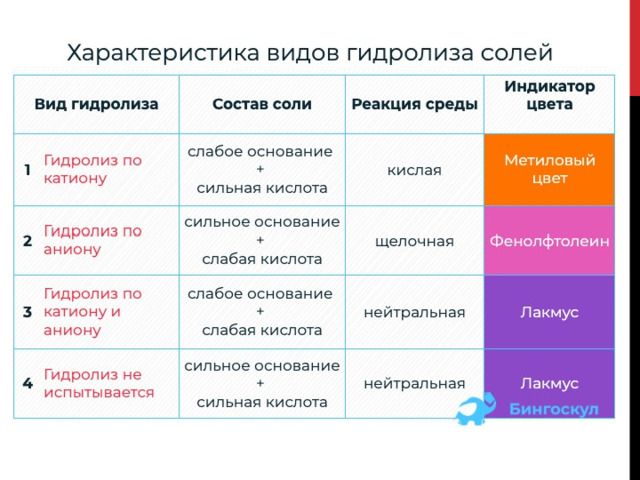
1. Для солей, которые включают слабое основание и сильную кислоту, свойственен гидролиз по катиону .
К примеру CuCl 2 , — это средняя соль. Состав представлен слабым основанием Cu(OH) 2 (нерастворимым в воде) и сильной кислотой HCl .
Все растворимые соли считаются сильными электролитами, вследствие этого при растворении в воде всецело диссоциируют на ионы.
Раствор представляет собой частичную диссоциацию молекулы воды и абсолютное разложение на ионы хлорида меди (II). OH - анионы объединяются с катионом Cu 2+ и образуют нерастворимое соединение, которое не диссоциирует на ионы. Ионы H + и Cl - связываются в молекулу сильного электролита – соляную кислоту. В итоге получается накопление в растворе ионов H + , которые обеспечивают, кислую реакцию среды раствора и изменение цвета индикаторов. Индикатор может быть метиловым оранжевым. В нейтральной среде имеет оранжевый цвет, в кислой окрашивается в красный.
Представляем процесс в виде уравнений реакции: 1) Cu 2+ + H 2 O = Cu(OH) 2 ↓ + 2H + — сокращенное ионное уравнение 2) Cu 2+ + 2Cl - + 2H 2 O = Cu(OH) 2 ↓ + 2H + + 2Cl - — полное ионное уравнение 3) CuCl 2 + 2H 2 O = Cu(OH) 2 ↓ + 2HCl — молекулярное уравнение реакции

2. Для солей, которые включают сильное основание и слабую кислоту, характерен гидролиз по аниону .
К примеру, Na 2 CO 3 представляет собой соль, образованную сильным основанием NaOH (водорастворимым) и слабой кислотой H 2 CO 3 .
Когда карбонат натрия растворяется в воде, он полностью распадается на ионы, а молекулы воды отчасти диссоциируют на ионы. В итоге процесса гидролиза ионы Na + и OH - объединяются и получается сильный электролит гидроксид натрия. В растворе накапливается избыточное общее количество гидроксильных анионов OH - , которые свойственны для щелочной реакции среды. Катионы H + и анионы CO3 2- образуют слабую углекислоту, которая в растворе распадается на воду и углекислый газ.
Составляем уравнение гидролиза: 1) CO3 2- + H 2 O = 2OH - + H 2 O + CO 2 ↑— сокращенное ионное уравнение 2) 2 Na + + CO3 2- + 2 H 2 O = 2 Na + + 2OH - + CO 2 ↑ — полное ионное уравнение 3) Na 2 CO 3 + 2 H 2 O = 2 NaOH + H 2 CO 3 — молекулярное уравнение реакции
Углекислота очень слабая, в растворе распадается на H 2 O и CO 2 .
Уравнение будет выглядеть так:
Na 2 CO 3 + 2 H 2 O = 2 NaOH + H 2 O + CO 2 ↑
3. Гидролиз по катиону и аниону характерен для солей, которые состоят из слабого основания и слабой кислоты.Например, (NH 4 ) 2 S представляет собой среднюю соль, образованную слабым основанием NH 4 OH и слабой кислотой H 2 S .
При растворении сульфида аммония в водном растворе происходит образование малодиссоциирующих веществ-гидроксида аммония и сероводорода. В растворе остаются лишь только молекулы воды, растворная среда станет нейтральной.
Составляем уравнение гидролиза: 1) (NH 4 ) 2 S + H 2 O = 2NH 3 ↑ + H 2 O +H 2 S ↑ — молекулярное уравнение реакции 2) Полное и сокращенное ионные уравнения отсутствуют
4. Гидролизу не подвергается соль, состоящая из сильного основания и сильной кислоты.Например, BaCl 2 представляет собой соль, образованную сильным основанием Ba(OH) 2 (водорастворимым) и сильной кислотой HCl .
Представленный тип солей не содержит кислотных остатков и катионов металлов, реагирующих с водой, т. е. способных влиять на РН водного раствора. Консистенции таких солей имеют нейтральную реакционную среду. В процессе растворения в воде образуются сильные электролиты, полностью распадающиеся на ионы.

Процессы диссоциации и гидролиза считаются обратимыми и подчиняются совокупным закономерностям смещения химического равновесия. Данные процессы возможно усиливать и замедлять, добавляя в раствор одноименный ион, разбавляя раствор или же нагревая его.
Для составления уравнений гидролиза солей существует конкретный алгоритм:
1. Запишите формулу соли и определите ее растворимость в воде, применяя таблицу растворимости солей, кислот и оснований в воде.
- ZnCl 2 растворимый в воде
- ZnCl 2 растворимый в воде
2. В случае если соль растворима, составьте уравнение диссоциации
- ZnCl 2 ⟷ Zn 2+ + 2Cl -
- ZnCl 2 ⟷ Zn 2+ + 2Cl -
3. Определите состав соли
 7. В данном случае среда является кислой. В данном случае среда является кислой. 7. Составьте полное ионное уравнение соли Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- 8. Составим молекулярное уравнение гидролиза ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl " width="640"
7. В данном случае среда является кислой. В данном случае среда является кислой. 7. Составьте полное ионное уравнение соли Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- 8. Составим молекулярное уравнение гидролиза ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl " width="640"
4. Сделайте вывод, какой из ионов соли подвергается гидролизу:
- Zn 2+ — ион, образующий слабый электролит, поэтому он подвергается гидролизу.В данном случае гидролиз проходит по катиону.
- Zn 2+ — ион, образующий слабый электролит, поэтому он подвергается гидролизу.В данном случае гидролиз проходит по катиону.
5. Составляем краткое ионное уравнение
- Zn 2+ + 2H 2 O = Zn(OH) 2 ↓ +2H +
- Zn 2+ + 2H 2 O = Zn(OH) 2 ↓ +2H +
6. Определите среду и рН раствора соли. Если в кратком ионном уравнении появляется 2H + — кислый раствор среды, рН OH - , то среда в растворе щелочная, рН 7.
- В данном случае среда является кислой.
- В данном случае среда является кислой.
7. Составьте полное ионное уравнение соли
- Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl-
- Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl-
8. Составим молекулярное уравнение гидролиза
- ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl
- ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl

Задание для подготовки к егэ
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Ответ: 4231.

Пояснение

Домашняя работа
Вариант № 5510468
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5510468












 7. В данном случае среда является кислой. В данном случае среда является кислой. 7. Составьте полное ионное уравнение соли Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- 8. Составим молекулярное уравнение гидролиза ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl " width="640"
7. В данном случае среда является кислой. В данном случае среда является кислой. 7. Составьте полное ионное уравнение соли Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- Zn 2+ + 2Cl - + 2 H 2 O = Zn(OH) 2 ↓ +2H + + 2Cl- 8. Составим молекулярное уравнение гидролиза ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl ZnCl 2 + 2H 2 O = Zn(OH) 2 ↓ + 2HCl " width="640"





















