
ЕГЭ по химии задание 25

План
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
Понятие о металлургии: общие способы получения металлов
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
Природные источники углеводородов, их переработка
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Применение изученных неорганических и органических веществ

Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории
Лабораторная посуда и оборудование
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии

Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Химия — полезный предмет, который любят многие школьники благодаря интересным опытам. Однако, попав в лабораторию, многие не придают значения установленным правилам, касающимся техники безопасности. Устроившись на работу в лабораторию, каждый молодой специалист желает показать более опытным коллегам свою осведомленность и серьезное отношение к новым обязанностям. И, если какие-то пробелы школьных знаний можно восполнить в процессе работы, то несоблюдение элементарных требований безопасности часто ведет к плачевным результатам.
Поэтому необходимо знать, как правильно вести себя в лаборатории, как обращаться с оборудованием, лабораторной посудой, химическими веществами.
Правила работы в лаборатории
- Приступая к работе, надеть халат, застегнув все пуговки. Это необходимо для защитить от испарений и мельчайших брызг, которые образуются в процессе работы. С этой же целью надевается закрытая обувь, собираются в пучок длинные волосы, используются защитные очки, маски, перчатки. (только при работе с токсичными, огнеопасными веществами)
- Соблюдать порядок и чистоту, строго придерживаться правил техники безопасности на рабочем месте
- Избегать употребления и хранения пищевых продуктов, питьевой воды.
- Избегать проведения анализов с использованием неисправного оборудования, треснувшей или грязной посуды: посуда для проведения опытов с использованием горелок должна быть из огнеупорного стекла, на пробирке должен находиться знак с отметкой о термической устойчивости посуды.
- Прикреплять этикетки с названиями и формулами реактивов ко всей имеющейся посуде.
- Осторожно обращаться с веществами и растворами: переливать из склянки в пробирку нужно только при соприкосновении горлышка склянки и горлышка пробирки. Пересыпать твердое вещество в пробирку или ступку необходимо в строго определенном отмеренном количестве и при помощи мерной ложечки.

- Не направлять горлышко емкости с химическими веществами в сторону другого человека во время их нагревания: направлять горлышко пробирки при нагревании нужно от себя и от соседа.
- Прогревание сначала осуществляется по всей длине пробирки и только затем в месте, где находится вещество Обеспечить свободный доступ к аптечке со средствами, предназначенными для оказания первой помощи.
- Обеспечить свободный доступ к противопожарным средствам — ящику с песком и лопаткой, противопожарному войлочному или асбестовому одеялу, исправному огнетушителю.
- Избегать попадания химических веществ на слизистые оболочки, открытые участки тела: при попадании вещества в зависимости от состава необходимо незамедлительно промыть раствором щелочи, перекиси водорода и большим количеством проточной воды.
- Обратиться в медпункт.
- Опыты с использованием ядовитых и вредных веществ проводить только во включенном вытяжном шкафу под наблюдением старшего лаборанта или учителя

- По окончанию работы следует тщательно помыть всю посуду под проточной водой.
- Запрещается пробовать химические вещества на вкус. Чтобы понюхать его, следует легким движением руки направить к себе газы из сосуда.
- Наклоняться над сосудом и заглядывать в него сверху нельзя, чтобы не получить травму при случайном выбросе горячего препарата.
Нужно помнить, что для утилизации концентрированных щелочей и кислот, органических растворителей предусмотрены специальные бутыли, которыми оснащается любая лаборатория. Для хранения бутылей используется вытяжной шкаф. Выливать такие средства в раковину категорически запрещено, поскольку это ведет к загрязнению окружающей среды, а также образованию ядовитых побочных продуктов, которые могут выбрасываться из раковины в виде паров или капель жидкости

Лабораторная посуда и оборудование
Лабораторная тара изготавливается из фарфора или термоустойчивого стекла. Применять какие-либо другие емкости, не предусмотренные для использования в лабораторных условиях, запрещено.
К лабораторной посуде относятся:
Исследование небольших объемов веществ осуществляется в пробирках, при работе с которыми запрещается использовать собственные пальцы для закрытия пробирки во время ее встряхивания. Нельзя проводить анализы в не помытой после предыдущего опыта пробирке.
Большие объемы препаратов помещаются для исследования в колбу или стакан. При работе с данными емкостями необходимо:
- Осуществлять перемешивание содержимого путем совершения круговых движений, или используя специальную стеклянную палочку. Чтобы она не повреждала стенки стеклянной емкости, на ее конец надевают кусочек резиновой трубки.
- Переливание химических растворов из сосудов с широким горлышком в емкости с узким горлышком осуществляется с использованием воронки.
- Фильтрование реактивов необходимо проводить в воронке, на дно которой помещается предварительно смоченный водой бумажный фильтр. Раствор выливают на фильтр тонкой струйкой, направляя ее на стеклянную палочку, расположенную у стенки воронки.
- Выпаривание жидкостей осуществляется в выпарительных чашах, надежно закрепленных на кольце штатива. Держать их в руках во время нагрева категорически запрещено. Для нагревания чаш используется пламя спиртовки. Наклоняться над чашей во время ее нагревания нельзя.
- Если процесс исследования вещества предполагает выделение каких-либо газов, их отводят из используемой посуды газоотводной трубкой, герметично соединенной с горлышком емкости.
Лабораторный штатив, при помощи которого закрепляется посуда пи проведении опытов, представляет собой подставку со стержнем, оснащенным кольцом, лапкой и муфтой. Последняя выполняет функцию перемещения лапки и кольца по стержню и регулировки их высоты. Для их фиксации применяются специальные винты. Колбы и пробирки, закрепляются в лапке, должны смотреть отверстием кверху и располагаться вертикально.
Спиртовка, с помощью которой нагреваются реактивы, представляет собой сосуд, заполненный спиртом. В сосуде имеется колпачок и фитиль, прикрепленный к металлической трубочке с диском. Перед проведением опыта колпачок снимают и проверяют плотность прилегания диска к отверстию емкости. Для поджигания спиртовки допускается использовать только горящую спичку.
Нагревание реактивов также можно осуществлять при помощи горелки, которая выполнена в виде металлической трубочки с двумя отверстиями. На подставке имеется боковая трубка со шлангом, присоединенным к газовому крану. Поступающий в горелку газ смешивается с воздухом, проникающим сквозь боковые отверстия. Верхняя, средняя и нижняя части пламени отличаются разной температурой. Наиболее высокая температура в верхней зоне пламени. Использовать для нагревания сосудов во время проведения опытов допускается только данную зону.
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Манипуляции с препаратами бытовой химии, легковоспламеняющимися, едкими и токсичными средствами требуют соблюдения определенных правил, позволяющих избежать неприятных ситуаций в ходе проведения опытов.
- При возникновении необходимости разбавить кислоту водой, кислоту вливают в воду как можно медленнее, тонкой струйкой.
- Для растворения щелочей допускается использовать только фарфоровую посуду. Для захвата кусочков твердого щелочного материала используется пинцет или щипцы. Растворение щелочи в фарфоровой емкости осуществляется путем добавления в воду небольших порций вещества. Во время выполнения данных манипуляций нужно постоянно помешивать раствор.
- При случайном проливе щелочи или кислоты на рабочую столешницу нужно как можно скорее насыпать на загрязненное место сухой песок. Смесь вытекшего вещества на стол с песком требуется постоянно перемешивать до тех пор, пока песок полностью поглотит всю жидкость. Далее осуществляется немедленная уборка загрязненного песка в стеклянную емкость с его последующим промыванием и нейтрализацией.
- В случае попадания щелочи или кислоты на открытые участки кожи их немедленно стряхивают и промывают кожу под краном с сильным напором холодной воды. Затем пораженное место обрабатывается раствором соды (3%), и смазывается вазелином.

- Переливая растворы из тары нужно следить, чтобы этикетка с наименованием вещества находилась сверху.
- При работе с агрессивными средствами бытовой химии (стиральными порошками, препаратами для чистки сантехники, отбеливателями) нужно использовать защитные перчатки.
- Работа с сильно пахучими веществами должна проводиться в хорошо проветриваемом помещении.
- При хранении бытовой химии необходимо следить, чтобы все емкости были плотно закрыты. Все реактивы следует хранить в прохладном месте, защищенном от прямых солнечных лучей.
Каждое химическое вещество и средство бытовой химии отличается своими свойствами и особенностями взаимодействия с другими препаратами. Прежде, чем приступать к проведению лабораторных анализов, надо изучить всю информацию, касающуюся безопасного обращения с препаратами. При работе следует неукоснительно соблюдать требования и инструкции, касающиеся особенностей веществ, сроков их годности и прочих данных.

Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
Смесь — система, включающая в себя два или более веществ, которые не реагируют между собой.
Типы смесей:
Гетерогенные или неоднородные (механические смеси). Это такие смеси, в которых невооружённым глазом, в редких случаях при помощи увеличительного прибора, можно отчётливо наблюдать границы между молекулами разных веществ. Для примера можно привести суспензии, смесь порошков, эмульсии, дым.
Гомогенные или однородные (растворы). Это такие смеси, в которых невозможно наблюдать границы между молекулами, даже при сильном увеличении, так как молекулы веществ сильно перемешаны друг с другом. Для примера можно привести жидкие (смесь спирта с водой), твёрдые (сплавы) и газовые (смесь газов, не реагирующих друг с другом) растворы.

Методы разделения смесей
- Метод отстаивания. Этот метод основан на разности плотностей различных веществ. Для этого смесь, которую необходимо разделить, помещают в воду, вещества с низкой плотностью поднимаются на верху, а вещества с большей – опускаются на дно посуды. Чтобы ускорить этот процесс в лаборатории используется метод центрифугирования. Он основан на центробежной силе, которая зависит от скорости вращения центрифуги. Для разделения различных веществ существуют индивидуальная скорость вращения в секунду, благодаря которой смесь разделяется.
- Метод декантации. После отстаивания жидкостей, образовавшиеся слои можно разделить при помощи делительной воронки. Суть метода можно увидеть в следующем рисунке.
- Метод фильтрации. Суть метода заключается в способности фильтра задерживать твёрдые частички и пропускать жидкость. . В случае использования отстаивания для разделения веществ разных агрегатных состояний, завершающим этапом является фильтрация.
Методы разделения смесей
- Метод магнитной сепарация. Основан на магнитных свойствах веществ, под действием магнитного поля. Для примера можно привести смесь серы и порошка железы. Железо, обладающие магнитными свойствами притягивается к магниту, а сера остаётся в посуде.
- Метод выпаривания. Используется для разделения тугоплавкого вещества и жидкости. Скорость выпаривание регулируется температурой, давлением, площади поверхности испарения.
- Метод перегонки (дистилляция). Этот метод используется для разделения веществ с приблизительно одинаковыми температурами кипения, а так же используется для разделения летучих веществ от нелетучих. Суть в том, что при закипании смеси быстрее улетучиваются жидкости с более низкой температурой кипения. Пары конденсируются и стекают в приёмник.
- Метод хроматографии. Этот метод основан на разности скоростей поглощения одних частиц другими. В стеклянную трубку насыпается порошок мела и смачивается бензолом. Сверху вливают раствор, который необходимо разделить. Все молекулы из-за разного строения и состава по-разному сорбируются, могут прочно крепиться или более слабо, меньше находиться в растворе и больше в связанном состоянии. На следующей иллюстрации можно наблюдать хроматографию хлорофилла.
- Метод адсорбции. Суть метода в том, что твёрдый компонент (адсорбент) всей поверхностью тела поглощает газовый компонент в результате реакции. Вещество, образованное на адсорбенте, можно отделить от него путём десорбции. Адсорбент используется повторно, а отделённое вещество по назначению. В качестве адсорбентов обычно служат пористые твердые вещества, имеющие большую удельную поверхность.
Понятие о металлургии
Металлургия — получение металлов из руд — один из древнейших видов человеческой деятельности. Еще во втором тысячелетии до н. э. в Египте умели выплавлять железо из железной руды. Так называемый железный век пришел на смену бронзовому, тот, в свою очередь, наступил после каменного.
Получают металлы из рудных полезных ископаемых. Например, халькопирит или медный колчедан — сырье для производства железа, меди и серы (Рис. 1). Химическая формула минерала CuFeS2. Металлы в составе других руд находятся в виде оксидов или солей неорганических кислот, химически связанных катионов.
Суть металлургического процесса заключается в восстановлении положительных ионов до свободных атомов металла. Используют в качестве источников электронов углерод и его соединения, водород, металлы. В процессе восстановления катионы получают недостающие электроны. Происходит восстановление электронных оболочек металла. Схема процесса:
Ме+n + ne- → Me, где
Ме+n — металл в окисленной форме;
+n — степень окисления;
ne- — количество присоединяемых электронов;
Ме — металл в восстановленной форме.

Способы получения металлов
В зависимости от того, кокой восстановитель используют в металлургическом процессе различают: пиро - , гидро, электро - и биометаллургию.
Наиболее распространенные способы получения металлов: пирометаллургический и электрометаллургический. Большинство реакций восстановления протекают при высоких температурах. Так как металлическая связь обладает повышенной прочностью, то выделение металлов в чистом виде из природных соединений проводят при высоких температурах.

Пирометаллургический способ
Пирометаллургия — получение металлов из руд при высоких температурах при участии восстановителей. В переводе с греческого «пирос» означает «огненный». Используют в качестве восстановителей кокс, диоксид углерода, водород. Применяют активные металлы для получения менее активных.
Пирометаллургия подразделяется на
карботермия,
водородотермия,
металлотермию.
Карботермия: перевод сульфида металла путем обжига в оксид и дальнейшим восстановлением углем до чистого состояния.
2ZnS + 3O2 = 2ZnO + 2 SO2
ZnO + C = CO + Zn
Руды, состоящие из оксидов и сульфидов железа, подвергают карботермии. Проводят восстановление коксом или диоксидом углерода (угарным газом). Получают сплавы железа — чугун и сталь. Первый содержит больше углерода, а также оксидов серы, фосфора и кремния. Углерод снижает твердость и другие характерные для металлов качества.
Химические реакции, лежащие в основе выплавки чугуна:
C + O 2 = CO 2 ↑,
CO 2 + C ↔ 2CO↑,
3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 ↑,
Fe 3 O 4 + CO = 3FeO + CO 2 ↑,
FeO + CO = Fe + CO 2 ↑.

Сталь выплавляют в специальных печах
Сталь выплавляют в специальных печах — электрических, конвертерных, мартеновских. При продувании обогащенного кислородом воздуха выгорает избыточный углерод, его содержание уменьшается до 2% и ниже. Этот способ является более экономически применим, т.к. при помощи него получают сталь и чугун, которые широко используются в современной промышленности.
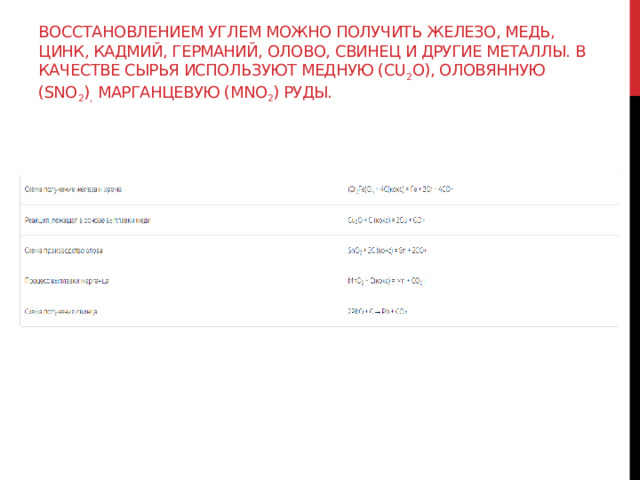
Восстановлением углем можно получить железо, медь, цинк, кадмий, германий, олово, свинец и другие металлы. В качестве сырья используют медную (Cu 2 O), оловянную (SnO 2 ) , марганцевую (MnO 2 ) руды.

Металлы можно извлечь из сульфидных руд. Сначала проводят обжиг, затем — восстановление полученного оксида углем. Схемы обжига цинковой обманки и получение цинка:
2ZnS +3O 2 = 2ZnO + 2SO 2 ↑;
ZnO + C = Zn + CO↑.
Карбонаты тоже прокаливают с углем для получения оксидов и последующего восстановления углем. Схемы обжига сидерита и восстановления оксида железа:
FeCO 3 = FeO + CO 2 ↑;
FeO + C = Fe + CO↑.
Водородотермия — производство металлов восстановлением водородом
Достоинством этого металлургического метода является получение очень чистых металлов. Восстановление меди из оксида CuO — пример восстановительных свойств водорода из школьного курса неорганической химии. Схема протекания реакции
Водородом восстанавливают из оксидов тугоплавкие металлы молибден и вольфрам.
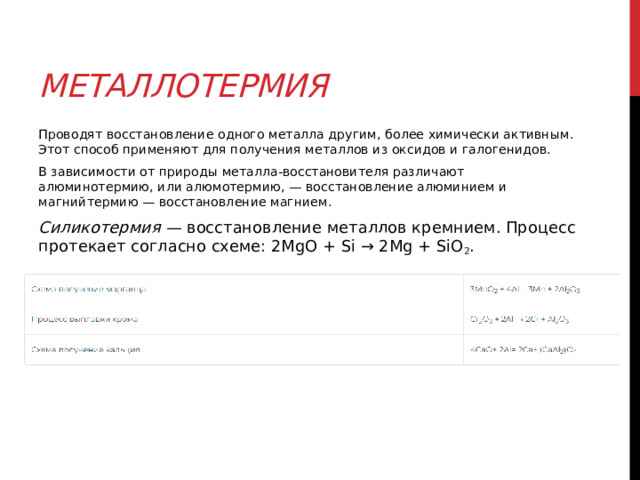
Металлотермия
Проводят восстановление одного металла другим, более химически активным. Этот способ применяют для получения металлов из оксидов и галогенидов.
В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием.
Силикотермия — восстановление металлов кремнием. Процесс протекает согласно схеме: 2MgO + Si → 2Mg + SiO 2 .

Гидрометаллургический способ
Гидрометаллургия — способ получения благородных, цветных, редких металлов. Например, оксид меди сначала переводят в сульфат с помощью серной кислоты. Медь вытесняют из раствора железом. Протекает следующая реакция замещения: CuSO 4 + Fe = Cu + FeSO 4 . Либо медь извлекают из раствора электролизом. Пропускают электрический ток, ионы Cu 2+ осаждаются на катоде.
Преимущество гидрометаллургического способа — возможность получать металлы из бедных руд. Еще один плюс метода — снижение газообразных выбросов в атмосферу. Большое количество вредных газов и сажи поступает в воздух при обжиге руды и пирометаллургии.

Электролиз
Электролиз расплавов оксидов, солей и гидроксидов проводят для получения металлов, расположенных в ряду активности от лития до марганца. Электролиз водных растворов служит для производства менее активных металлов.
Электролиз расплавов
Катодные (восстановительные) процессы . На катоде происходит восстановление катионов металлов и водорода или молекул воды.
Для растворов кислот: К(-) Н + + 2 е - ⟶H 2 0 ↑.
Для растворов солей или щелочей: К(-) M n+ , H 2 O.
Характер восстановительного процесса зависит от значения стандартного потенциала металла:
Схема электролиза расплава хлорида натрия: 2NaCl (эл. ток) → 2Na + Cl 2 ↑.
Схема электролиза сульфата марганца в растворе: 2MnSO 4 + 2H 2 O (эл. ток) → 2Mn + O 2 ↑+2H 2 SO 4 .
Способ термического разложения
Железо с диоксидом углерода при повышенных давлении и температуре образует пентакарбонил Fe(CO)5. Эту жидкую субстанцию перегоняют для очистки от примесей, затем нагревают. Карбонил разлагается с образованием порошка железа. Дальнейшее нагревание в вакууме или атмосфере водорода приводит к получению очень чистого железа. Схема процесса: Fe(CO)5 → Fe + 5CO↑.
Биометаллургия
Способ, основанный на биохимических процессах с участием микроорганизмов. Метод получил распространение на Западе, так как позволяет меньше загрязнять окружающую среду. Биометаллургия служит для получения меди, серебра, никеля, свинца, урана, рения и ряда других металлов.
общие способы получения металлов
Кроме собственно добычи металла из природных соединений (руд), металлургия включает в себя вторичную переработку сплавов и металлических изделий. Минеральные ресурсы Земли огромны, но конечны, а переплавка бывших в употреблении изделий бывает выгоднее и проще. Иногда обработку металлов тоже относят к металлургии, поэтому можно сказать, что это действительно одна из самых крупных областей промышленности.

Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
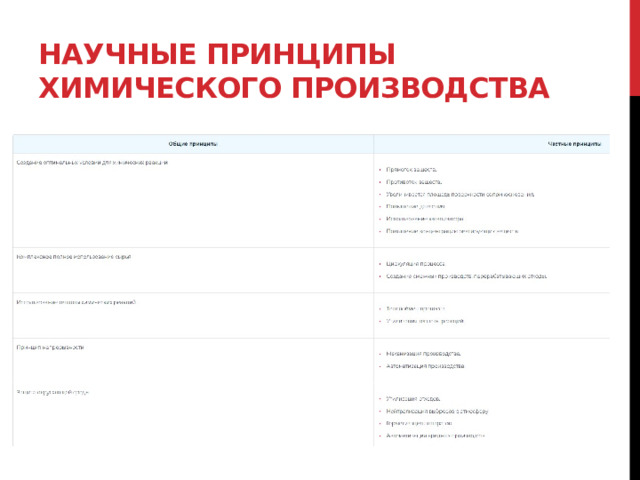
Научные принципы химического производства
Производство аммиака
Производство серной кислоты
Производство метанола
Химическое загрязнение окружающей среды и его последствия
Научные принципы химического производства
Производство аммиака
Первый шаг – получение из азота и водорода азотоводородной смеси. Азот получается посредством фракционной перегонки жидкого воздуха. Источником водорода выступает процесс паровой природного газа или угля.
Турбокомпрессор сжимает смесь, пока не будет получено давление в 25*10 6 Па. Температура для протекания требуемых химических реакций находится в диапазоне: 400-500 °С. Для ускорения используется катализатор – пористое железо, содержащее примеси K 2 O и Al 2 O 3 .
Данный химический процесс является равновесным: при изменении условий происходит изменение количество продукта реакции, поэтому при проведении данного процесса нужно следить за внешними факторами, которые влияют на протекание химического процесса.
Создаваемый аммиак отделяют от непрореагировавшего водорода и азота в холодильнике процессом сжижения. Непрореагировавшая смесь возвращается в колонну синтеза. Процесс циркулирует непрерывно, пока не будет истрачен требуемый исходный материал. Применяется получаемый аммиак для производства взрывчатых веществ, азотных удобрений, пластических масс и ещё ряда продукции химического производства.

Производство серной кислоты
Серная кислота относится к числу сильных кислот. Для получения используется очищенный измельченный влажный пирит (другое название – серный колчедан). Сырьё сверху засыпается в печь, чтобы обжечь вещество. Снизу, по принципу противотока, пропускается воздух, обогащенный кислородом.
Результат обжига в печи: SO 2 , пары воды и мельчайшие частицы оксида железа (огарок). Газ очищается от примесей. Твёрдые частицы задерживает электрофильтр и циклон. Для водных паров предусматривается сушильная башня.
Контактный аппарат окисляет сернистый газ с помощью катализатора пятиокиси ванадия. Процесс окисления обратим, для чего подбирают оптимальные условия, способствующие протеканию прямой реакции: повышается давление и поддерживается температура на свыше отметки в 500 °С.
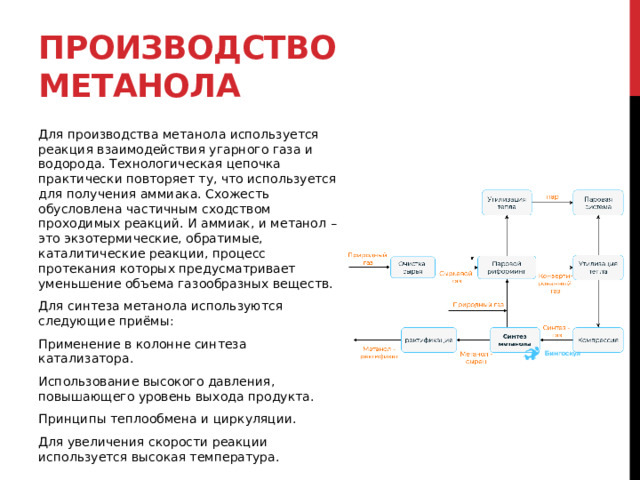
Производство метанола
Для производства метанола используется реакция взаимодействия угарного газа и водорода. Технологическая цепочка практически повторяет ту, что используется для получения аммиака. Схожесть обусловлена частичным сходством проходимых реакций. И аммиак, и метанол – это экзотермические, обратимые, каталитические реакции, процесс протекания которых предусматривает уменьшение объема газообразных веществ.
Для синтеза метанола используются следующие приёмы:
Применение в колонне синтеза катализатора.
Использование высокого давления, повышающего уровень выхода продукта.
Принципы теплообмена и циркуляции.
Для увеличения скорости реакции используется высокая температура.
Химическое загрязнение окружающей среды и его последствия
Недостаток химического производства – загрязнение окружающей среды, вредоносное влияние на здоровье и жизнь человека и местной флоры с фауной. Негативные последствия накапливаются, приводя к ухудшению самочувствия. При размещении химического предприятия окружающая обстановка может кратно ухудшиться. Падает уровень жизни и удовлетворенность.
Чтобы не допустить этого, с химическим загрязнением окружающей среды борются. Это достигается с помощью следующих мер:
Создание новых технологий и технических объектов, ориентированных на ресурсосбережение и малоотходность.
Получение наибольшего объема продукции требуемого качества с наименьшими вложениями.
Стремление к полному использованию исходного сырья.
Поддержание экологической безопасности на предприятии.
Государство заинтересовано в поддержания благоприятной экологической обстановки. Для стимулирования уменьшения химического загрязнения окружающей среды и последствий используется налоговая экологическая политика, привязанная к объему выбросов и уровню опасности.

Природные источники углеводородов, их переработка
Природные источники углеводородов
Их переработка
Обработка попутного нефтяного газа
Природные источники углеводородов
Нефть – это природная маслянистая горючая жидкость, обладающая специфическим запахом, темно-коричневого (черного, красного, синего, белого) цвета или бесцветная, состоящая из сложной смеси углеводородов различной молекулярной массы (алканов, циклоалканов, аренов) и ряда других химических соединений.
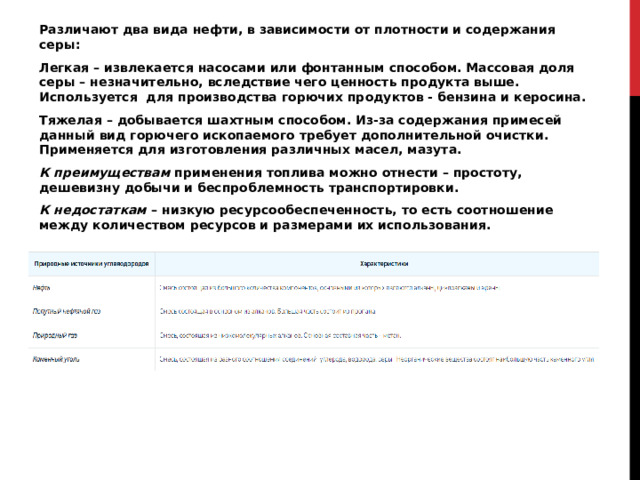
Различают два вида нефти, в зависимости от плотности и содержания серы:
Легкая – извлекается насосами или фонтанным способом. Массовая доля серы – незначительно, вследствие чего ценность продукта выше. Используется для производства горючих продуктов - бензина и керосина.
Тяжелая – добывается шахтным способом. Из-за содержания примесей данный вид горючего ископаемого требует дополнительной очистки. Применяется для изготовления различных масел, мазута.
К преимуществам применения топлива можно отнести – простоту, дешевизну добычи и беспроблемность транспортировки.
К недостаткам – низкую ресурсообеспеченность, то есть соотношение между количеством ресурсов и размерами их использования.

Природный газ
Природный газ — это смесь газов, образовавшихся в недрах земли посредством анаэробного разложения органических веществ. Содержание углеводородов в природном ресурсе низкое, 80- 97% составляет метан и незначительный процент – пропан, бутан, этан.
Преимущества данного вида топлива – простота добычи и транспортировки, экономичность.
Недостатки – сложность межконтинентальной транспортировки с помощью дорогостоящих танкеров.
Природный газ не имеет запаха, но для обнаружения протечек вещества в быту, в него добавляют специальные компоненты – меркаптаны. Это связано с тем, что смесь метана с воздухом взрывоопасна, небольшая искра способна спровоцировать происшествие.

Попутный нефтяной газ
Попутный нефтяной газ – это смесь газообразных углеводородов, содержащихся в нефти и выделяющихся при ее добыче и подготовке. Чем ниже молекулярная масса алкана, тем выше его концентрация в природном ресурсе.
Смесь бутана и пропана образует сжиженный газ, который применяется в качестве бытового топлива.
В зависимости от содержания углеводорода попутный газ делится на следующие группы:
- чистый (95–100%);
- углеводородный с примесью углекислого газа 4-20%;
- углеводородный с примесью азота 3-15%;
- углеводородно-азотный, содержанием примесей до 50% соответственно.

Каменный уголь
Данный вид горючего ископаемого относится к твердым, и представляет собой многокомпонентную смесь углеводородов, азота, серы, кислорода и неорганических веществ. Доля углерода составляет 80 %, остальные 20% - органические и неорганические компоненты. Чем выше содержание газа, тем большей теплотворностью обладает вещество, чем ниже – тем дольше уголь может храниться.
Образование данного вида горючего ископаемого проходит в два этапа:
Появление торфа из остатков растений и живых организмов.
Формирование твердого угля.
Данный вид топлива является достаточно перспективным для получения ряда химических продуктов и энергии.
Их переработка
Полезные ископаемые требуют переработки для дальнейшего использования и получения необходимых продуктов.
Переработка нефти
В сыром виде данный ресурс не применяется. Переработка может быть первичной и вторичной.
1. Первичная переработка – заключается в ректификации нефти, путем ее нагревания, не приводящая к химическим изменениям вещества. В процессе повышения температуры улетучиваются сначала легкокипящие элементы, затем требующие более высокой температуры.
На подготовительном этапе требуется очитка нефти от воды, солей и твердых механических частиц. Далее вещество поступает в трубчатую печь, где подвергается нагреванию до 350 °С. Горячий состав перемещается в нижнюю часть ректификационной колонны, в которой осуществляется испарение отдельных фракций на разные уровни, в зависимости отих температуры кипения:
ректификационные газы (верхняя часть, температура кипения не более 40 о С);
бензиновая фракция (35 -200 о С);
лигроиновая фракция (150 - 250 о С);
керосиновая фракция (190 - 300 о С);
дизельную фракцию (200 -300 о С);
мазут (нижняя часть колонны, температура кипения более 350 о С).

2. Вторичная: крекинг и риформинг – необходимы для повышения выхода после переработки более дорогих и качественных фракций.
Крекинг – способ обработки мазута путем нагревания с совместным воздействием катализатора, для увеличения выхода бензиновой фракции.
Риформинг – направлен на улучшение качественных характеристик бензиновой фракции путем реакций дегидроциклизации.

Переработка природного газа
Содержание примесей в природном газе затрудняет его дальнейшую транспортировку и использование. В связи с этим он подвергается переработке:
Сушке – для удаления серы и воды.
Переработка производственным методом в целях придания товарного вида:
- термохимическим способом – при высокой температуре и давлении; физико-энергетическим – охлаждением или нагреванием ресурса для его сжатия и деления; химико-каталитическим – методом парциального окисления или паровой, углекислой конверсии.
- термохимическим способом – при высокой температуре и давлении;
- физико-энергетическим – охлаждением или нагреванием ресурса для его сжатия и деления;
- химико-каталитическим – методом парциального окисления или паровой, углекислой конверсии.
В результате процессов образуются вещества: источники энергии и химические продукты (аммиак, уксусная кислота, метонол и др.).

Обработка попутного нефтяного газа
Концентрация продуктов нефтепереработки негативно влияет на экологию и здоровье населения. В связи с этим возникла необходимость в переработке ПНГ и практическом применении.
Существуют несколько способов утилизации и переработки:
Фракционный метод – основан на разделении газа на компоненты.
Закачка в пласт нефти, для повышения давления и увеличения объемов добычи.
Мембранная очистка с дальнейшим сжижением и использованием для получения топлива и нефтехимического сырья.
Переработка в сжиженный газ.
Переработка каменного угля
Переработка данного вида ресурса называется коксованием, которое осуществляется путем накаливания угля до 900-1100°С без доступа воздуха.
В результате получаются следующие продукты:
кокс с высоким содержанием углерода;
коксовый газ;
каменноугольная смола.
Более 90% всей энергии, потребляемой человечеством в настоящее время, добывается из ископаемых природных органических соединений. ПО своим свойствам газ превосходит нефть.

Высокомолекулярные соединения. Реакции полимеризации и поликонденсации
Реакции полимеризации
Реакции поликонденсации
Характеристика полимеров

Высокомолекулярные соединения
Высокомолекулярные соединения – это полимеры, у которых молекулярная масса больше 10000. Полимер – это соединение, состоящее из большого числа звеньев – мономеров (низкомолекулярных веществ), которые повторяются в полимерной цепи большое количество раз .
Число n показывает, из скольких мономеров состоит полимер, и называется степенью полимеризации. Молекулярная масса иногда достигает нескольких миллионов.
Высокомолекулярные соединения классифицируются по характеру мономеров:
гомополимеры – вещества, состоящие из одинаковых мономеров. Например, пропилен CH 2 =CH-CH 3 – это мономер полипропилена (-CH(CH 3 )-CH 2 -) n ;
гетерополимеры – вещества, состоящие из двух разных мономеров. Например, при взаимодействии 1,3-дивинила и стирола получается стирольный каучук.
n CH 2 =CH-CH=CH 2 + n C 6 H 5 -CH=CH 2 → (-CH 2 -CH=CH-CH 2 -CH(C 6 H 5 )-CH 2 -) n
Полимеры получают с помощью:
реакции полимеризации;
реакции поликонденсации.
![Реакции полимеризации Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции: n X → (-X-) n Самой распространенной реакций полимеризации является реакция получения полиэтилена: nC 2 H 4 = (CH 2 – CH 2 ) n реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией. I. Гомополимеризация К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей: n CH 2 =CH-CH 3 → (CH 2 -CH(CH 3 )-) n II. Сополимеризация К этим реакциям относят получение сополимера этилена и пропилена: n CH 2 =CH 2 + n CH 2 =CH-CH 3 → [(-CH 2 -CH 2 -) x – (-CH 2 -CH(CH 3 )-) y ] n , где 1Полимеры, которые получают в результате реакций полимеризации](https://fsd.multiurok.ru/html/2022/07/17/s_62d3ba5b4efd3/img43.jpg)
Реакции полимеризации
Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции:
n X → (-X-) n
Самой распространенной реакций полимеризации является реакция получения полиэтилена:
nC 2 H 4 = (CH 2 – CH 2 ) n
реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией.
I. Гомополимеризация
К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей:
n CH 2 =CH-CH 3 → (CH 2 -CH(CH 3 )-) n
II. Сополимеризация
К этим реакциям относят получение сополимера этилена и пропилена:
n CH 2 =CH 2 + n CH 2 =CH-CH 3 → [(-CH 2 -CH 2 -) x – (-CH 2 -CH(CH 3 )-) y ] n , где 1
Полимеры, которые получают в результате реакций полимеризации
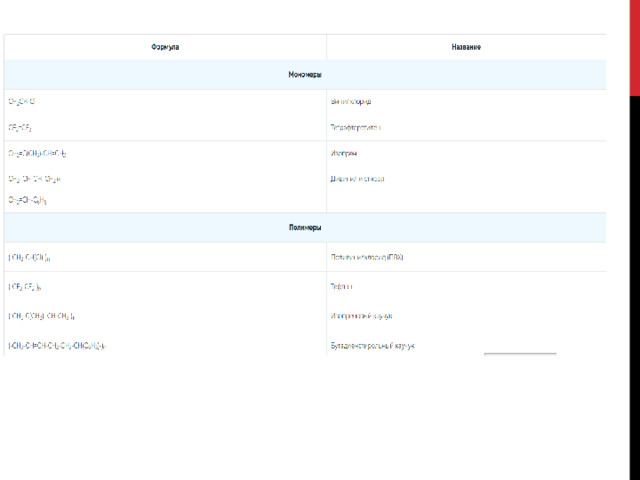

Реакции поликонденсации
Реакции поликонденсации заключаются в образовании полимера из мономеров, а также выделении побочного низкомолекулярного вещества. В этих уравнениях исходные реактивы - молекулы мономера с функциональными группами.
I. Гомополиконденсация
К данным реакциям относят получение полимера из одного мономера с выделением конденсата. Например, получение полисахарида из глюкозы – этот процесс происходит в природе.
n C6H12O6 → (-C6H10O5-)n + n H2O
Синтетическое волокно получают в промышленности из аминоэнантовой кислоты под воздействием температуры, давления и катализатора в виде молекулярного азота.
n NH2-(CH2)6-COOH → (-NH-(CH2)6-CO)n + n H2O
II. Сополиконденсация
К данным реакциям относят получение полимера из нескольких мономеров с выделением конденсата. Например, получение фенолформальдегидной смолы из фенола и формальдегида в щелочной или подкисленной среде.
n C6H5-OH + n H-CHO → (-C6H4(OH)-CH2-)n + n H2O
С помощью реакций сополиконденсации в промышленности получают полиэфиры, полиамины, полиакрил и т.д.

Характеристика полимеров
Полимеры – это соединения, которые имеют особые свойства и множество классификаций.
Классификация полимеров
Полимеры
По способу получения высокомолекулярные вещества делятся на:
- природные (целлюлоза, крахмал, белки);
- искусственные (эфиры целлюлозы);
- синтетические (капрон, полиэтилен, тефлон).
Также по форме макромолекул:
- линейные (волокна, полиэтилен низкого давления);
- разветвленные (крахмал, полиэтилен высокого давления);
- пространственные (резина, кварц).
А еще по свойствам и применению:
- пластмассы;
- каучуки;
- волокна.
Все полимеры активно используются в отраслях жизнедеятельности человека.

Пластмассы
Пластик (пластические массы) – полезные материалы, которые способны под воздействием температур или давления плавиться и при застывании оставлять заданную форму. Этот процесс сопровождается переходом из вязкотекучего в стеклообразное состояние. Главный компонент пластмассы – полимер, а остальные части – это наполнители, пластификаторы, красители и т.д.
Каучуки
Эластомеры – это высокомолекулярные соединения, которые обладают высокоэластичными свойствами. Каучуки используют для изготовления автомобильных шин, промышленных товаров и медицинских препаратов. Натуральный каучук получают из латекса (млечный сок каучуконосных растений). Получают по методу С.В. Лебедева с помощью полимеризации дивинила при действии металлического натрия.
n CH2=CH-CH=CH2 → (-CH2-CH(CH=CH2)-…-CH2-CH=CH-CH2-)n
Волокна
Волокна – это высокомолекулярные соединения, для которых характерна строгая упорядоченность молекул и используется в изготовлении нитей. Существует три типа волокон, которые разделяются еще на несколько подтипов.

- Искусственного происхождения. Животного происхождения. Минерального происхождения.
- Искусственного происхождения.
- Животного происхождения.
- Минерального происхождения.
- Искусственные. Ацетатное волокно. Вискозное волокно.
- Ацетатное волокно.
- Вискозное волокно.
- Синтетические. Полиамидное волокно. Полиэфирное волокно.
- Полиамидное волокно.
- Полиэфирное волокно.
Полимеры – это соединения, с помощью которых человечество способно изготавливать высокопрочные материалы и довольствоваться благами технологий.

Применение изученных неорганических и органических веществ
Применение неорганических веществ
Применение органических веществ
Применение неорганических веществ
К неорганическим относят соединения, которые не содержат углерод, а также углеродосодержащие вещества, традиционно относящиеся к неорганическим (карбиды, оксиды и др.).
Применение данных соединений достаточно распространено в повседневной деятельности человека, и без них невозможно полноценное ведение хозяйства, лечение, производство и т.п.
Пищевая сода
Гидрокарбонат натрия (NaHCO 3 ) – представляет собой мелкий порошок белого цвета, без запаха, растворимый в воде. Используется преимущественно в кулинарии, для выпечки. Это обусловлено тем, что во время нагревания сода легко разлагается с выделением углекислого газа.
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2 .
Кроме этого гидрокарбонат натрия используется для придания пышности омлету, смягчения мяса, усиления аромата чая или кофе, добавления сладости плодам фруктов, очищения продуктов от нитратов и т.д.
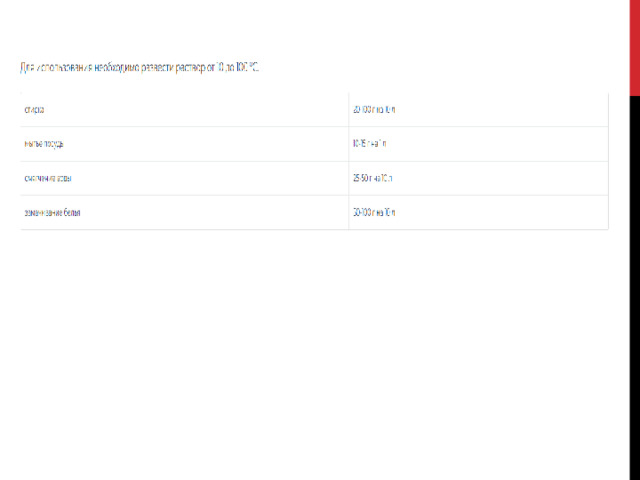
Кальцинированная сода
Na 2 CO 3 — применяется для бытовых нужд:
мытья посуды (из фаянса, фарфора, керамики в том числе);
чистки раковин, ванн, плитки;
стирки (замачивание, кипячение натуральных тканей);
смягчения жесткой воды;
удобрения кислых дерново-подзолистых почв.
Для использования необходимо развести раствор от 10 до 100 °С.

Соль
Поваренная соль (NaCl) – незаменимая приправа при приготовлении первых, вторых блюд, консервации и даже выпечки. Суточная норма натрия для организма человека составляет 1 г, но употребление значительно превышает эту норму (4-6 г). Осторожнее к потреблению данного продукта следует относиться людям, страдающим повышенным давлением, склонным к появлению отеков.
Серная кислота
Сильная двуосновная кислота (H 2 SO 4 ) представляет собой бесцветную тяжелую маслянистую жидкость, не обладающую запахом. Широко распространено использование средства в различных отраслях промышленности:
сельском хозяйстве (производство минеральных удобрений);
химической (изготовление красителей, химволокна, взрывчатых веществ);
пищевой (пищевая добавка E513)$
металлообрабатывающей;
в промышленном органическом синтезе (реакции дегидратации, гидратации, сульфирования, алкилирования).
Так же соединения серы используется в качестве электролита в свинцовых аккумуляторах.

Оксид цинка
Цинковые белила (ZnO) – представляет собой белый порошок, меняющий цвет при нагревании. Применение продукта известно в медицине, химической промышленности в качестве наполнителя или пигмента:
при производстве красок и эмалей;
при изготовлении бумаги, резины, пластмассы, косметики и парфюмерии;
в составе мазей и присыпок.
Данное соединение обладает фотокаталитической активностью, что нашло свое применение при изготовлении самоочищающихся поверхностей, бактерицидных покрытий для помещений больниц и подобных учреждений.
Медный купорос
Сульфат меди II (CuSO4) – бесцветное кристаллическое соединение, растворимое в воде. При реакции с воздухом или водой образуется голубой пентагидрат.
Применяется вещество как основа для других соединений или в качестве индикатора влажности помещения. Медный купорос – эффективное средство в борьбе с вредителями, грибковыми заболеваниями. Но есть и безвредное применение - изготовление минеральных красок, меднение ванн, пищевые добавки (консервант).
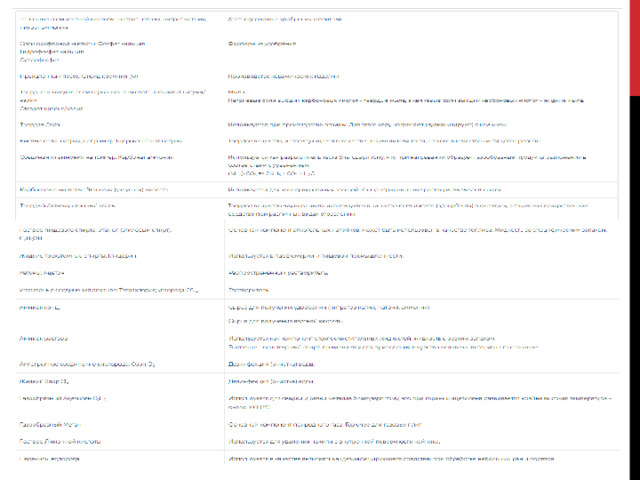
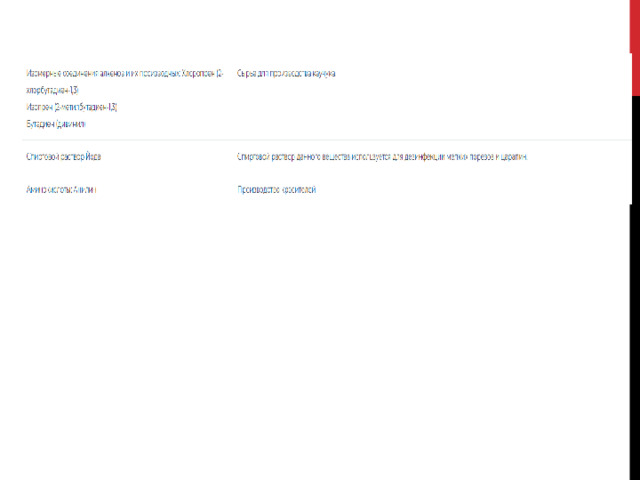

Применение органических веществ
Органические вещества – это класс химических соединений, объединяющий все вещества, в состав которых входит углерод.
Алканы
Предельные (насыщенные) углеводороды, атомами водорода: СН 4 – метан (основа природного газа), С 2 Н 6 – этан, С 3 Н 8 – пропан, С 8 Н 18 – октан (основа бензина).
Применяются в качестве топлива: бензин, дизельное, авиационное, пропан-бутановая смесь для бытовых плит.
Вазелин – незаменим в медицине, парфюмерии, косметологии.
Входят в состав смазочных масел.
Хладагент для холодильников.
Петролейный эфир и циклогексан используются в качестве растворителя.
Метан незаменимый компонент при производстве шин.
Широко распространено применение данной группы органических соединений в химической промышленности (для производства пластмасс, синтетических волокон и т.д.) и медицине.

Алкены
Соединения служат исходными веществами для получения ряда готовых продуктов:
растворителей (спиртов, дихлорэтана, эфира);
полимеров (полиэтилена, поливинилхлорида, полиизобутилена);
Этилен (Н 2 С=С Н 2 ) используется для получения, тефлона, этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Алкены применяются и для ускорения процесс созревания фруктов.
Алкины (ацетиленовые углеводороды)
Ацетилен – необходим в качестве исходного продукта в органическом синтезе при производстве:
полимеров (каучука, поливинилхлорида и др.);
растворителей (1,1,2,2-тетрахлорэтана , 1,1,2-трихлорэтена);
уксусной кислоты.
Температура пламени вещества достигает 3150°С, что нашло свое применение при резке металла и в сварке.

Спирты
Алкоголи – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу ОН.
Метанол (СН 3 ОН) –применяется в производстве муравьиной кислоты и формальдегида. Рассматривается как вариант для применения в качестве моторного топлива.
Этанол (С 2 Н 5 ОН)- востребован в виде исходного соединения для получения уксусной кислоты, сложных эфиров, карбоновых кислот. Вещество служит основой производства спиртосодержащей продукции и антисептических средств.
Этиленгликоль – компонент необходимый в производстве пластмасс, антифризов, органическом синтезе.
Глицерин – незаменим в разных отраслях промышленности, в том числе текстильной, пищевой, фармакологии.
Фенолы
Основное использование соединений приходится на химическую промышленность, медицину (производство синтетических смол, красителей, антисептиков, взрывчатых веществ и т.д.).
Альдегиды
Метаналь – используется при получении фенолформальдегидных и карбамидных смол, синтезе лекарственных средств, как дезинфицирующее средство.
Этаналь - нашел свое применение в органическом синтезе.
Карбоновые кислоты
Соединения, карбоксильной группы –СООН.
Муравьиная кислота (НСООН) –применяется в фармацевтической и пищевой промышленности. Уксусная кислота (СН 3 СООН) - востребована для производства искусственных волокон на основе целлюлозы и в пищевой промышленности.
Бензойная кислота (С 6 Н 5 СООН) – незаменима в фармацевтике для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов.
Сложные эфиры
Применяются в пищевой и парфюмерной отраслях в качестве отдушек. А также обеспечивают эластичность и пластичность пластмасс и резины.
Также широко распространено в пищевой промышленности, медицине применение глюкозы, аминов, аминокислот. Целлюлоза основной компонент при изготовлении бумаги, пленок, искусственных волокон и т.д.
Много соединений еще не изучено до конца, и возможно, благодаря науке человек сможет заменить натуральные продукты на искусственные, органических соединений природного происхождения применяется все меньше.

Задание для подготовки к егэ
Ответ: 4235.

Пояснение
Установим соответствие.
A) Аммиак широко используется как исходное азотсодержащее вещество в производстве удобрений (4).
Б) Одно из основных применений метана — в качестве топлива (2).
В) Изопрен — исходный мономер при получении каучука (3).
Г) Этилен может использоваться для различных целей, но из представленных вариантов наиболее подходящий — получение пластмасс (5).
Ответ: 4235.

Задание для подготовки к егэ
Ответ: 5412.

Пояснение
Установим соответствие.
А) Перегонка (фракционирование) сжиженного воздуха используется для получения легких газов (азот, кислород) (5).
Б) Прокаливание фосфатов кальция с углем и диоксидом кремния — получение белого фосфора (4).
В) Крекинг нефтепродуктов — получение бензина (1).
Г) Каталитическое окисление диоксида серы в триоксид — одна из стадий получения серной кислоты (2).
Ответ: 5412.

Домашняя работа
Вариант № 5511119
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5511119






































![Реакции полимеризации Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции: n X → (-X-) n Самой распространенной реакций полимеризации является реакция получения полиэтилена: nC 2 H 4 = (CH 2 – CH 2 ) n реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией. I. Гомополимеризация К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей: n CH 2 =CH-CH 3 → (CH 2 -CH(CH 3 )-) n II. Сополимеризация К этим реакциям относят получение сополимера этилена и пропилена: n CH 2 =CH 2 + n CH 2 =CH-CH 3 → [(-CH 2 -CH 2 -) x – (-CH 2 -CH(CH 3 )-) y ] n , где 1Полимеры, которые получают в результате реакций полимеризации](https://fsd.multiurok.ru/html/2022/07/17/s_62d3ba5b4efd3/img43.jpg)





























