
Егэ ПО химии задание 3

План
- Электроотрицательность химических элементов
- Степень окисления химических элементов и ее вычисление
- Валентность. Валентные возможности атомов

Электроотрицательность
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
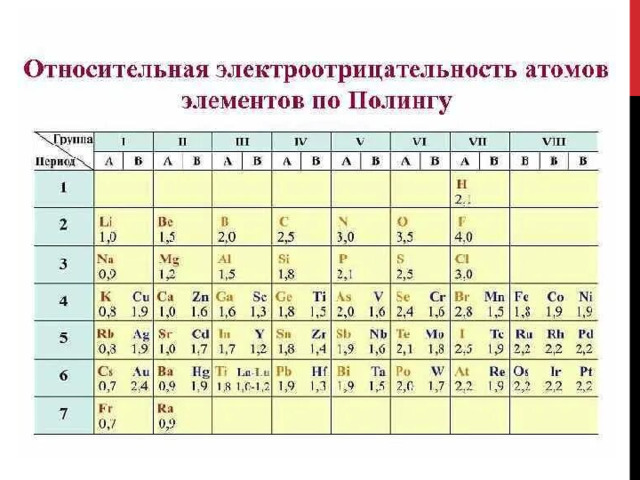

Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.

Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.

При определении СО следует руководствоваться следующими правилами :
Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
СО всех простых веществ соответствует нулю;
Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
Постоянную СО имеют фтор (-1), щелочные металлы (+1), щелочноземельные, а также бериллий, магний, цинк (+2), алюминий (+3). У кислорода СО равна -2, исключение пероксиды (+2). У водорода +1, исключение соединения с металлами (гидриды) -1.

Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру , определим степени окисления элементов в фосфорной кислоте H 3 PO 4 .
Найдем и проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х». — H +1 3 P X O -2 4
Используя эти значения составим и решим уравнение с одной неизвестной. (+1) * 3 + (x) * 1 + (-2) * 4 = 0 Следовательно, x=5 или +5. Таким образом, СО у фосфора +5.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Проставим известные СО элементов – алюминий и кислород, у азота примем СО за «x». Al +3 (N x O -2 3 ) 3
Составим и решим уравнение — (+3) * 1 + 3x + 9 * (-2) = 0. В итоге получаем x=+5, то есть СО у азота в соединении +5.

Валентность. Валентные возможности атомов
Валентность - это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Валентность обозначается римскими цифрами и указывается над химическим элементом справа вверху и не имеет знака (+ или -). Может быть постоянной или переменной.

Для определения валентности применяются определенные правила :
У металлов главных подгрупп валентность всегда постоянная и определяется по номеру группы.
У металлов побочных подгрупп и неметаллов валентность переменная. Высшая валентность = номеру группы, а низшая = 8 - номер группы.
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Количеством неспаренных электронов;
Наличием свободных орбиталей;
Наличием неподеленных пар электронов.

Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.

Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Атом С способен присоединять и отдавать электроны с образованием ковалентных связей. Валентные возможности углерода очень широкие, он может принимать значение степени окисления от +4 до -4.

Валентные возможности азота
У азота на валентном энергетическом уровне находится 5 электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.

Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.

Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.

Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.

Заключение
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.

Задания для подготовки к егэ
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –4. Запишите в поле ответа номера выбранных элементов.
Ответ: 35.
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную −2. Запишите в поле ответа номера выбранных элементов.
Ответ: 35.

Домашняя работа
Вариант № 5508749
Перейти по ссылке - https:// chem-ege.sdamgia.ru/test?id=5508749


































