
ЕГЭ ПО ХИМИИ ЗАДАНИЕ 6

План
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных

Химические свойства щелочных металлов: взаимодействие, получение
Щелочные металлы находятся в первой группе периодической таблицы. Атомы этих элементов содержат один электрон на внешнем энергетическом уровне. Он расположен на большом расстоянии от ядра. Как и все металлы являются восстановителями и легко отдают электрон. Характерна степень окисления равная +1. В группе сверху вниз наблюдается увеличение металлических свойств. За счет растущей энергии ионизации способность отдавать электроны, а следовательно, электроотрицательность возрастают снизу вверх.
Франций является самым активным металлом, так как у него электрон находится на самом далеком расстоянии от ядра. Соответственно, его способность к восстановлению самая высокая.

1. В нормальных условиях щелочные металлы взаимодействуют с кислородом. Они очень активны в таких реакциях, поэтому их хранят под слоем вазелинового масла. Продукты реакции могут быть оксидами или пероксидами.
2. Щелочные металлы вступают с водой в реакцию при нормальных условиях. Водород вытесняется из воды, и в качестве продукта реакции образуется растворимое основание – щелочь. Для распознавания щелочи можно использовать индикатор - фенолфталеин. При добавлении в раствор он окрашивается в малиновый цвет. Реакции с водой протекают очень бурно, литий «взрывается» в воде, натрий «кипит». При этом водород выделяется в виде белого пара клубами.

3. Вступают в реакции с галогенами, образуя галогениды.
4. Характерно взаимодействие с водородом при нагревании, продуктом реакции являются гидриды. Например, продуктом реакции калия и водорода будет гидрид калия.
5.С серой при нагревании образуют сульфиды. Это твердое, бесцветное вещество, растворимое в воде.
6. При нагревании происходит реакция с фосфором, фосфиды являются продуктом
7. Литий и натрий могут вступать в реакцию с углеродом при нагревании. В результате образуются карбиды. Остальные щелочные металлы в эти реакции не вступают.

8. С азотом при обычных условиях реагирует только литий, с остальными щелочными металлами реакция возможна только при нагревании.
9. Взаимодействуют со спиртами, образуя алкоголяты
Многие щелочные металлы способны взаимодействовать с разбавленными кислотами до образования водорода. Однако, реакция протекает стадийно, т.е. сначала металл реагирует с водой до образования щелочи, а затем происходит нейтрализация щелочи кислотой. Взаимодействие с кислотами сопровождается взрывом и поэтому такие реакции на практике не проводятся.

Получение
Основным методом получения щелочных металлов является электролиз галогенидных расплавов. При этом чаще всего используются хлориды, входящие в состав природных минералов.
Другими способами получения щелочных металлов могут быть получение из его оксидов и солей.Например, натрий можно получить путем кальцинирования соды с углем.
Na 2 CO 3 + 2C → 2Na + 3CO↑
Литий получают из его оксида при повышении температуры до 300°С.
2Li 2 O + Si + 2CaO → 4 Li + Ca 2 SiO 4

Химические свойства щелочноземельных металлов: взаимодействие, получение
Главную подгруппу второй группы периодической системы химических элементов образуют металлы, которые получили название щелочноземельных. Так названы они потому, что гидраты их окислов («земель»), подобно гидратам окислов щелочных металлов, являются щелочами.
Внешний электронный слой их атомов состоит из двух электронов. Отдавая их, атомы этих металлов превращаются в ионы, несущие две единицы положительного заряда. Во всех своих соединениях металлы подгруппы бериллия положительно двухвалентны. В периодической таблице они соседствуют с щелочными металлами. Поэтому эти элементы проявляют высокую химическую активность, уступая в ней только щелочным металлам. Свойства металла повышаются с увеличением порядкового номера.
1. Вступают в реакции с кислородом, продуктом реакции становятся оксиды, исключение барий, он образует пероксид BaO 2 . Бериллий и магний взаимодействуют с кислородом только при очень высоких t, так как покрыты тонкой защитной оксидной пленкой.
2Ca + O 2 → 2CaO
В приведенной выше реакции кусочек кальция сгорает с образованием белого дыма при нагревании. Он образован тончайшими твердыми частицами оксида кальция.
2. Подобно щелочным металлам взаимодействуют с водой, но менее активно. В результате образуется гидрат оксида и вытесняется водород. Ca + 2H 2 O → 2Ca(OH) 2 + H 2 ↑
Фенолфталеин окрашивается в полученном растворе в малиновый цвет. Этот пример оправдывает ожидаемое сходство в химических свойствах щелочноземельных и щелочных металлов: оба взаимодействуют с водой с выделением водорода. Гидраты оксидов щелочноземельных металлов, как и щелочи, являются щелочами, то есть они растворимы в воде.
3. Все металлы, кроме бериллия, вступают в реакцию с галогенами. Бериллий взаимодействует с галогенами только при повышенных температурах. Продуктом реакции являются галогениды.
Ca + Cl 2 → CaCl 2 4. При нагревании с водородом реагируют все щелочноземельные металлы, кроме бериллия. В результате образуются гидриды.
Ca + H 2 → CaH 2

5. Реагируют с серой, в результате чего образуются сульфиды.
Ca + S → CaS 6. Взаимодействуют с азотом при нагревании, за исключением магния. Он реагирует с азотом в нормальных условиях. Продуктом реакции являются нитриды.
3Be + N 2 → Be 3 N 2 3Mg + N 2 → Mg 3 N 2 7. Могут вступать в реакции с кислотами, в результате образуют соли соответствующей кислоты и водород.
Be + H 2 SO 4 (разб.) → BeSO 4 + H 2 ↑

Получение
Основными способами получения металлов второй группы главной подгруппы являются электролиз расплавов, алюминотермия и вытеснение из их солей другими более активными металлами.
CaO + Al → Al 2 O 3 + Ca
MgBr 2 + Ca → CaBr 2 + Mg

Химические свойства алюминия
Алюминий находится в третьей группе периодической системы элементов. Заряд ядра атома алюминия +13, на внешнем электронном слое три электрона.
По строению атомов и положению в периодической системе можно предположить, что у элементов третьей группы металлические свойства должны быть выражены слабее, чем у элементов второй группы. Это действительно так.
При химических реакциях атом алюминия отдает три электрона внешнего слоя, обращаясь в трех зарядный положительный ион Al 3+ . Поэтому во всех его устойчивых соединениях алюминий положительно трехвалентен. Его соединения проявляют амфотерные свойства.

Алюминий – химически активный металл и проявляет себя как восстановитель. Однако его активность снижает оксидная пленка, которая образуется на его поверхности. Поэтому во многих реакциях пленка сначала удаляется, а затем осуществляется взаимодействие с веществами. Рассмотрим на конкретных примерах химические свойства алюминия.
1. Алюминий соединяется с кислородом воздуха и при нагревании и при обыкновенной температуре. На его поверхности быстро образуется тончайшая плотная пленка окиси алюминия. Она трудно проницаема для газов и защищает металл от дальнейшего окисления.В раздробленном состоянии и при повышенной температуре алюминий бурно реагирует с кислородом с выделением большого количества тепла. В результате образуется окись алюминия.
2. Со многими неметаллами реакции происходят при нагревании.
![3. С водой взаимодействует при удалении оксидной пленки. Реакция протекает энергично, вытесняя водород из воды. 2Al + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 4. Взаимодействие с кислотами. Опустим алюминиевые стружки в пробирку с соляной или разбавленной серной кислотой. Алюминий растворяется, вытесняя из кислоты водород и образуя соль. 2Al + 6HCl → 2AlCl 3 + 3H 2 ↑ 2Al +3H 2 SO4 (разб.) → Al 2 (SO 4 ) 3 + 3H 2 ↑ С концентрированной азотной и серной кислотой не реагирует. Поэтому концентрированная азотная кислота хранится в алюминиевых емкостях и транспортируется в алюминиевых резервуарах. С разбавленной азотной кислотой вступает в реакцию с образованием N 2 O, N 2 или NH 4 NO 3 . 8Al + 30HNO 3 → 8Al(NO 3 ) 3 + 3N 2 O + 15H 2 O 5. Поскольку алюминий обладает амфотерными свойствами, он характеризуется реакциями со щелочами. 2Al + 2NaOH + 10H 2 O → 2Na[Al(H 2 O) 2 (OH) 4 ] + 3H 2 ↑ 6. Алюминий взаимодействует с окислами большинства металлов, вытесняя менее активный металл. Этот метод используется в промышленности для получения металлов и называется алюминотермией. 2Al + Fe 2 O 3 → 2Fe + Al 2 O 3](https://fsd.multiurok.ru/html/2022/07/14/s_62d015050625f/img13.jpg)
3. С водой взаимодействует при удалении оксидной пленки. Реакция протекает энергично, вытесняя водород из воды.
2Al + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2
4. Взаимодействие с кислотами. Опустим алюминиевые стружки в пробирку с соляной или разбавленной серной кислотой. Алюминий растворяется, вытесняя из кислоты водород и образуя соль.
2Al + 6HCl → 2AlCl 3 + 3H 2 ↑ 2Al +3H 2 SO4 (разб.) → Al 2 (SO 4 ) 3 + 3H 2 ↑
С концентрированной азотной и серной кислотой не реагирует. Поэтому концентрированная азотная кислота хранится в алюминиевых емкостях и транспортируется в алюминиевых резервуарах.
С разбавленной азотной кислотой вступает в реакцию с образованием N 2 O, N 2 или NH 4 NO 3 .
8Al + 30HNO 3 → 8Al(NO 3 ) 3 + 3N 2 O + 15H 2 O
5. Поскольку алюминий обладает амфотерными свойствами, он характеризуется реакциями со щелочами.
2Al + 2NaOH + 10H 2 O → 2Na[Al(H 2 O) 2 (OH) 4 ] + 3H 2 ↑ 6. Алюминий взаимодействует с окислами большинства металлов, вытесняя менее активный металл. Этот метод используется в промышленности для получения металлов и называется алюминотермией.
2Al + Fe 2 O 3 → 2Fe + Al 2 O 3

Химические свойства переходных металлов (меди, цинка, хрома, железа)
Переходные элементы – металлы, расположены в побочных подгруппах периодической системы химических элементов. Так как у них происходит заполнение d-уровней в последнюю очередь, то их относят к d-элементам. Если последним заполняется f-уровень, то это f-элементы. Соответственно, химические свойства обусловлены таким строением атома.

1. Взаимодействие с кислородом
- В кислороде железо сгорает, разбрасывая искры – раскаленные капли железной окалины, а при накаливании на воздухе окисляется с поверхности, образуя окалину в виде корки. Во всех случаях образуется железная окалина.
- В кислороде железо сгорает, разбрасывая искры – раскаленные капли железной окалины, а при накаливании на воздухе окисляется с поверхности, образуя окалину в виде корки. Во всех случаях образуется железная окалина.
3Fe + 2O 2 → Fe 3 O 4
- Медь, цинк и хром вступают в реакцию с кислородом только при нагревании 2Zn + O 2 → 2ZnO 4Cr + 3O 2 → 2Cr 2 O 3
- Медь, цинк и хром вступают в реакцию с кислородом только при нагревании 2Zn + O 2 → 2ZnO 4Cr + 3O 2 → 2Cr 2 O 3

2. Взаимодействие с неметаллами.
- Железо способно реагировать с азотом, фосфором, углеродом и серой. Энергично реагирует при нагревании с серой, образуя сернистое железо
- Железо способно реагировать с азотом, фосфором, углеродом и серой. Энергично реагирует при нагревании с серой, образуя сернистое железо
Fe + S → FeS
- Медь не реагирует с водородом, азотом, углеродом и кремнием. Характерны реакции с серой при нагревании. При нагревании цинк взаимодействует с серой и фосфором. С водородом, азотом, бором, кремнием, углеродом цинк в реакции не вступает.
- Медь не реагирует с водородом, азотом, углеродом и кремнием. Характерны реакции с серой при нагревании.
- При нагревании цинк взаимодействует с серой и фосфором. С водородом, азотом, бором, кремнием, углеродом цинк в реакции не вступает.
Zn + S → ZnS
- Хром взаимодействует с азотом, серой, бором, углеродом и кремнием при повышенных температурах.
- Хром взаимодействует с азотом, серой, бором, углеродом и кремнием при повышенных температурах.
2Cr + 3C → Cr 2 C 3

3. Взаимодействие с галогенами
- Железный порошок, предварительно нагретый и внесенный в колбу с хлором, сгорает, образуя бурый дым – хлорное железо.
- Железный порошок, предварительно нагретый и внесенный в колбу с хлором, сгорает, образуя бурый дым – хлорное железо.
3Cl 2 + 2Fe → 3FeCl 2
- Медь и хром с галогенами вступает в реакции при нагревании.Cu + Br2 → CuBr 2 2Cr + 3Cl 2 → 2CrCl 3 Цинк вступает в реакции с галогенами при нормальных условиях, в качестве катализатора необходимы пары воды.Zn + Cl 2 → ZnCl 2
- Медь и хром с галогенами вступает в реакции при нагревании.Cu + Br2 → CuBr 2 2Cr + 3Cl 2 → 2CrCl 3
- Цинк вступает в реакции с галогенами при нормальных условиях, в качестве катализатора необходимы пары воды.Zn + Cl 2 → ZnCl 2

4. При нагревании характерно взаимодействие с водой железа, цинка, хрома. Медь неактивный металл, поэтому с водой не реагирует .
3Fe + 4H 2 O → Fe 3 O 4 + H 2 ↑
При обычных условиях железо реагирует с парами воды и кислородом. Происходит процесс ржавления и образуется желто-бурая ржавчина – гидрат окиси железа.
3Fe + 6H 2 O + 3O 2 → 4Fe(OH) 3 ↓

5. Железо, цинк и хром способны вытеснять из водных растворов солей медь и другие металлы, расположенные правее в ряду активности.
Fe + CuSO 4 → Cu + FeSO 4

Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния

Химические свойства неметаллов
Прежде чем перейти к химическим свойствам неметаллов, вспомним их характерные особенности.
В периодической таблице химических элементов неметаллы располагаются в конце периодов. Внешний электронный слой в их атомах является неполным, но близким к завершению. Поэтому атомы неметаллов легко присоединяют электроны, превращаясь в отрицательно заряженные ионы. Это происходит при соединении неметаллов с элементами, атомы которых, наоборот, легко отдают электроны, а такими элементами являются металлы и водород. Поэтому для них типичны реакции соединения с металлами и водородом.

Самым электроотрицательным элементом является фтор. Он не способен отдавать электроны из –за высокой электроотрицательности. Фтор проявляет только окислительные свойства и принимает электроны от других элементов. Другие элементы могут проявлять как восстановительные, так и окислительные свойства. Восстановительные свойства элементы –неметаллы проявляют гораздо слабее, чем металлы. Наиболее сильные окислительные свойства проявляют: фтор, кислород, хлор. Восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк. Промежуточные свойства проявляют азот, сера, йод.

Данные элементы способны образовывать множество типов химических связей с различными химическими элементами – ковалентные, ионные, водородные. Неметаллы, как простые вещества, имеют молекулярное или атомное строение. В нормальных условиях чаще всего это либо газы, либо твердые вещества.

Характерные химические свойства оксидов: основных, амфотерных, кислотных
Классификация оксидов
Химические свойства оксидов

Почти все химические элементы образуют оксиды. Лишь инертные газы не могут образовывать данные соединения.
Оксиды – это сложные вещества, в состав которых входят 2 элемента, одним из которых является кислород . Таким образом, можно представить общую формулу данных соединений:
Э m O n , где
Э – химический элемент;
m, n – индексы.
Номенклатура оксидов
Номенклатура этих веществ складывается из слова «оксид», названия химического элемента и валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название оксида = «Оксид» + название х.э. + валентность (в скобках)
Например:
СO — оксид углерода (IV)
Fe 2 O 3 — оксид железа (III)

Классификация оксидов
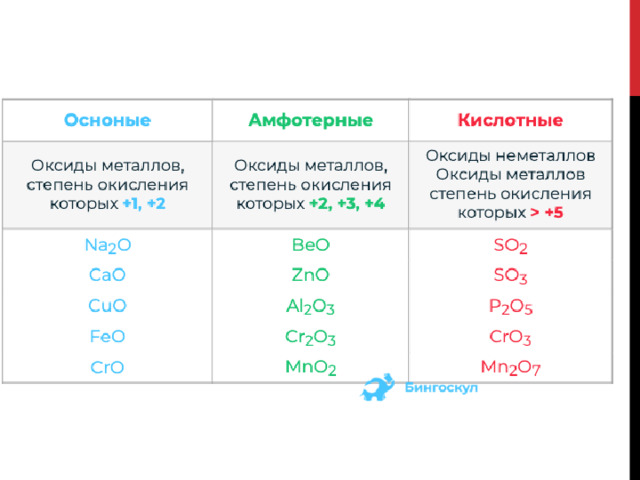
Все оксиды подразделяются на две большие группы:
Оксиды, которые при взаимодействии с кислотами и основаниями не образуют солей относят к несолеобразующим (CO, SiO, N 2 O, NO). В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность. Солеобразующие оксиды – это оксиды, которые при взаимодействии с кислотами, либо с основаниями, образуют соли. Эти оксиды являются производными от соответствующих оснований и кислот, в которых элемент находится в высшей валентности.
Все солеобразующие оксиды разделяются на три типа:

Солеобразующие оксиды
К основным оксидам относят оксиды, гидраты которых являются основаниями. Образуются металлами, валентность которых меньше IV. Например :
- Na2O → NaOH CaO → Ca(OH)2 FeO → Fe(OH)2 В состав данных соединений входят металлы с I и II, исключение цинк, бериллий, свинец, олово.
- Na2O → NaOH
- CaO → Ca(OH)2
- FeO → Fe(OH)2 В состав данных соединений входят металлы с I и II, исключение цинк, бериллий, свинец, олово.
К кислотным оксидам относят оксиды, гидраты которых являются кислотами. Образованы неметаллами и металлами побочных подгрупп с валентностью V, VI, VII. Например:
- CO2 → H2CO3 SO3 → H2SO4 P2O5 → H3PO4
- CO2 → H2CO3
- SO3 → H2SO4
- P2O5 → H3PO4
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды. Образованы металлами с валентностью III и IV. Например:
- ZnO → Zn(OH)2 Al2O3 → Al(OH)3
- ZnO → Zn(OH)2
- Al2O3 → Al(OH)3

Химические свойства оксидов
Все три группы оксидов обладают разными химическими свойствами. Амфотерные оксиды занимают промежуточное положение между основными и кислотными, поэтому для них характерны и кислотные, и щелочные химические свойства.

Задания для подготовки к егэ
В пробирку с раствором соли Х добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
Ответ: 42.

Домашняя работа
Вариант № 5508888
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5508888

















![3. С водой взаимодействует при удалении оксидной пленки. Реакция протекает энергично, вытесняя водород из воды. 2Al + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 4. Взаимодействие с кислотами. Опустим алюминиевые стружки в пробирку с соляной или разбавленной серной кислотой. Алюминий растворяется, вытесняя из кислоты водород и образуя соль. 2Al + 6HCl → 2AlCl 3 + 3H 2 ↑ 2Al +3H 2 SO4 (разб.) → Al 2 (SO 4 ) 3 + 3H 2 ↑ С концентрированной азотной и серной кислотой не реагирует. Поэтому концентрированная азотная кислота хранится в алюминиевых емкостях и транспортируется в алюминиевых резервуарах. С разбавленной азотной кислотой вступает в реакцию с образованием N 2 O, N 2 или NH 4 NO 3 . 8Al + 30HNO 3 → 8Al(NO 3 ) 3 + 3N 2 O + 15H 2 O 5. Поскольку алюминий обладает амфотерными свойствами, он характеризуется реакциями со щелочами. 2Al + 2NaOH + 10H 2 O → 2Na[Al(H 2 O) 2 (OH) 4 ] + 3H 2 ↑ 6. Алюминий взаимодействует с окислами большинства металлов, вытесняя менее активный металл. Этот метод используется в промышленности для получения металлов и называется алюминотермией. 2Al + Fe 2 O 3 → 2Fe + Al 2 O 3](https://fsd.multiurok.ru/html/2022/07/14/s_62d015050625f/img13.jpg)





























