
ЕГЭ по химии З адание 7

План
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных
- Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Реакции ионного обмена

Характерные химические свойства оснований и амфотерных гидроксидов
- Номенклатура оснований
- Классификация оснований
- Химические свойства щелочей (Щ)
- Химические свойства нерастворимых оснований
- Химические свойства амфотерных гидроксидов

Первое знакомство с основаниями состоялось при изучении взаимодействия воды с активными металлами и с оксидами активных металлов. В состав оснований входит одновалентная группа атомов OH (гидроксогруппа). Следовательно, основаниям можно дать следующее определение:
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одной или нескольким группами атомов OH.
Общая формула оснований выглядит следующим образом: Ме (ОН) x , где Ме – металл; x – индекс.
Номенклатура оснований
Название оснований включает в себя слово «гидроксид», названия металла и его валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название основания = «Гидрооксид» + название Me + валентность (в скобках)

Классификация оснований
Все основания можно классифицировать по различным признакам. Рассмотрим это в нижеприведенной таблице.
Из таблицы мы видим, что наблюдается большое различие по некоторым признакам. В зависимости от этого, различные группы оснований, обладают не схожими химическими свойствами.

Химические свойства щелочей (Щ)
1. Водные растворы Щ изменяют окраску индикаторов, тем самым можно определить реакцию среды
2. Реакция нейтрализации заключается во взаимодействии основания и кислоты, ход которой можно проследить по изменению окраски индикаторов. Данная реакция характерна и для щелочей, и для нерастворимых оснований.
NaOH + HCl → NaCl + H 2 O

3. Для Щ характерны реакции с солями, в результате образуется другая соль и основание.
2NaOH + CuSO 4 = Cu(OH) 2 ↓ + Na 2 SO 4 4. Могут вступать в реакции с кислотными оксидами, при этом образуется нерастворимая соль и вода.
Ca(OH) 2 + CO 2 = CuCO 3 ↓ + H 2 O 5. В отличии от нерастворимых оснований, не разлагаются при нагревании.

Химические свойства нерастворимых оснований
Так же как и щелочи, могут изменять окраску индикаторов. Характерна реакция нейтрализации.
Fe(OH) 2 + H 2 SO 4 → FeSO 4 + 2H 2 O
При нагревании разлагаются с образованием основного оксида и воды

Химические свойства амфотерных гидроксидов
К амфотерным гидроксидам относятся сложные вещества, способные проявлять свойства кислот либо оснований при определенных условиях.
Формулы данных соединений можно представить в виде оснований и в виде кислот.
ZnO — Zn(OH) 2 ↔ H 2 ZnO 2
Al 2 O 3 — Al(OH) 2 ↔ H 3 AlO 3
1. В нейтральной среде не растворяются и не диссоциируют на ионы. Способны разлагаться в кислотах и щелочах.
2. При взаимодействии с кислотами образуется соль и вода.
Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O
![3. В результате реакции со щелочами образуются те же соединения, что и в предыдущей реакции. Zn(OH) 2 + 2NaOH =Na 2 [Zn(OH) 4 ] комплексная соль 4. Способны взаимодействовать с основными оксидами 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O 5. Так же как и щелочи взаимодействуют с солями. 2Al(OH) 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2 + 3H 2 O](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img9.jpg)
3. В результате реакции со щелочами образуются те же соединения, что и в предыдущей реакции.
Zn(OH) 2 + 2NaOH =Na 2 [Zn(OH) 4 ] комплексная соль 4. Способны взаимодействовать с основными оксидами
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O 5. Так же как и щелочи взаимодействуют с солями.
2Al(OH) 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2 + 3H 2 O

Характерные химические свойства кислот
- Общая характеристика
- Классификация:
- Физические свойства
- Химические свойства

Общая характеристика
Кислоты – это химические соединения, содержащие в себе положительный атом водорода (катион H+) и кислотный остаток (анион A-). Является сложным веществом.
В первую очередь кислоты различают по растворимости. Есть нерастворимые, растворимые и полурастворимые кислоты. Эти различия прописаны в таблице растворимости, так что наизусть запоминать не требуется.

Классификация:
Кислоты различают по составу на кислородсодержащие и бескислородные. Примеры кислот приведены ниже в таблице.
Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная.
Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память. Кислоты различают по количеству атомов водорода на одноосновные (один атом водорода), двухосновные (два атома водорода), трёхосновные (три атома водорода).

Кислоты разделяют на сильные и слабые. К сильным относят галогенводородные и высшие кислородсодержащие кислоты, они растворимы. К слабым относят неустойчивые и нерастворимые в воде кислоты. Чтобы определить силу кислоты, существует правило: из числа атомов кислорода вычесть число атомов водорода, если получаемое число 2 или 3 – кислота сильная, если 1 или 0 – кислота слабая.

Физические свойства
Кислоты, в зависимости от условий, могут быть в трёх агрегатных состояниях: в жидком, твёрдом и газообразном состоянии. Кислоты могут обладать цветом и запахом.

Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
Взаимодействие кислот с металлами
Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
Mg + 2HCl → MgCl 2 + H 2 ↑
Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.

Взаимодействие кислот с основными и амфотерными оксидами
При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H 2 O.
В качестве примера приведены следующие реакции:
K 2 O + 2HNO 3 → 2KNO 3 + H 2 O Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.

Реакции, в результате которых при нагревании или обычных условиях выделяется газ.NaCl( тв. ) + H 2 SO 4 ( конц. ) → Na 2 SO 4 + 2HCl↑ FeS + 2HCl → FeCl 2 + H 2 S↑
Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород. Реакции, в результате которых образуется слабый электролит. Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд:
В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности.

Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.

Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
H 2 CO 3 → H 2 O + CO 2 ↑

Характерные химические свойства солей
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
- Классификация солей
- Химические свойства солей

Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Соли – это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металлов.
Общим способом получения солей является взаимодействие оснований с кислотами:
NaOH + HCl = NaCl + H 2 O (так же эту реакцию называют реакцией нейтрализации, т.к. соли не имеют среды – она нейтральна)
Общая формула солей: Me x (Ac) y , где
Me – металл,
x и y – индексы,
Ac – кислотный остаток.

Классификация солей
(III) Приставка «ди» используется, если в молекуле основной соли с одним атомом Me связаны с гидроксильными группами.
1. Средние (нормальные) соли – это продукты полного замещения атомов водорода на металл.
Название средней соли = название Ac + название Me + валентность Me
NaCl – хлорид натрия
Fe(NO3)2 - нитрат железа (II)
2. Кислые соли – это продукты неполного замещения атомов водорода на Me.
Название кислой соли = «Гидро» или «Дигидро» + название Ac + название Me + валентность Me
NaHCO3 – гидрокарбонат натрия
KH2PO4 – дигидрофосфат калия
![3. Основные соли – это соли, которые кроме ионов Me и Ac содержат гидроксогруппы. Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me CaOHCl – гидроксохлорид кальция Ca(OH) 2 SO 4 – гидроксосульфат кальция Fe(OH) 2 NO 3 – дигидроксонитрат железа CaOHCl – гидроксохлорид кальция Ca(OH) 2 SO 4 – гидроксосульфат кальция Fe(OH) 2 NO 3 – дигидроксонитрат железа 4. Комплексные соли – соли, содержащие комплексный ион. [Ag(NH 3 ) 2 ]Сl – хлорид диаммин серебра (I) [Cu(NH 3 ) 4 ]SO 4 – сульфат тетрааммин меди (II) K 4 [Fe(CN) 6 ] – гексацианоферрат (II) калия [Ag(NH 3 ) 2 ]Сl – хлорид диаммин серебра (I) [Cu(NH 3 ) 4 ]SO 4 – сульфат тетрааммин меди (II) K 4 [Fe(CN) 6 ] – гексацианоферрат (II) калия](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img23.jpg)
3. Основные соли – это соли, которые кроме ионов Me и Ac содержат гидроксогруппы. Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me
- CaOHCl – гидроксохлорид кальция Ca(OH) 2 SO 4 – гидроксосульфат кальция Fe(OH) 2 NO 3 – дигидроксонитрат железа
- CaOHCl – гидроксохлорид кальция
- Ca(OH) 2 SO 4 – гидроксосульфат кальция
- Fe(OH) 2 NO 3 – дигидроксонитрат железа
4. Комплексные соли – соли, содержащие комплексный ион.
- [Ag(NH 3 ) 2 ]Сl – хлорид диаммин серебра (I) [Cu(NH 3 ) 4 ]SO 4 – сульфат тетрааммин меди (II) K 4 [Fe(CN) 6 ] – гексацианоферрат (II) калия
- [Ag(NH 3 ) 2 ]Сl – хлорид диаммин серебра (I)
- [Cu(NH 3 ) 4 ]SO 4 – сульфат тетрааммин меди (II)
- K 4 [Fe(CN) 6 ] – гексацианоферрат (II) калия

Химические свойства солей
I. Средние соли
1. Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и анионы Ac.К примеру, хлорид калия в водном растворе распадается на катионы калия и анионы хлора.
KCl ↔ K — + Cl —
2. Соли могут взаимодействовать с металлами, при этом каждый Me, стоящий левее в ряду напряжений Me, способен вытеснять Me, стоящие правее, из их солей.Щелочные и щелочноземельные металлы с солями реагировать не будут, так как вступают в реакцию с водой.
Например, при взаимодействии сульфата меди с железом, происходит замещение меди железом, так как железо более активный металл, чем медь и находится в электрохимическом ряду напряжений левее водорода.
CuSO4 + Fe → FeSO4 + Cu↓
При взаимодействии сульфида железа с цинком происходит тот же процесс, но в данной реакции более активным металлом является цинк. Цинк вытесняет железо из соединения, в результате происходит образование чистого железа.
FeS + Zn → ZnS + Fe↓

3. Реакция растворов солей с растворами щелочей возможна в том случае, когда образующиеся основание или соль выпадают в осадок. Взаимодействие хлорида железа (III) с раствором гидроксида калия является качественной реакцией на ионы Fe 3+ . Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами.
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
4. При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой кислоты или нерастворимой соли. В представленной ниже реакции осуществляется взаимодействие между хлоридом бария и серной кислотой. Продуктами реакции являются нерастворимая соль и сильная кислота. Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl

5. Для солей характерно взаимодействие между собой. В этом случае одним из продуктов реакции должна быть нерастворимая соль.Взаимодействие нитрата серебра с хлоридом калия сопровождается выпадением осадка белого цвета – хлорида серебра. Эта реакция является качественной на хлорид-ионы.
AgNO3 + KCl → AgCl↓ + KNO3
6. При нагревании разлагаются соли слабых кислот, соли аммония, а также образованные сильными окислителями или восстановителями.
- Все карбонаты при термическом разложении распадаются на основный оксид и углекислый газ.
- Все карбонаты при термическом разложении распадаются на основный оксид и углекислый газ.
- При разложении нитратов следует учитывать следующие условия:

- Если металл находится в ряду напряжений левее магния, то в результате реакции образуется нитрит и кислород. Реакция протекает по следующей схеме:
Если металл находится в ряду напряжений левее магния , то в результате реакции образуется нитрит и кислород.
- Если металл расположен в электрохимическом ряду напряжений между магнием и медью, при этом будет происходить образование оксида металла, диоксида азота и кислорода.
Металлы , стоящие в электрохимическом ряду напряжений после водорода не взаимодействуют с растворами кислот.

II. Кислые соли
1. Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и сложный анион Ac. Диссоциация протекает в две стадии. Первая стадия всегда необратима, по второй стадии протекает обратимая диссоциация.
KHSO 4 → K — + HSO 4 — HSO 4 — ↔ H + + SO 4 2—
2. Кислые соли могут взаимодействовать с металлами, стоящими левее водорода. Не стоит в таких реакциях использовать щелочные металлы, так как они прежде всего реагируют с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, при таких условиях может произойти взрыв.В результате данной реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.
2KHSO 4 + Mg → H 2 ↑ + MgSO 4 + K 2 SO 4

3. При взаимодействии кислой соли с раствором щелочи образуется средняя соль и вода. Гидрокарбонат натрия способен вступать в реакцию с раствором щелочи, продуктами реакции будут сульфит натрия и вода.
NaHCO 3 + NaOH → Na 2 SO 3 + H 2 O 4. При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой или летучей кислоты. Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия.
2KHS + H 2 SO 4 → K 2 SO 4 + 2H 2 S
5. Для кислых солей характерно взаимодействие со средними солями. Однако, при такой реакции должны образоваться вода, газ или осадок. В противном случае взаимодействие происходить не будет. Очень хорошо это просматривается на примере взаимодействия гидросульфата калия и хлорида бария. Продуктами реакции будут сульфат бария – осадок белого цвета, сульфат калия и хлороводородная кислота.
2KHSO 4 + BaSO 4 ↓ + K 2 SO 4 + 2HCl

6. При нагревании некоторые соли разлагаются. Ярким примером может служить разложение гидрокарбонатов. В результате реакции образуется вода, углекислый газ и карбонат натрия.
СаСO 3 =СаO + СО 2
Реакции разложения гидрокарбонатов кальция и магния являются причиной образования накипи в водонагревательных приборах.

III. Основные соли
1. Способны в водных растворах разлагаться на сложные катионы и анионы Ac. Диссоциация проходит в несколько ступеней, причем по первой ступени разложение проходит необратимо. Все последующие ступени протекают обратимо.
Al(OH) 2 CH 3 COO → Al(OH) 2 + + CH 3 COO — Al(OH) 2+ ↔ AlOH 2+ + OH — Al(OH) 2+ ↔ Al 3+ + OH —
2. Основные соли могут взаимодействовать с растворами щелочей с образованием нерастворимого основания и кислой соли. Гидроксонитрат железа (III) и раствор едкого калия при взаимодействии друг с другом образуют нитрат калия и гидрокисд железа (II) – осадок белого цвета.
Fe(OH)NO 3 + KOH → Fe(OH) 2 ↓ + KNO 3
![3. При взаимодействии основной соли с кислотой, образуется средняя соль и вода. Взаимодействие гидроксохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды. CuOHCl + HCl → CuCl 2 + H 2 O 4. Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди (II) образуется оксид меди (II), углекислый газ и вода. [Cu(OH)]2CO3 = 2CuO + CO2 + H2O](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img32.jpg)
3. При взаимодействии основной соли с кислотой, образуется средняя соль и вода. Взаимодействие гидроксохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды.
CuOHCl + HCl → CuCl 2 + H 2 O 4. Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди (II) образуется оксид меди (II), углекислый газ и вода.
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
![IV. Комплексные соли 1. Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация).K 4 [Fe(CN) 6 ] → 4K + + [Fe(CN) 6 ] 4— Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это - вторичная диссоциация комплексных ионов. [Fe(CN) 6 ] 3— ⟷ [Fe(CN) 5 ] 2— + CN — [Fe(CN) 5 ] 2— ⟷ [Fe(CN) 4 ] — + CN — [Fe(CN) 4 ] — ⟷ [Fe(CN) 3 ] + CN — [Fe(CN) 3 ] ⟷ [Fe(CN) 2 ] + + CN — [Fe(CN) 2 ] + ⟷ [Fe(CN) 2 ] 2+ + CN — [Fe(CN)] 2+ ⟷ Fe 3+ + CN — Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения: [Fe(CN) 6 ] 3— ⟷ Fe 3+ + 6CN —](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img33.jpg)
IV. Комплексные соли
1. Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация).K 4 [Fe(CN) 6 ] → 4K + + [Fe(CN) 6 ] 4—
Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это - вторичная диссоциация комплексных ионов.
[Fe(CN) 6 ] 3— ⟷ [Fe(CN) 5 ] 2— + CN — [Fe(CN) 5 ] 2— ⟷ [Fe(CN) 4 ] — + CN — [Fe(CN) 4 ] — ⟷ [Fe(CN) 3 ] + CN — [Fe(CN) 3 ] ⟷ [Fe(CN) 2 ] + + CN — [Fe(CN) 2 ] + ⟷ [Fe(CN) 2 ] 2+ + CN — [Fe(CN)] 2+ ⟷ Fe 3+ + CN —
Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения:
[Fe(CN) 6 ] 3— ⟷ Fe 3+ + 6CN —
![2. Комплексные соли способны вступать в реакции обмена со средними солями. В результате такой реакции образуется две другие соли – комплексная и средняя. FeCl 3 + K 4 [Fe(CN) 6 ] = Fe 4 [Fe(CN) 6 ]↓ + 3KCl Данная реакция является качественной реакции на ионы Fe 3+ . Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия. 3. При нагревании комплексных солей происходит их разложение.Тетрагидроксоалюминат натрия распадается на алюминат натрия и воду. Na[Al(OH) 4 ] → NaAlO 2 + 2H 2 O 4. При взаимодействии комплексной соли со средней, происходит разрушение комплексов за счёт образования малорастворимых соединений.2[Cu(NH 3 ) 2 ]Cl + K 2 S → CuS↓ + 2KCl + 4NH 3 ↑](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img34.jpg)
2. Комплексные соли способны вступать в реакции обмена со средними солями. В результате такой реакции образуется две другие соли – комплексная и средняя.
FeCl 3 + K 4 [Fe(CN) 6 ] = Fe 4 [Fe(CN) 6 ]↓ + 3KCl
Данная реакция является качественной реакции на ионы Fe 3+ . Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия. 3. При нагревании комплексных солей происходит их разложение.Тетрагидроксоалюминат натрия распадается на алюминат натрия и воду.
Na[Al(OH) 4 ] → NaAlO 2 + 2H 2 O
4. При взаимодействии комплексной соли со средней, происходит разрушение комплексов за счёт образования малорастворимых соединений.2[Cu(NH 3 ) 2 ]Cl + K 2 S → CuS↓ + 2KCl + 4NH 3 ↑

Электролитическая диссоциация (ЭД) электролитов в водных растворах. Сильные и слабые электролиты
Понятие об электролитах и неэлектролитах
Процессы диссоциации и ассоциации в электролитах по теории Аррениуса, степень диссоциации
Механизм ЭД
Классификация и некоторые особенности диссоциации электролитных растворов
Константа электролитической диссоциации
Реакции ионного обмена
Значение электролитов

Понятие об электролитах и неэлектролитах
Ещё в начале XIX в. М. Фарадей обнаружил, что одни растворы веществ пропускают электрический ток, другие – нет.
Если в металлах электрический ток возникает за счёт направленного движения электронов, то в растворах, а также в расплавах электрический заряд переносится ионами.
Соединениям, которые распадаются в растворах на ионы и проводят электрический ток, химики дали название электролиты .
Физики же их называют проводниками 2-го рода.
Растворённые вещества, неспособные пропускать электричество, называются неэлектролитами . В растворах они существуют в виде электронейтральных молекул. Большинство органических соединений – неэлектролиты.

Процессы диссоциации и ассоциации в электролитах по теории Аррениуса, степень диссоциации
Распад электролита на ионы называется электролитической диссоциацией (ЭД) или ионизацией.
В 1887 г. шведским химиком С.Аррениусом были сформулированы основные принципы этого явления:
- Под действием воды (растворителя) происходит разложение электролита на ионы.
- Электроток заставляет ионы с плюсовым зарядом (катионы) двигаться к катоду (–), ионы с минусовым зарядом (анионы) – к плюсовому электроду (аноду).
- Одновременно с диссоциацией происходит встречный процесс – ассоциация ионов в молекулы.
- Полноту разложения электролита на заряженные частицы, по-другому сказать, силу электролита определяет степень диссоциации (обозначается α ). Она равна отношению количества продиссоциировавших молекул электролита (N д ) к общему их количеству в растворе (N), т.е. по формуле: α = (N д / N)·100%

На эту характеристику влияют:
- природа электролитов и участвующих в ЭД растворителей – с увеличением полярности связей в их молекулах α растет;
- температура – α находится в прямой пропорции от неё;
- концентрация – в более разбавленных растворах α выше.
Эти основные положения теории электролитической диссоциации (ТЭД) в 1891 г. были дополнены русским химиком И. Каблуковым понятием сольватации (гидратации) катионов и анионов. Он, используя теорию Д.Менделеева о растворах, доказал, что между растворителем и растворяемым веществом формируются химические связи.

Механизм ЭД
Когда химические соединения растворяются в воде молекулы H 2 O , будучи биполярными, начинают ориентироваться вокруг ионов растворяемого вещества: полюс (+) молекулы воды притягивается к отрицательному иону соединения и наоборот.
Межмолекулярные связи этого реагента ослабевают, оно разрушается, ионы перемещаются в раствор. Там ионы связываются с молекулами H 2 O и становятся гидратированными. Это наглядно видно на примере ионизации NaCl.
Схема электролитической диссоциации хлорида натрия на гидратированные ионы

Классификация и некоторые особенности диссоциации электролитных растворов
С учетом степени ЭД электролиты классифицируют по 3 группам
- сильные
- средней силы
- слабые

Химический характер полученных в ходе ЭД подразделяет электролиты на 3 класса: кислоты, основания, соли.
1. Для кислот свойственно распадаться на катион H + и анион кислотного остатка.H 2 SO 4 = H + + HSO 4 - HSO 4 - ⇆ H + + SO 4 2-
Примечание.
а) Для многоосновных кислот отрыв иона H + происходит ступенчато, причём самая высокая степень ионизации достигается на первой стадии
б) Именно из-за присутствия ионов H + кислоты обладают кислым вкусом и происходит соответствующие окрашивание индикаторов.
2. Основания в ходе ЭД образуют анионы гидроксида (OH - ) и катион металла.NaOH = Na + + OH -
Аналогично кислотам многокислотные основания отщепляют гидроксид-ионы ступенчато:
Zn(OH) 2 = ZnOH + + OH - ZnOH + ⇆ Zn 2+ + OH -
3. Соли в ходе диссоциации распадаются на кислотные остатки (анионы) и катионы металлов.При этом возможны несколько вариантов этого процесса:
- С образованием нормальных (средних) солей. Происходит полное замещение всех атомов водорода в кислоте на атомы металла.K 3 PO 4 ⇆ 3K + + PO 4 3- С образованием кислых солей. За счёт ступенчатой диссоциации в составе соли находится ещё несколько или один атом водорода.NaHCO 3 ⇆ Na + + HCO 3 - HCO 3 - ⇆ H + + CO 3 2- С образованием основных солей . В этом случае они распадаются, образуя катионы металла, анионы кислотного остатка и гидроксид-ионы. Mg(OH)Cl ⇆ Mg(OH) + + Cl - Mg(OH) + ⇆ Mg 2+ + OH -
- С образованием нормальных (средних) солей. Происходит полное замещение всех атомов водорода в кислоте на атомы металла.K 3 PO 4 ⇆ 3K + + PO 4 3-
- С образованием кислых солей. За счёт ступенчатой диссоциации в составе соли находится ещё несколько или один атом водорода.NaHCO 3 ⇆ Na + + HCO 3 - HCO 3 - ⇆ H + + CO 3 2-
- С образованием основных солей . В этом случае они распадаются, образуя катионы металла, анионы кислотного остатка и гидроксид-ионы. Mg(OH)Cl ⇆ Mg(OH) + + Cl - Mg(OH) + ⇆ Mg 2+ + OH -
Диссоциация также может вести к образованию двойных и смешанных солей .

Константа электролитической диссоциации
Наиболее общей характеристикой электролитов (прежде всего слабых) является константа диссоциации Кд.
В слабых электролитах из-за неполной их ионизации возникает равновесие между нераспавшимися молекулами и ионами. Одновременно идут процессы диссоциации и ассоциации (молекуляризации). К д по сравнению со степенью диссоциации ( α ) более объективно характеризует способность электролита к ионизации.
С увеличением К д растёт количество ионов, а значит сильнее становится электролит. Для слабых электролитов при данной температуре константа диссоциации постоянная величина, для сильных – переменная, зависимая от концентрации раствора.
К д и α связаны формулой: К д = (α 2 ·c) / (1 – α), где c – молярная концентрация раствора.

Реакции ионного обмена
Согласно ТЭД взаимодействия в электролитных растворах есть реакции между ионами и получили название реакций ионного обмена (РИО). А уравнения, которые их описывают, - ионные уравнения.
РИО между сильными электролитами необратимы. Их продукты выходят из реакции или в виде нерастворимого осадка, или газообразными, или малодиссоциирующими электролитами. Такое условие необратимости ионообменных реакций сформулировано в 1803 г. французским химиком Бертолле.
Реакции в электролитах письменно оформляются в 3 видах: сначала в молекулярной форме, затем в полной ионной и сокращенной ионной.

Значение электролитов
Без них невозможно существование живых организмов, в том числе человека. Все биохимические и физиологические процессы проходят при их непосредственном участии: транспортировка кислорода в крови, регулирование водно-солевого баланса, работа кишечника и сердца.
В технике электролиты участвуют в таких процессах как электролиз, электрокатализ, защита металлов от коррозии. В энергетике создаются новые топливные элементы, солнечные батареи, электрохимические преобразователи информации.

Реакции ионного обмена
Что есть реакция ионного обмена? Определение
Необходимое условие РИО. Правило Бертолле
Особенности РИО. Суть необратимого процесса
Правила (алгоритм) составления уравнений ионно-обменных реакций
Примеры РИО с выделением газа и выпадением осадка
Применение РИО

Что есть реакция ионного обмена? Определение
Химическое взаимодействие ионов в электролитах называется реакцией ионного обмена (РИО).
Сущность РИО заключается в связывании ионов.
Напоминание. Электролиты – это водные растворы кислот, солей или оснований, в которых эти вещества распадаются (диссоциируют) на свободные заряженные ионы.

Необходимое условие РИО. Правило Бертолле
Главное условие необратимого протекания ионнообменной реакции между электролитами – образование осадка, газообразного вещества или малодиссоциирующего соединения (слабого электролита, в т.ч. воды).
Данное утверждение носит название правила Бертолле . Этот французский химик сформулировал его в 1803 г.
Следует помнить , что это правило справедливо при взаимодействии ненасыщенных растворов.

Особенности РИО. Суть необратимого процесса
1. В ходе ионообменной реакции не происходит перехода электронов и соответственно изменения степени окисления реагирующих частиц. 2. Ионообменный процесс может быть и обратимым, то есть реакция будет протекать в двух направлениях. Это происходит в случае, когда одно из исходных веществ - слабый электролит. 3. В соответствии с правилом Бертолле, например, азотная кислота реагирует с гидроокисью натрия. В результате образуются сильный электролит азотнокислого натрия и малодиссоциирующий электролит – вода.
HNO 3 + NaOH = NaNO 3 + H 2 O (1)
HNO 3, NaOH, NaNO 3 - будучи сильными электролитами в растворе находятся в виде ионов. А вода, H 2 O как слабый электролит фактически не распадается на ионы.

Более реально состояние реагентов в растворе демонстрирует запись в виде заряженных ионов:
H+ + NO3- + Na+ + OH- = Na+ + NO3- + H2O (2)
В уравнении (2) видно, что ионы NO3- и Na+ находятся в растворе и до и после реакции, т.е. в ней не участвуют. После сокращения в обеих частях уравнения одинаковых ионов получается короткая запись:
H+ + OH- = H2O (3)
Эти уравнения получили названия:
(3) - сокращенное ионное уравнение,
(2) – полное ионное уравнение,
(1) – молекулярное уравнение реакции.
Вывод: уравнение в ионной форме отражает сущность процесса, показывает за счёт чего возможно его протекание.
Знать: в обратимых РИО не бывает сокращенной ионной формы уравнения.

Правила (алгоритм) составления уравнений ионно-обменных реакций
В обычных химических уравнениях разложение молекул на ионы не учитывается. Чтобы отразить сущность взаимодействия электролитических растворов, пользуются ионными уравнениями, которые составляются по определённым правилам.
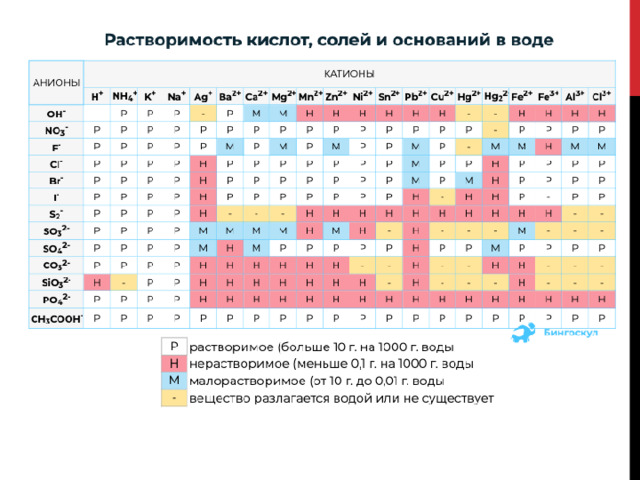
- Для составления уравнения РИО следует проверить растворимость реагентов по таблице растворимости веществ.
- Записать затем уравнение реакции в молекулярной форме и расставить коэффициенты. Не забывать , что в молекулах продуктов реакции сумма зарядов равняется нулю.

3. После этого оформить РИО в виде полного ионного уравнения с учётом результатов распада на ионы, как исходных, так и полученных веществ. Формулы растворимых соединений записать в виде ионов (в таблице растворимости они обозначены буквой «Р»). Молекулярные формулы применить для написания нерастворимых веществ. Иметь в виду: малорастворимые соединения («М») в левой части следует записывать в ионной форме, в правой – в молекулярной (считать их нерастворимыми). Для подсчёта суммарного коэффициента реакции произвести сложение всех коэффициентов в обеих частях уравнения.
4. Записать краткую форму ионного уравнения, сократив одинаковые ионы в левой и правой части. Коэффициенты сделать минимальными, суммы зарядов и слева, и справа должны быть одинаковыми. Аналогично п.3 сделать подсчёт суммарного коэффициента реакции.
Примеры РИО с выделением газа и выпадением осадка
1. Пример ионнообменной реакции с выделением углекислого газа и воды (реагенты соль и кислота):
- Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2 ↑ + H 2 O - уравнение в молекулярной форме; 2Na + + CO 3 2- + 2H + + SO 4 2- = 2Na + + SO 4 2- + CO 2 ↑ + H 2 O – уравнение в полной ионно-молекулярной форме; CO 3 2- + 2H + = CO 2 ↑ + H 2 O – уравнение в сокращённой ионно-молекулярной форме.
- Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2 ↑ + H 2 O - уравнение в молекулярной форме;
- 2Na + + CO 3 2- + 2H + + SO 4 2- = 2Na + + SO 4 2- + CO 2 ↑ + H 2 O – уравнение в полной ионно-молекулярной форме;
- CO 3 2- + 2H + = CO 2 ↑ + H 2 O – уравнение в сокращённой ионно-молекулярной форме.
2. Пример ионообменной реакции с образованием нерастворимого сернокислого свинца:
- Pb(NO 3 ) 2 + K 2 SO 4 = PbSO 4 + 2KNO 3 – уравнение в молекулярной форме; Pb 2+ + 2NO 3 - + 2K + + SO 4 2- = PbSO 4 ↓ + 2K + + 2NO 3 - - уравнение в полной ионно-молекулярной форме; Pb 2+ + SO 4 2- = PbSO 4 ↓ – уравнение в сокращённой ионно-молекулярной форме.
- Pb(NO 3 ) 2 + K 2 SO 4 = PbSO 4 + 2KNO 3 – уравнение в молекулярной форме;
- Pb 2+ + 2NO 3 - + 2K + + SO 4 2- = PbSO 4 ↓ + 2K + + 2NO 3 - - уравнение в полной ионно-молекулярной форме;
- Pb 2+ + SO 4 2- = PbSO 4 ↓ – уравнение в сокращённой ионно-молекулярной форме.

Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
Для обессоливания (деминерализации) воды с помощью катионитных и анионитных колонок. Катиониты поглощают ионы Ca 2+ , Mg 2+ , заменяя их на ионы H + . На анионите группа OH - заменяется анионами Cl - . В итоге получается почти дистиллированная вода. Для опреснения воды в космических кораблях и морских судах. Для обеспечения ионного обмена в почвах , что помогает улучшению их агротехнических свойств. Для извлечения ценных примесей (уран, золото, серебро). Для удаления ионов тяжелых металлов при очистке промышленных сточных вод.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
Например:
1.CuS + Fe(NO 3 ) 2 ≠ FeS + Cu(NO 3 ) 2
- реакция не идет, потому что FeS – нерастворим, а так же нерастворимой солью является соль – реагент сульфид меди - (CuS).
- реакция не идет, потому что FeS – нерастворим, а так же нерастворимой солью является соль – реагент сульфид меди - (CuS).
2.Na 2 CO 3 + CaCl 2 = CaCO 3 ↓+ 2NaCl
- реакция протекает, так как карбонат кальция нерастворим и соли – реагенты являются растворимыми.
- реакция протекает, так как карбонат кальция нерастворим и соли – реагенты являются растворимыми.
3. Cu(OH) 2 + Na 2 S – не протекает,
- Чтобы соль с основанием реагировали, необходима растворимость их обоих. Cu(OH) 2 - нерастворим, хотя потенциальный продукт CuS был бы осадком. В одной системе 2-х осадков не бывает.
- Чтобы соль с основанием реагировали, необходима растворимость их обоих.
- Cu(OH) 2 - нерастворим, хотя потенциальный продукт CuS был бы осадком. В одной системе 2-х осадков не бывает.
4. 2NaOH + Cu(NO 3 ) 2 = Cu(OH) 2 ↓+ 2NaNO 3
- реакция протекает, так оба исходных вещества растворимы и дают осадок Cu(OH) 2 : Это требование не распространяется на растворимость исходных веществ дальше реакций соль1+ соль2 и соль + основание. Все растворимые кислоты реагируют со всеми карбонатами, в том числе нерастворимыми.
- реакция протекает, так оба исходных вещества растворимы и дают осадок Cu(OH) 2 :
- Это требование не распространяется на растворимость исходных веществ дальше реакций соль1+ соль2 и соль + основание.
- Все растворимые кислоты реагируют со всеми карбонатами, в том числе нерастворимыми.

Вывод:
Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть садок или гидроксид аммония.

Задания для подготовки к егэ
Установите соответствие между простым веществом и реагентами, с каждым из которых оно может реагировать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Ответ: 3534.

Домашняя работа
Вариант № 5509028
Ссылка - https :// chem-ege.sdamgia.ru/test?id=5509028














![3. В результате реакции со щелочами образуются те же соединения, что и в предыдущей реакции. Zn(OH) 2 + 2NaOH =Na 2 [Zn(OH) 4 ] комплексная соль 4. Способны взаимодействовать с основными оксидами 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O 5. Так же как и щелочи взаимодействуют с солями. 2Al(OH) 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2 + 3H 2 O](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img9.jpg)













![3. Основные соли – это соли, которые кроме ионов Me и Ac содержат гидроксогруппы. Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me CaOHCl – гидроксохлорид кальция Ca(OH) 2 SO 4 – гидроксосульфат кальция Fe(OH) 2 NO 3 – дигидроксонитрат железа CaOHCl – гидроксохлорид кальция Ca(OH) 2 SO 4 – гидроксосульфат кальция Fe(OH) 2 NO 3 – дигидроксонитрат железа 4. Комплексные соли – соли, содержащие комплексный ион. [Ag(NH 3 ) 2 ]Сl – хлорид диаммин серебра (I) [Cu(NH 3 ) 4 ]SO 4 – сульфат тетрааммин меди (II) K 4 [Fe(CN) 6 ] – гексацианоферрат (II) калия [Ag(NH 3 ) 2 ]Сl – хлорид диаммин серебра (I) [Cu(NH 3 ) 4 ]SO 4 – сульфат тетрааммин меди (II) K 4 [Fe(CN) 6 ] – гексацианоферрат (II) калия](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img23.jpg)








![3. При взаимодействии основной соли с кислотой, образуется средняя соль и вода. Взаимодействие гидроксохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды. CuOHCl + HCl → CuCl 2 + H 2 O 4. Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди (II) образуется оксид меди (II), углекислый газ и вода. [Cu(OH)]2CO3 = 2CuO + CO2 + H2O](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img32.jpg)
![IV. Комплексные соли 1. Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация).K 4 [Fe(CN) 6 ] → 4K + + [Fe(CN) 6 ] 4— Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это - вторичная диссоциация комплексных ионов. [Fe(CN) 6 ] 3— ⟷ [Fe(CN) 5 ] 2— + CN — [Fe(CN) 5 ] 2— ⟷ [Fe(CN) 4 ] — + CN — [Fe(CN) 4 ] — ⟷ [Fe(CN) 3 ] + CN — [Fe(CN) 3 ] ⟷ [Fe(CN) 2 ] + + CN — [Fe(CN) 2 ] + ⟷ [Fe(CN) 2 ] 2+ + CN — [Fe(CN)] 2+ ⟷ Fe 3+ + CN — Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения: [Fe(CN) 6 ] 3— ⟷ Fe 3+ + 6CN —](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img33.jpg)
![2. Комплексные соли способны вступать в реакции обмена со средними солями. В результате такой реакции образуется две другие соли – комплексная и средняя. FeCl 3 + K 4 [Fe(CN) 6 ] = Fe 4 [Fe(CN) 6 ]↓ + 3KCl Данная реакция является качественной реакции на ионы Fe 3+ . Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия. 3. При нагревании комплексных солей происходит их разложение.Тетрагидроксоалюминат натрия распадается на алюминат натрия и воду. Na[Al(OH) 4 ] → NaAlO 2 + 2H 2 O 4. При взаимодействии комплексной соли со средней, происходит разрушение комплексов за счёт образования малорастворимых соединений.2[Cu(NH 3 ) 2 ]Cl + K 2 S → CuS↓ + 2KCl + 4NH 3 ↑](https://fsd.multiurok.ru/html/2022/07/14/s_62d01534477b3/img34.jpg)
































