
ЕГЭ ПО ХИМИИ ЗАДАНИЕ 9

пЛАН
Взаимосвязь различных классов неорганических веществ

Как уже известно, существует четыре класса неорганических соединений. К ним относятся оксиды, основания, кислоты и соли. При подробном изучении способов получения каждого класса соединений можно проследить определенную взаимосвязь между всеми классами. Например, из кислот можно получить соли, из оксидов основания и так далее. Такая связь называется генетической .
Следовательно, генетическая связь – это связь между классами неорганических соединений, которая основана на получении веществ одного класса из веществ другого класса, а также их химических свойств.
На основании данной связи составляют генетические ряды , которые включают в себя представителей разных классов, но состоящие из одного элемента.
Генетическую связь можно представить в виде схемы.
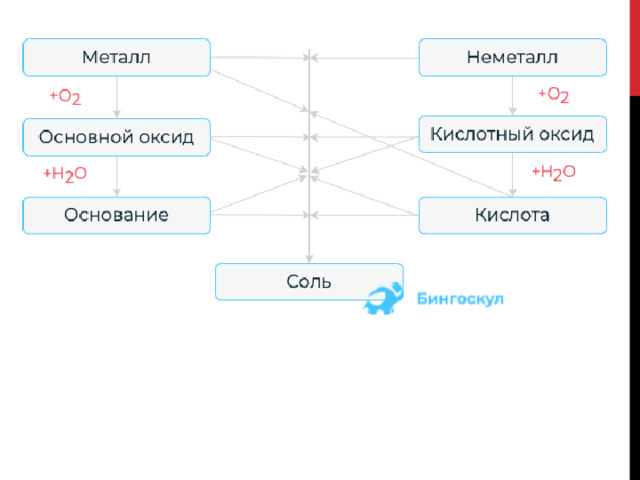

Из данной схемы видно, что существует определенная взаимосвязь между классами. Основополагающими элементами генетического ряда являются либо металл, либо неметалл.
- Для получения оксида необходимо осуществить взаимодействие металла либо неметалла с кислородом.
- При взаимодействии с водой из основного оксида можно получить основание, а из кислотного – кислоту.
- Соль образуется при различных реакциях между всеми классами неорганических соединений. Например, металл + неметалл, основный оксид + кислотный оксид, основание + кислота и так далее.
Можно выделить два типа генетических рядов, которые мы и рассмотрим.

1. Генетический ряд металла
Металл → Основный оксид → Основание → Соль
Ряд кальция: Ca → CaO → Ca(OH) 2 → Ca Cl 2 ;
Ряд натрия: Na → Na 2 O → NaOH → Na 3 PO 4 ;
Ряд магния: Mg → MgO → Mg(OH) 2 → Mg(NO 3 ) 2 ;
Ряд железа: Fe → FeO → Fe(OH) 2 → FeSO4.
Рассмотрим взаимосвязь в данных рядах на примере магния.
Для получения оксида магния из чистого металла, осуществим реакцию взаимодействия с кислородом.
Mg + O 2 → MgO
При взаимодействии основного оксида с водой, в частности оксида магния, получим основание – гидроксид магния.
MgO + H2O → Mg(OH) 2
Для получения соли из нерастворимого основания, необходимо добавить кислоту.
Mg(OH) 2 + HNO 3 → Mg(NO 3 ) 2 + H 2 O

2. Генетический ряд неметалла
Неметалл → Кислотный оксид → Кислота → Соль
Ряд фосфора: P → P 2 O 5 →H 3 PO 4 → Na 3 PO 4 ;
Ряд углерода: C → CO 2 → H 2 CO 3 → CaCO 3 ;
Ряд серы: S → SO 2 → H 2 SO 3 → MgSO 3 ;
Ряд кремния: Si → SiO 2 → H 2 SiO 3 → K 2 SiO 3 .
Рассмотрим взаимосвязь в данных рядах на примере углерода.
Для получения оксида углерода осуществим реакцию взаимодействия с кислородом – горение. Протекает с выделением энергии.
C + O 2 → CO 2
При взаимодействии кислотного оксида с водой, в частности оксида углерода, получим угольную кислоту.
CO + H 2 O → H 2 CO 3
Для получения соли из кислоты, необходимо добавить основание.
Ca(OH) 2 + H 2 CO 3 → CaCO 3 ↓ + 2H 2 O

Важно!!!
Для составления генетических цепочек необходимо знать химические свойства каждого класса неорганических соединений, а также валентные возможности того элемента, который лежит в основе генетического ряда.

Задания для подготовки к егэ
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
Ответ: 43.

Пояснение
Вещества X и Y — различны. При этом Y — гидрокарбонат натрия, значит, из оставшихся веществ гидроксид натрия в карбонат натрия можно перевести только по реакции с углекислым газом.

Задания для подготовки к егэ
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
Ответ: 23.

пояснение
В первой реакции происходит окисление железа. Окислить железо могут азотная кислота, кислород и серная кислота. Но кислоты превратят железо не в оксид, а в соль. Поэтому веществом является кислород.
Во второй реакции происходит восстановление железа из степени окисления +3 до степени окисления +2. Единственным восстановителем из представленных веществ является водород. Вещество У — это водород.

Домашняя работа
Вариант № 5509109
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5509109




























