
Занятие №12
Электрохимическое производство хлорной кислоты и перхлоратов

Применение хлорной кислоты и перхлоратов
Хлорная кислота HClO 4 – наиболее сильная и стабильная из всех кислородсодержащих кислот хлора. Используется в аналитической практике, гальваностегии, фотографии; как растворитель органических веществ и катализатор. Соли хлорной кислоты (NaClO 4 , KClO 4 , NH 4 ClO 4 ) используются в пиротехнике, фотографии; как компоненты при изготовлении ракетного топлива.

Электрохимическое получение перхлоратов возможно двумя способами: электролизом хлоратов и электролизом NaCl.
1. Электролиз хлоратов (электролит не должен содержать Cl – ).
А:
ClO 3 - +H 2 O–2 e→ ClO 4 - +2H + (1)
К:
2H + + 2 e → Н 2 (2)
Суммарная реакция:
ClO 3 - + H 2 O → ClO 4 - + H 2 (3)

В процессе электролиза заметного изменения pH не происходит.
Наиболее вероятным механизмом является механизм с участием кислорода, генерируемого на поверхности анода:
Mе + H 2 O – e → MеOH + H + (4)
MеOH – e → MеO + H + (5)
MеO + ClO 3 - → Mе + ClO 4 - (6)
Например, для платинового анода:
Pt * PtO + ClO 3 - – e → Pt * PtO(ClO 3 ) адс (7)
Pt * PtO(ClO 3 ) адс + H 2 O – e → Pt * PtO + ClO 4 - + 2H + (8) Возможно также образование радикалов ·ClO 3 , которые затем превращаются в ионы ClO 4 - .

Побочный анодный процесс – выделение кислорода – усиливается при малой концентрации ClO 3 - в растворе. В присутствии Cl – выход потоку ClO 4 - уменьшается, т. к. идет процесс выделения хлора. Ионы Cl – могут образовываться на катоде вследствие восстановления ClO 3 - на катоде, которое предотвращают введением 2–5 г/л K 2 Cr 2 O 7 (нельзя для PbO 2 -анодов).

Рис. 1. Зависимость выхода по току от материала анода:
1 – PbO 2 на титановой основе; 2 – Pt; 3 – ПТА
Условия электролиза
Используются малоизнашиваемые аноды:
Pt, ПТА, PbO 2 на титановой основе, которые определяют выход по току и потенциал анода (рис. 1).
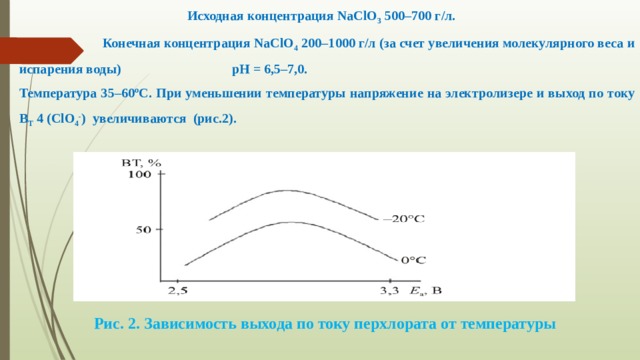
Исходная концентрация NaClO 3 500–700 г/л.
Конечная концентрация NaClO 4 200–1000 г/л (за счет увеличения молекулярного веса и испарения воды) рН = 6,5–7,0.
Температура 35–60ºC. При уменьшении температуры напряжение на электролизере и выход по току В Т 4 (ClO 4 - ) увеличиваются (рис.2).
Рис. 2. Зависимость выхода по току перхлората от температуры

Для платинового анода плотность тока составляет
7 кА/м 2 , катодная плотность тока i к = 1–2 кА/м 2 .
Начальный B T (NaClO 4 ) = 95%,
в конце электролиза B T (NaClO 4 ) = 40% (конечная концентрация NaClO 3 составляет 50 г/л).
Средний B T (NaClO 4 ) = 85%.

- При электросинтезе NaClO 4 из NaCl происходит последовательное окисление:
Cl - → ClO - → ClO 3 - → ClO 4 -
Материал катода – Ni, нержавеющая сталь, графит.

Получение хлорной кислоты
Хлорную кислоту получают химическим и электрохимическими способами.
- Химический способ основан на действии
HCl конц на твердый NaClO 4 :
NaClO 4 +HCl→HClO 4 + NaCl (9)

2. Электрохимические способы :
– анодное окисление Cl 2 в HClO 4 :
1/2Cl 2 + 4H 2 O–7 e → ClO 4 - + 8H + (10)
Это многостадийная реакция, последнюю стадию на платиновом аноде можно описать уравнением (8).

Условия электролиза:
аноды: Pt или ПТА;
высокие анодные потенциалы: 2,8–3,0 В;
электролит: 40%-ный раствор HClO 4 ;
выход по току зависит от температуры: при –20ºС составляет 80–85%;

B T (HClO 4 ) зависит от температуры, концентрации HCl, плотности тока.
При i a ≈ 4 кА/м 2 B T (HClO 4 ) = 40–50%.
Используют аноды с высоким перенапряжением выделения кислорода (Pt, ПТА).
Оптимальная концентрация НCl составляет 0,1 моль/л. При увеличении концентрации НCl начинает выделяться Cl 2 , при средних концентрациях образуется HClO 3 .
Для обеспечения высокого перенапряжения выделения хлора и кислорода необходима низкая температура (–25ºС).






























