Просмотр содержимого документа
«Элементы химической термодинамики»

Наманганский Государственный Университет
Элементы химической термодинамики

Термодинамика
Изучение законов обмена энергией между системой и окружающей средой
Система
Обмен энергией
Изолированная
Обмен веществом
Невозможен
Закрытая
Возможен
Невозможен
Открытая
Невозможен
Возможен
Возможен
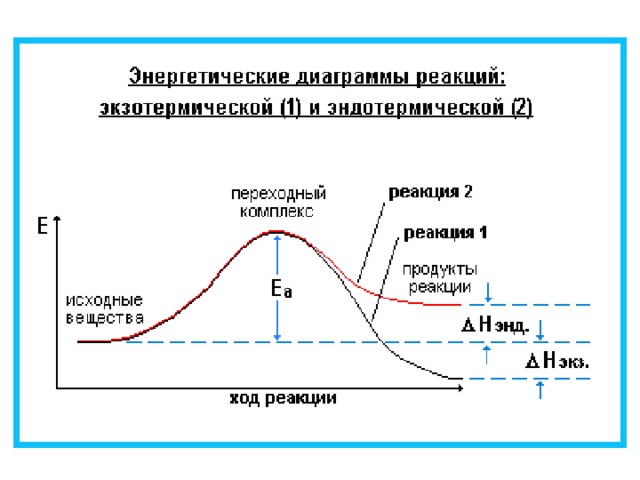
 0 Эндо термическая реакция " width="640"
0 Эндо термическая реакция " width="640"
Тепловой эффект
Тепловой эффект Q или H (энтальпия)
- количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
Q = H
Экзо термическая реакция
H
H0
Эндо термическая реакция

Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ.
СH 4 (г) + 2 O 2 (г) = СO 2 (г) + 2 H 2 О(ж) + 890 кДж
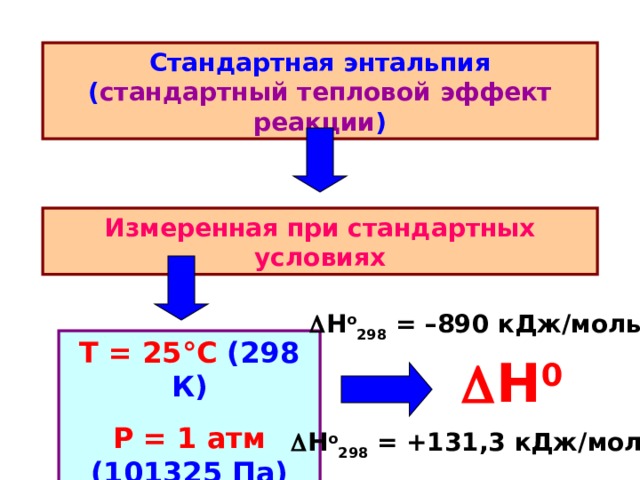
Стандартная энтальпия ( стандартный тепловой эффект реакции )
Измеренная при стандартных условиях
Н о 298 = –890 кДж / моль
Т = 25 ° С (298 К)
Р = 1 атм (101325 Па)
H 0
Н о 298 = +131,3 кДж / моль

Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ
Тепловой эффект реакции можно измерить при помощи калориметра
Q = mc(t 2 - t 1 )
Q = H

Основные законы термохимии
Закон Лавуазье - Лапласа
Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
2 H 2 (г) + O 2 (г) = 2 H 2 О(ж) + 572 кДж
(горение водорода в кислороде)
2 H 2 О(ж) + 572 кДж = 2 H 2 (г) + O 2 (г)
(разложение воды электрическим током)

Закон Гесса
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O + 131 кДж
а) NaOH + H 2 SO 4 = NaНSO 4 + H 2 O + 62 кДж
б) NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O + 69 кДж
6 2 кДж + 69 кДж = 131 кДж

Теплота любой реакции может быть вычислена как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в реакции .
Теплота образования простых веществ равна нулю.
Fe 2 O 3 (тв) + 3 C(графит) = 2 Fe(тв) + 3 CO(г)
Fe 2 O 3 ( Н о 298 = –822,1 кДж / моль)
СО ( Н о 298 = – 110,5 кДж / моль).
Н о 298 = 3 (-110,5) - (-822,1) = -331,5 + 822,1 = +490,6 кДж









 0 Эндо термическая реакция " width="640"
0 Эндо термическая реакция " width="640"

















