
САБАҚТЫҢ ТАҚЫРЫБЫ: ЭЛЕКТРОЛИЗ
№ 13 мектеп-гимназиясы
Химия пәні мұғалімі:
Мукушева Қ.М.
10 сынып

Сабақтың мақсаты

Үй тапсырмасын тексеру
“ Ой қозғау ” тапсырмалары. Топтық жұмыс.

Электролиз
Электролит балқымасы немесе ерітіндісі арқылы
тұрақты электр тогы өткенде электродтарда жүретін тотығу-тотықсыздану реакцияларын электролиз деп атайды.

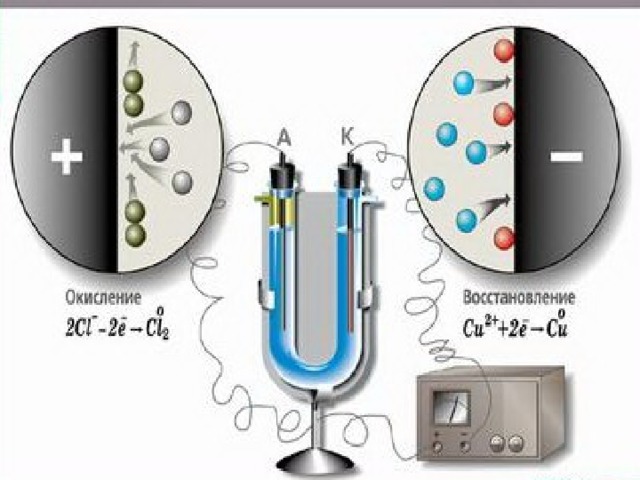
Мыс хлориді ерітіндісінің электролизі
Мыс хлориді ерітіндісін қарастырамыз. Аспапты ток көзіне қосамыз. Аздан соң бір электродта мыс, ал екіншісінде газ бөлінгенін бақылаймыз. Электр тогының әсерінен жаңа заттар – мыс және хлор түзілді. Электродтарды ток көзіне қосқанда, біреуі теріс, ал екіншісі – оң зарядталады. Осы кезде С u 2+ және СІ – иондары әр түрлі электродтарға қарай жылжиды. Катодқа оң С u 2+ иондары , ал анодқа теріс СІ – иондары бағытталады.

Электролиз кезінде
- С u 2+ иондары катодқа жетіп, одан электрондарды қабылдап, тотықсызданады да мыс атомдары электродтың бетіне қонады:
С u 2+ + 2e = С u 0
- Катодты мыс қабаты қаптайды.
- Хлорид иондары анодқа жетіп, электрондарын беріп тотығады да атомдарға айналады. Олар жұптасып молекулалар түзеді. Анодта газ хлор бөлінеді: 2СІ – + 2e = CI 2 0
- С uCI 2 → С u + CI 2
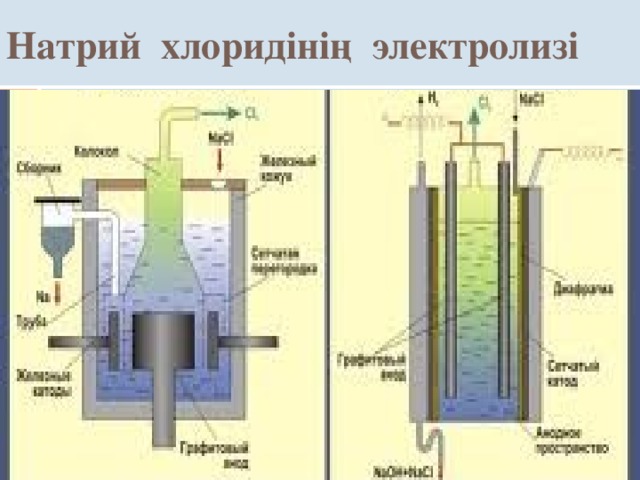
Натрий хлорид інің электролизі

Электролиз процесі
Электролиз – бұл электр тогының әсерінен өтетін тотығу-тотықсыздану процесі. Балқымалардың электролизі кезінде катодта үнемі металл бөлінеді. Ерітінділердің электролизі кезінде катодта және анодта заттардың бөлінуі қатысатын иондардың табиғатына тәуелді.

Судың электролизі

Катодтық процестер
- С u 2+ -тан А u 3 + -ға дейін металдардың катиондары электролиз кезінде катодта толықтай тотықсызданады.
- Li + - ме н АІ 3 + -ті қоса металдардың катиондары электролиз кезінде катодта тотықсызданбайды, олардың орнына су молекуласы тотықсызданады, сутек бөлінеді.
- АІ 3 + -ден Н + - ке дейін металдардың катиондары электролиз кезінде катодта су молекуласымен бір уақытта тотықсызданады, сутек бөлінеді.
А

А

А

Анодты қ процестер
Анодта жүретін реакцияның сипаты – су молекуласының қатысуына және анод жасалған затқа тәуелді болады.
Анодтар ерімейтін және еритін болып екіге бөлінеді. Ерімейтін анод – көмірден, графиттен, платинадан, иридийден жасалса, екіншілері – мыстан, күмістен, мырыштан, кадьмийден, никельден және басқа металдардан жасалады.

Анодты қ процестер
- Электролиз кезінде ерімейтін анодта аниондардың немесе су молекуласының тотығуы жүреді. Оттексіз қышқылдардың аниондары (S 2- ,I - , Br - , CI - ) олардың концентрациясы жеткілікті болса оңай тотығады. оттекті қышқылдардың аниондары (S О 4 2- ,NO 3 - , CO 3 2- , PO 4 3- ) болса, онда анодта бұл иондар емес, су молекулалары тотығып, оттегі бөліп шығарады.
- Электролиз кезінде ерігіш анод өзі тотығуға ұшырайды, яғни электрондарын сыртқы тізбекке жібереді.

Электролиттердің судағы ерітінділеріндегі электролиз өнімі
Электролиттер
Электролиз өнімі
Сілтілер, оттекті қышқылдар , оттекті қышқылдардың тұздары, белсенді металдар (K, Na, Ca) .
Оттексіз қышқылдар, олардың тұздары, белсенді металдар (K, Na, Ca) .
Н 2 және О 2 өйткені тек су ғана айырылады .
Оттексіз қышқылдардың тұздары, белсенділігі орташа металдар ( Co, Ni, Cr, Sn) .
Н 2 және S , галогендер және т.б.
Оттекті қышқылдардың тұздары, белсенділігі аз металдар ( Cu, Hg, Ag, Pt, Au), металдар (Co, Ni, Cr, Sn)
Металдар, галогендер, ал Н + ионының концентрациясы көп болса, Н 2 -де бөлініп шығады.
Металл және О 2 бөлініп шығады.

Сабақты бекіту
- Есеп шығару. №1. 1 топқа №1 есеп.
Калий хлоридінің сулы ерітіндісі электролизі нің сызбанұсқасын құру. Калий хлоридінің теңдеуі:
КСІ ↔ К + + CI -

Ерітінді электролизінің теңдеуін құру
- К + мен ОН - иондары ерітіндіде қалып, калий гидроксидін түзеді. Реакция теңдеуі:
2КСІ + 2H 2 O = 2KOH + H 2 ↑ + CI 2 ↑.
№ 2. 2 топқа. Мыс сульфаты ерітіндісінің электролиз теңдеуін құру. Мыс сульфатының диссоциация теңдеуі: CuSO 4 ↔ Cu 2+ + SO 4 2-
катодта
анодта

Ерітінді электролизінің теңдеуін құру
- Катодта: Cu 2+ + 2е = Cu 0
- Анодта: 2H 2 O – 4е = 4 H + + О 2 ↑
- Н + мен SO 4 2- иондары ерітіндіде қалып, күкірт қышқылын түзеді. Реакция теңдеуі:
2 CuSO 4 + 2H 2 O = 2Cu + 2 H 2 SO 4 + O 2 ↑.

Оқулықпен жұмыс
- № 6 есеп. 141-бет. 3 топқа № 6 есеп беріледі.
Берілгені: m( Ме )= 13г Шешуі: Мырыштың массасы
ὴ = 85 % m(Zn) = 13 г ∙100% / 85%=15,3 г
Табу керек: V (O 2 ) = ? М (Zn) = 65 г/моль
Электролиз кезінде жүретін реакция теңдеуін жазамыз:
К ( - ) Zn +2 + 2e → Zn 0
A (+) 2H 2 O – 4е = 4 H + + О 2 ↑
ZnSO 4 ерітіндісінің электролизі кезінде катодта мырыш бөлінеді.
2 ZnSO 4 + 2H 2 O = 2Zn + 2 H 2 SO 4 + O 2 ↑
65 г/моль 22 л/моль
15,3 г х
Бөлінген O 2 газының көлемін табамыз:
V(O 2 ) = 15,3 г∙ 22 л/моль / 2 ∙ 65 г/моль = 2,6 л

Сабақты қорытындылау.
Тобықтай түйін.
- Электролиз – электр тогының әсерінен жүретін тотығу-тотықсыздану реакциясы.
- Балқымалардың электролизі кезінде катодта үнемі металл бөлінеді.
- Ерітінділердің электролизі кезінде катодта және анодта заттардың бөлінуі қатысатын иондардың табиғатына тәуелді.
- Бұйымдарды электролиз әдісі арқылы металдармен қаптау тәсілі гальваностегия деп аталады.
Грекше “ стеге ” – қаптау деген мағынаны білдіреді.

Үйге тапсырма:
- § 5.5. №1-5 жаттығуларды орындау. 141 бет.
- Оқушылар бірін-бірі, топты бағалайды.
- Рефлекция.






































