

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Фонд оценочных средств по учебной дисциплине оп.10 аналитическая химия
Фонд оценочных средств учебной дисциплины разработан на основе ФГОС СПО по специальности 33.02.01 Фармация
Просмотр содержимого документа
«Фонд оценочных средств по учебной дисциплине оп.10 аналитическая химия»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего образования
«КРЫМСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
имени В.И.Вернадского»
МЕДИЦИНСКИЙ КОЛЛЕДЖ
(структурное подразделение)
ФГАОУ ВО «КФУ имени В.И.Вернадского»
«Утверждаю»
Зам. директора по учебной работе
__________________А.С. Быкова
«____»_____________2015 года
ФОНД оценочныХ средств
по учебной дисциплине
ОП.10 АНАЛИТИЧЕСКАЯ ХИМИЯ
название учебной дисциплины
Специальность 33.02.01 (ФАРМАЦИЯ)
Фонд оценочных средств учебной дисциплины разработан на основе Федерального государственного образовательного стандарта среднего профессионального образования по специальности 33.02.01 (ФАРМАЦИЯ)
Организация – разработчик: Медицинский колледж (структурное подразделение) ФГАОУ ВО «КФУ ИМ. В.И. ВЕРНАДСКОГО»
Разработчик:
Белякова Людмила Ильинична
преподаватель первой
квалификационной категории _________________ Л.И. Белякова
Программа учебной дисциплины рекомендована Цикловой Методической комиссией общих гуманитарных и социально-экономических дисциплин
(Протокол № ____ от _______________)
Председатель ________________ Л.В. Зайцева
Фонд оценочных средств учебной дисциплины рассмотрен на заседании МС (Протокол № ____ от _______________)
Зам. директора по учебной работе _______________А.С. Быкова
1. паспорт ФОНДА оценочных СРЕДСТВ УЧЕБНОЙ ДИСЦИПЛИНЫ
| ОП.10 АНАЛИТИЧЕСКАЯ ХИМИЯ |
название дисциплины
В результате освоения учебной дисциплины обучающийся должен уметь:
правильно и аккуратно выполнять реакции полумикрометодом, капельным и микрокристаллоскопическим методами ;
владеть техникой обычных аналитических операций;
грамотно оформлять и обрабатывать полученные результаты;
уметь по химическим свойствам веществ, в том числе лекарственных, подбирать методы качественного и количественного анализа;
работать с мерной посудой; на аналитических весах;
готовить титрованные растворы, устанавливать титр и эквивалентную концентрацию раствора;
титровать пипеткой, бюреткой и титровальной установкой;
точно фиксировать точку конца титрования(точку эквивалентности );
выбирать необходимые методы анализа;
применять методы количественного анализа при контроле различных исследуемых веществ;
наблюдать, обобщать, сравнивать, математически обрабатывать экспериментальные данные;
работать с приборами (ФЭК, рефрактометр и др.).
В результате освоения дисциплины обучающийся должен знать:
теоретические основы аналитической химии ;
методы качественного анализа;
качественные реакции, применяемые в фармацевтическом анализе;
методы количественного анализа;
требования к реакциям, исходным веществам, титрованным растворам;
вычисления в титриметрическом анализе.
В результате освоения дисциплины обучающийся формирует общие и профессиональные
компетенции:
ОК 2. Организовывать собственную деятельность, определять методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Решать проблемы, оценивать риски и принимать решения в нестандартных ситуациях.
ПК 1.1. Организовывать прием, хранение лекарственных средств, лекарственного растительного сырья и товаров аптечного ассортимента в соответствии с требованиями нормативно-правовой базы.
ПК 1.6. Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
ПК 2.1. Изготавливать лекарственные формы по рецептам и требованиям учреждений здравоохранения.
ПК 2.2. Изготавливать внутриаптечную заготовку и фасовать лекарственные средства для последующей реализации.
ПК 2.3. Владеть обязательными видами внутриаптечного контроля лекарственных средств.
Формой аттестации по учебной дисциплине является ______ экзамен _____.
2. РЕЗУЛЬТАТЫ ОСВОЕНИЯ УЧЕБНОЙ ДИСЦИЛИНЫ,
ПОДЛЕЖАЩИХ ПРОВЕРКЕ
В результате освоения по учебной дисциплине осуществляется комплексная проверка следующих знаний и умений:
| Результаты обучения (освоенные умения, усвоенные знания) | Формы и методы контроля и оценки результатов обучения |
| Умения | |
| У1. Уметь составлять уравнения реакций в молекулярной и сокращенной ионной форме, владеть техникой обычных аналитических операций. У2. Уметь по химическим свойствам веществ, в том числе лекарственных, подбирать методы качественного и количественного анализа. У3. Работать с мерной посудой; на аналитических весах. У4. Готовить титрованные растворы, устанавливать титр и эквивалентную концентрацию раствора. У5. Титровать из бюретки, титровальной установкой, точно фиксировать точку конца титрования. У6. Пприменять методы количественного анализа при контроле различных исследуемых веществ. У7. Работать с приборами (ФЭК, рефрактометр и др.). У8. Грамотно оформлять и обрабатывать полученные результаты.
| 1. Письменный, тестовый, индивидуальный опрос.
2. Письменный, тестовый, с применениям компьютерных технологий, индивидуально. 3. Письменный, тестовый, индивидуальный опрос. 4. Письменный, тестовый, индивидуальный опрос. 5. Письменный, тестовый, индивидуальный опрос. Работа малыми группами. 6. Письменный, тестовый, с применениям компьютерных технологий, индивидуально. 7. Письменный, индивидуальный опрос. 8. Письменный, тестовый, с применениям компьютерных технологий, индивидуально.
|
| Знания | |
| 31. Теоретические основы аналитической химии З2. Методы качественного и количественного анализа. З3. Качественные реакции, применяемые в фармацевтическом анализе. | Письменный, устный семинар. Письменный, тестовый, индивидуальный опрос. Работа малыми группами. Письменный, тестовый, индивидуальный опрос. |
3.Оценка освоения учебной дисциплины
3.1. Формы и методы оценивания
Предметом оценки служат знания и умения, предусмотренные ФГОС СПО по дисциплине ОП.10 аналитическая химия и направленные на формирование общих и профессиональных компетенций.
Текущий контроль освоения студентами программного материала учебной дисциплины имеет следующие виды: входящий, оперативный и рубежный.
Входящий контроль знаний студентов проводится в начале изучения дисциплины с целью определения освоенных знаний и умений (базовых) в рамках изучения общепрофессиональных дисциплин, а также выстраивания индивидуальной траектории обучения студентов.
Оперативный контроль проводится с целью объективной оценки качества освоения программы учебной дисциплины, а также стимулирования учебной работы студентов, мониторинга результатов образовательной деятельности, подготовки к промежуточной аттестации и обеспечения максимальной эффективности учебно-воспитательного процесса. Оперативный контроль проводится преподавателем на любом из видов учебных занятий. Формы оперативного контроля (контрольная работа, тестирование, опрос, выполнение и защита практических, выполнение рефератов (докладов), подготовка презентаций, наблюдение за деятельностью обучающихся и т.д.) выбираются преподавателем, исходя из методической целесообразности.
Рубежный контроль является контрольной точкой по завершению отдельного раздела учебной дисциплины.
Экзамен проводится по окончании изучения дисциплины.
В системе оценки знаний используются следующие критерии:
«Отлично» – за глубокое и полное овладение содержанием учебного материала, в котором студент легко ориентируется, владение понятийным аппаратом за умение связывать теорию с практикой, решать практические задачи, высказывать и обосновывать свои суждения. Отличная отметка предполагает грамотное, логичное изложение ответа (как в устной, так и в письменной форме), качественное внешнее оформление;
«Хорошо» – если студент полно освоил учебный материал, владеет понятийным аппаратом, ориентируется в изученном материале, осознанно применяет знания для решения практических задач, грамотно излагает ответ, но содержание и форма ответа имеют некоторые неточности;
«Удовлетворительно» – если студент обнаруживает знание и понимание основных положений учебного материала, но излагает его неполно, непоследовательно, допускает неточности в определение понятий, в применении знаний для решения практических задач, не умеет доказательно обосновать свои суждения;
«Неудовлетворительно» – если студент имеет разрозненные, бессистемные знания, не умеет выделять главное и второстепенное, допускает ошибки в определение понятий, искажает их смысл, беспорядочно и неуверенно излагает материал, не может применять знания для решения практических задач; за полное незнание и непонимание учебного материала или отказ отвечать
В системе оценки умений используются следующие критерии:
«Отлично» - ставится, если студент:
а) умеет подтвердить на примерах …
б) умело строит аргументы …
в) целесообразно использует теоретический материал для составления ……
г) правильно использует необходимые…
д) демонстрирует умение действовать в стандартных и нестандартных профессиональных ситуациях
е) грамотное составление …, относящихся к профессиональной деятельности и т.п.
«Хорошо» - ставится, если студент обнаруживает практические умения, удовлетворяющие
тем же требованиям, что и для отметки «отлично», но допускает единичные негрубые ошибки, которые сам же исправляет после замечания преподавателя.
«Удовлетворительно» - ставится, если студент обнаруживает практические умения, но:
а) затрудняется привести примеры…
б) непоследовательно строит аргументы …
в) нецелесообразно использует теоретический материал для составления …..
г) излагает материал недостаточно связно и последовательно с частыми заминками и перерывами;
д) испытывает затруднения в действиях при нестандартных профессиональных ситуациях и т.п.
«Неудовлетворительно» - ставится, если студент допускает грубые нарушения алгоритма
действий или ошибки, влекущие за собой возникновение отрицательных последствий для пациента или медицинского работника, или (и) отсутствие умения действовать в стандартных профессиональных ситуациях, или (и) обнаруживает незнание или непонимание большей части соответствующего раздела.
Критерии оценивания тестирования:
«Отлично» - 100-91 % (91 – 100) правильных ответов,
«Хорошо» - 90-81 % (81 – 90) правильных ответов,
«Удовлетворительно» – 80-71 % (71 – 80) правильных ответов,
«Неудовлетворительно» - 70-0 % (0 – 70) правильных ответов.
4. фОНД ОЦЕНОЧНЫХ СРЕДСТВ для ПРОМЕЖУТОЧНОЙ аттестации по учебной дисциплине
Выполнение тестовых заданий «Основные понятия и законы химии»:
Тест №1
1. Отметьте правильные утверждения:
а) химический элемент обозначается химическим символом;
б) химические элементы имеют изотопы;
в) некоторые химические элементы получены искусственно;
г) в земной коре наиболее распространен элемент кислород.
2. Укажите формулы сложных веществ:
![]()
3. При каких процессах протекают химические реакции:
а) фильтрование;
б) перегонка нефти;
в) гидратация этилена;
г) полимеризация этилена.
4. Укажите единицу измерения количества вещества:
а) г; б) кг; в) а.е.м.; г) моль.
5. Отметьте правильные утверждения.
Относительная атомная масса:
а) показывает, во сколько раз масса атома больше 1/12 части массы изотопа углерода ![]()
б) имеет размерность г/моль;
в) безразмерная величина;
г) приведена в Периодической системе элементов.
6. Укажите массу атома углерода:
а) 12 г; б) 6 г; в) ![]()
7. Отметьте правильные утверждения. Постоянная Авогадро:
а) показывает число структурных единиц в 1г вещества;
б) показывает число структурных единиц в 1 моле вещества;
в) имеет размерность ![]()
г) равна 22,4 л.
8. Укажите массы или объемы соединений, в которых содержится 1 моль вещества:
а) 22,4 л ![]()
б) 98 г ![]()
в) 40 г NaOH;
г) 26 г ![]()
9. Укажите формулы аллотропных модификаций элемента кислорода:
а) О2;
б) О3;
в) ![]()
г) N0.
10. Укажите молекулу, которая имеет наибольшую массу:
а) ![]()
б) СО;
![]()
Тест №2
(Возможно несколько правильных ответов)
1. Объемные доли азота и этилена (С2Н4) в смеси одинаковы. Массовые доли газов в этой же смеси:
а) одинаковы; б) больше у азота;
в) больше у этилена; г) зависят от давления.
2. Масса 10 м3 воздуха при н.у. равна (в кг):
а) 20,15; б) 16,25; в) 14,50; г) 12,95.
3. 465 мг фосфата кальция содержат следующее число катионов и анионов соответственно:
а) 2,7•1021 и 1,8•1021; б) 4,5•1020 и 3,0•1020;
в) 2,7•1025 и 1,8•1025; г) 1,2•1025 и 1,1•1025.
4. Число моль молекул воды, содержащееся в 18,06•1022 молекулах воды, равно:
а) 0,667; б) 0,5; в) 0,3; г) 12.
5. Из приведенных ниже веществ к простым относятся:
а) серная кислота; б) сера;
в) водород; г) бром.
6. Атом, имеющий массу 2,66•10–26 кг, соответствует элементу:
а) сера; б) магний;
в) кислород; г) цинк.
7. Частица, являющаяся химически делимой, это:
а) протон; б) молекула;
в) позитрон; г) атом.
8. Об углероде как о простом веществе говорится в утверждении:
а) углерод распространен в природе в виде изотопа с массовым числом 12;
б) углерод при горении в зависимости от условий может образовывать два оксида;
в) углерод входит в состав карбонатов;
г) углерод имеет несколько аллотропных модификаций.
9. Валентность атома – это:
а) число химических связей, образованных данным атомом в соединении;
б) степень окисления атома;
в) число отданных или принятых электронов;
г) число электронов, недостающее до получения электронной конфигурации ближайшего инертного газа.
10. Какое из следующих явлений является химическим?
а) Плавление льда; б) электролиз воды;
в) возгонка йода; г) фотосинтез.
Решение задач
Задачи на определение количества вещества по базовым формулам
(По известным массе, объему, числу структурных единиц)
Уровень А
1. Сколько атомов хрома содержится в 2 г дихромата калия?
Ответ. 8,19•1021.
2. Каких атомов – железа или магния – больше в земной коре и во сколько раз? Массовая доля железа в земной коре составляет 5,1%, магния – 2,1%.
Ответ. Атомов железа больше, чем атомов магния в 1,04 раза.
3. Какой объем (в л) занимают:
а) 1,5•1022 молекул фтора;
б) 38 г фтора;
в) 1•1023 молекул кислорода?
Ответ. а) 0,558; б) 22,4; в) 3,72.
4. Найти массу (в г) одной молекулы: а) воды;
б) плавиковой кислоты; в) азотной кислоты.
Ответ. а) 2,99•10–23; б) 3,32•10–23; в) 1,046•10–22.
5. Сколько молей вещества содержится в:
а) 3 г трифторида бора;
б) 20 л хлористого водорода;
в) 47 мг пентаоксида фосфора;
г) 5 мл воды?
Ответ. а) 0,044; б) 0,893; в) 0,33; г) 0,28.
6. Металл массой 0,4 г содержит 6,02•1021 атомов. Определить металл.
Уровень В
1. К 100 г 20%-го раствора соляной кислоты добавили 100 г 20%-го раствора гидроксида натрия. Сколько структурных единиц соли NaCl и молекул воды содержит полученный раствор?
Ответ. 5,65•1024 молекул воды и 3,01•1023 структурных единиц соли NaCl.
2. Определить массу 8,2 л газовой смеси гелия, аргона и неона (н.у.), если на один атом гелия в этой смеси приходится два атома неона и три атома аргона.
Ответ. 10 г.
3. В каком соотношении по массе необходимо смешать 2%-е растворы хлорида калия и сульфата натрия, чтобы в итоговом растворе ионов натрия было по массе в четыре раза больше, чем ионов калия?
Ответ. 6,46 : 1.
4. Плотность жидкого кислорода при температуре –183 °С равна 1,14 г/см3. Во сколько раз увеличится объем кислорода при переходе его из жидкого состояния в газообразное при н.у.?
Ответ. В 798 раз.
5. Чему равна массовая доля серной кислоты в растворе, в котором числа атомов водорода и кислорода равны между собой?
Ответ. 73,13%.
Критерии оценки: см. 3.1. Формы и методы оценивания
Эталон ответа:
Ключ к тесту №1
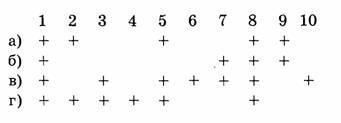
Ключ к тесту №2
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а | г | а | в | б, в, г | в | б | б, г | а | б, г |
Задачи
(А) Металл массой 0,4 г содержит 6,02•1021 атомов. Определить металл.
Дано:
N = 6,02•1021 атомов, m(M) = 0,4 г.
Найти: металл.
Решение
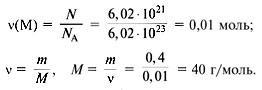
Искомый металл – Ca.
Ответ. Кальций.
(В) Чему равна массовая доля серной кислоты в растворе, в котором числа атомов водорода и кислорода равны между собой?
Решение
Раствор H2SO4 состоит из H2SO4 и H2O. Пусть ![]() (H2SO4) = x моль, тогда
(H2SO4) = x моль, тогда ![]() (H в H2SO4) = 2xмоль;
(H в H2SO4) = 2xмоль;
![]() (H2O) = y моль, тогда
(H2O) = y моль, тогда ![]() (H в H2O) = 2y моль.
(H в H2O) = 2y моль.
Сумма ![]() (H в р-ре) = (2x + 2y) моль.
(H в р-ре) = (2x + 2y) моль.
Определим количество вещества атомарного кислорода:
![]() (O в H2SO4) = 4x моль,
(O в H2SO4) = 4x моль, ![]() (O в H2O) = y моль.
(O в H2O) = y моль.
Сумма ![]() (O в р-ре) = (4x + y) моль.
(O в р-ре) = (4x + y) моль.
Поскольку числа атомов O и H равны между собой, то 2x + 2y = 4x + y.
Решая уравнение, получаем: 2x = y. Если
x = ![]() (H2SO4) = 1 моль, то y =
(H2SO4) = 1 моль, то y = ![]() (H2O) = 2 моль.
(H2O) = 2 моль.
m(H2SO4) = ![]() (H2SO4)•M(H2SO4) = 1•98 = 98 г;
(H2SO4)•M(H2SO4) = 1•98 = 98 г;
m(H2O) = ![]() (H2O)•M(H2O) = 2•18 = 36 г;
(H2O)•M(H2O) = 2•18 = 36 г;
m(р-ра) = m(H2SO4) + m(H2O) = 98 + 36 = 134 г.
Массовая доля серной кислоты в растворе:
![]()
Ответ. 73,13%.
Раздел 1. Предмет «Аналитической химии». Основные характеристики методов.
Тема 1.1 Введение.
Собеседование по вопросам:
1.Предмет «Аналитической химии», ее значение и задачи.
2.Развитие аналитической химии, вклад русских ученых в развитие аналитической химии.
3. Связь аналитической химии с другими дисциплинами.
4.Объекты аналитического анализа.
Методы химического анализа.
5.Основные характеристики методов.
6.Требования, предъявляемые к анализу веществ.
7. Современные достижения аналитической химии как науки.
Критерии оценки: см. 3.1. Формы и методы оценивания
Тема 1.2. Растворы. Химическое равновесие. Закон действующих масс.
Кислотно-основное равновесие. Равновесие в гетерогенной системе раствор – осадок.
Письменный опрос
Контрольные вопросы
1) Каковы термодинамические условия химического равновесия?
2) Как рассчитывается константа химического равновесия для: а) гомогенных б) гетерогенных реакций?
3) Какие параметры влияют на смещение химического равновесия?
4) Напишите выражение для константы равновесия гомогенной системы СН4 + СО2 ↔ 2СО + 2Н2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция – образование водорода - эндотермическая.
5) Вычислите константу равновесия для гомогенной системы
СО (г) + Н2О (г) ↔ СО2 + Н2 (г), если равновесные концентрации реагирующих
веществ: [СО] = 0,004 моль/л; [Н2О] = 0,064 моль/л; [СО2] = 0,016 моль/л; [Н2] = 0,016 моль/л.
6) Исходные концентрации NO и Cl2 в гомогенной системе
2NO + Cl2 ↔ 2NOCl
составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
7) Напишите выражение для константы равновесия гетерогенной системы:
СО2 + С ↔ 2СО. Как следует изменить давление, чтобы повысить выход СО?
Критерии оценки: см. 3.1. Формы и методы оценивания
Раздел 2 Качественный анализ
Тема 2.1. Методы качественного анализа.
Устный опрос
Сущность химических, физико – химических и физических методов качественного анализа.
Гравиметрические методы анализа.
Титриметрические методы анализа.
Кинетические методы анализа.
Биохимические методы анализа.
В чём отличия «сухого» метода анализа от «мокрого»?
Амфотерные соединения. Приведите примеры амфотерных соединений. Составьте уравнение реакции, подтверждающие амфотерные свойства Zn(OH)2
Амфотерные гидроксиды .
Критерии оценки: см. 3.1. Формы и методы оценивания
Эталон ответа:
Методы качественного анализа делятся на химические, физико-химические и
физические.
Физические методы основаны на изучении физических свойств анализируемого
вещества. К этим методам относятся спектральный, рентгеноструктурный, масс-
спектрометрический анализы и др.
В физико-химических методах течение реакции фиксируется измерением
определенного физического свойства исследуемого раствора. К этим методам
относятся полярография, хроматография и др.
К химическим методам относятся методы, основанные на использовании
химических свойств исследуемых веществ.
В основе химических методов обнаружения и определения лежат химические реакции трех типов: кислотно-основные, окислительно-восстановительные и комплексообразования. Иногда они сопровождаются изменением агрегатного состояния компонентов. Наибольшее значение среди химических методов имеют гравиметрический и титриметрический. Эти аналитические методы называются классическими. Критериями пригодности химической реакции как основы аналитического метода в большинстве случаев являются полнота протекания и большая скорость.
Гравиметрические методы.
Гравиметрический анализ заключается в выделении вещества в чистом виде и его взвешивании. Чаще всего такое выделение проводят осаждением. Реже определяемый компонент выделяют в виде летучего соединения (методы отгонки). В ряде случаев гравиметрия - лучший способ решения аналитической задачи. Это абсолютный (эталонный) метод. Недостатком гравиметрический методов является длительность определения, особенно при серийных анализах большого числа проб, а так же неселективность - реагенты-осадители за небольшим исключением редко бывают специфичны. Поэтому часто необходимы предварительные разделения. Аналитическим сигналов в гравиметрии является масса.
Титриметрические методы.
Титриметрическим методом количественного химического анализа называют метод, основанный на измерении количества реагента В, затраченного на реакцию с определяемым компонентом А. Практически удобнее всего прибавлять реагент в виде его раствора точно известной концентрации. В таком варианте титрованием называют процесс непрерывного добавления контролируемого количества раствора реагента точно известной концентрации (титрана) к раствору определяемого компонента.
В титриметрии используют три способа титрования: прямое, обратное и титрование заместителя.
Прямое титрование - это титрование раствора определяемого вещества А непосредственно раствором титрана В. Его применяют в том случае, если реакция между А и В протекает быстро.
Обратное титрование заключается в добавлении к определяемому веществу А избытка точно известного количества стандартного раствора В и после завершения реакции между ними, титровании оставшегося количества В раствором титрана В'. Этот способ применяют в тех случаях, когда реакция между А и В протекает недостаточно быстро, либо нет подходящего индикатора для фиксирования точки эквивалентности реакции.
Титрование по заместителю заключается в титровании титрантом В не определяемого количества вещества А, а эквивалентного ему количества заместителя А', получающегося в результате предварительно проведенной реакции между определяемым веществом А и каким-либо реагентом. Такой способ титрования применяют обычно в тех случаях, когда невозможно провести прямое титрование.
Кинетические методы.
Кинетические методы основаны на использовании зависимости скорости химической реакции от концентрации реагирующих веществ, а в случае каталитических реакций и от концентрации катализатора. Аналитическим сигналом в кинетических методах является скорость процесса или пропорциональная ей величина.
Реакция, положенная в основу кинетического метода, называется индикаторной. Вещество, по изменению концентрации которого судят о скорости индикаторного процесса, - индикаторным.
Биохимические методы.
Среди современных методов химического анализа важное место занимают биохимические методы.
К биохимическим методам относят методы, основанные на использовании процессов, происходящих с участием биологических компонентов (ферментов, антител и т.п.).
Аналитическим сигналом при этом чаще всего являются либо начальная скорость процесса, либо конечная концентрация одного из продуктов реакции, определяемая любым инструментальным методом.
Ферментативные методы основаны на использовании реакций, катализируемых ферментами - биологическими катализаторами, отличающимися высокой активностью и избирательностью действия.
Иммунохимические методы анализа основаны на специфическом связывании определяемого соединения - антигена соответствующими антителами. Иммунохимическая реакция в растворе между антителами и антигенами - сложный процесс, протекающий в несколько стадий
Реакции, позволяющие получить внешний эффект с определяемым веществом, называют аналитическими, а добавляемое для этого вещество - реагентом. Аналитические реакции, проводимые между твердыми веществами, относят к реакциям «сухим путем», а в растворах - «мокрым путем».
К реакциям «сухим путем» относятся реакции, выполняемые путем растирания твердого исследуемого вещества с твердым реагентом, а также путем получения окрашенных стекол (перлов) при сплавлении некоторых элементов с бурой.
Значительно чаще анализ проводят «мокрым путем», для чего анализируемое вещество переводят в раствор. Реакции с растворами могут выполняться пробирочным, капельным и микрокристалли-ческимметодами. При пробирочном полумикроанализе его выполняют в пробирках вместимостью 2-5см3. Для отделения осадков используют центрифугирование, а выпаривание ведут в фарфоровых чашечках или тиглях. Капельный анализ (Н.А. Тананаев, 1920 г.) осуществляют на фарфоровых пластинках или полосках фильтрованной бумаги, получая цветные реакции при добавлении к одной капле раствора вещества одной капли раствора реактива. Микрокристаллический анализ основан на обнаружении компонентов с помощью реакций, в результате которых образуются соединения с характерным цветом и формой кристаллов, наблюдаемых в микроскоп.
Амфоте́рность (от др.-греч. αμφίς — «оба») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства. Например, вода образует при диссоциации ионы Н+ и ОН−(Н2О ⇄ Н+ + ОН−). Амфотерны гидроксиды: гидроксид алюминия Аl(ОН)3, гидроксид хрома(III) Сr(ОН)3, гидроксид цинка Zn(OH)2 и др. При растворении они диссоциируют в зависимости от условий, с образованием ионов Н+ или ОН−, например:
Сr(ОН)3 ⇄ Сr3+ + ЗОН− (проявление осно́вных свойств)
Сr(ОН)3 ⇄ H+ + CrO2− + Н2О (проявление кислотных свойств).
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II,III,IV.
Характерные реакции
Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются проявлением основных свойств амфотерных оксидов, например:
ZnO + H2SO4 → ZnSO4 + H2O
Они также реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например:
ZnO + 2NaOH → Na2ZnO2 + H2O Амфотерные оксиды могут реагировать с щелочами двояко: в растворе и в расплаве.
При реакции с щёлочью в расплаве образуется обычная средняя соль(как показано на примере выше).
При реакции с щёлочью в растворе образуется комплексная соль.
Al2O3 + 2NaOH → 2Na[Al(OH)4] (В данном случае образуется тетрагидроксоаллюминат натрия)
Для каждого амфотерного металла есть свое координационное число. Для Be и Zn — это 4; Для и Al — это 4 или 6; Для и Cr — это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Амфоте́рные гидрокси́ды — химические вещества, которые в кислой среде ведут себя как основания, а в щелочной — как кислоты.
В пределах каждого периода элементы со свойствами металлов сменяются элементами, которые проявляют свойства как металлов, так и неметаллов. Соединения этих элементов называются амфотерными. Элемент алюминий проявляет в соединениях свойства металла и неметалла. Подобные свойства имеют элементы А-групп — Be, Ga, Ge, Sn, Pb, Sb, Bi и другие, а также большинство элементов Б-групп — Cr, Mn, Fe, Zn, Cd и другие. Практически все они нерастворимы в воде, являются слабыми электролитами.
При нагревании соединения разлагаются. В большинстве случаев при взаимодействии гидроокиси металла образуется гидроксосоль соответствующей кислоты: Me(OH)n+nNaOH→Nan[Me(OH)2n] например, таким образом взаимодействие протекает для Al(3+), Cr(3+), Zn(2+) и многих других металлов. Данная реакция является обратимой, положение равновесия зависит от природы металла pH среды и частично от температуры. Так же в растворе могут существовать ионы с меньшим координационным числом металла.
Гидроксид цинка проявляет основные свойства, взаимодействуя с кислотами, например:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O.
Кислотные свойства подтверждаются реакцией растворения гидроксида цинка в растворе щелочи, например:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4].
Тема 2.2. Катионы I аналитической группы. Катионы II аналитической группы.
Выполнение тестовых заданий
1. К катионам I-ой аналитической группы относятся K+ ,Na+ , NH4 + , которые образуют хорошо растворимые в воде соединения. Какой групповой реагент можно использовать для отделения катионов I-ой аналитической группы?
A. хлористоводородную кислоту. C. групповой реагент отсутствует. B. серную кислоту. D. гидроксид натрия. E. аммиак.
2. В химико-аналитической лаборатории исследовали растворы, содержащие смеси катионов. В каком из растворов содержатся только катионы I-ой аналитической группы?
A. Na+ , NH4 + , Ca2+ . C. Na+ , Co2+ , Ni2+ . B. K+ , NH4 + , Ba2+ . D. Na+ , K+ , NH4 + . E. NH4 + , Ca2+ , Со2+ .
3. Фармакопея рекомендует определять катион калия в лекарствах действием винной кислоты. Какой аналитический эффект наблюдается в случае обнаружения катиона калия при помощи этого реактива?
A. Желтый кристаллический осадок. C. Белый кристаллический осадок. B. Белый творожистый осадок. D. Желтый творожистый осадок. E. Черный творожистый осадок.
4. В растворе присутствуют катионы кальция, бария, аммония, калия и натрия. После того, как к раствору добавили небольшое количество раствора цинкуранилацетата, образовался желтый кристаллический осадок. Какой катион определили этой реакцией?
A. Кальция. B. Калия. C. Бария. D. Натрия. E. Аммония.
5. Действие щелочей является фармакопейной реакцией на один из катионов I-ой аналитической группы. Какой катион идентифицируют с помощью этой реакции?
A. NH4 + . B. Na+ . C. Ва2+ . D. Ca2+ . E. K+ .
6. При идентификации катиона калия используют раствор натрия гексанитрокобальтата ( III). Какой катион мешает определению калия при помощи этой реакции?
A. Co2+ . B. Na+ . C. NH4 + . D. Ca2+ . E. Ba2+ .
7. В аналитической лаборатории идентифицировали соединение, внося его в бесцветное пламя горелки, при этом пламя окрашивалось в фиолетовый цвет. Соли какого катиона дают такой эффект?
A. Са2+ . B. Sг2+ . C. Ва2+ . D. Na+ . E. K+ .
8. В лаборатории необходимо идентифицировать катион аммония. Какой раствор можно для этого использовать?
A. Калия хромата. C. Реактива Чугаева. B. Цинка уранилацетата. D. Натрия сульфата. E. Реактива Несслера.
9. В аналитической лаборатории проводили анализ лекарственного вещества, в состав которого входят катионы первой аналитической группы. Для определения натрия какой катион необходимо предварительно удалить из исследуемого раствора?
A. Аммония. C. Лития. B. Калия. D. Аммония и калия. E. Калия и лития.
По катионам II-ой аналитической группы
1. К катионам II-ой аналитической группы относятся Ag+ , Hg2 2+ , Pb2+ . Какой раствор является групповым реагентом на эти катионы?
A. 6 М HCl. B. 0,1М NaOH. C. 2 М NaOH. D. 2 М HCl. E. 2 М HNO3 .
2. В химико-аналитической лаборатории исследовали растворы, содержащие смеси катионов. В каком из растворов содержатся только катионы II-ой аналитической группы?
A. Hg2 2+ , NH4 + , Ag+ . C. Na+ , Pb2+ , Ni2+ . B. Ag+ , Hg2 2+ , Pb2+ . D. Na+ , Hg2 2+ , NH4 + . E. Pb2+ , Ag+ , Со2+ .
3. В растворе присутствуют катионы калия, ртути ( I), серебра, магния и натрия. После добавления небольшого количества раствора калия йодида, образовался желтый осадок. Какой катион определили при помощи этой реакции?
A. серебра. B. калия. C. магния. D. натрия. E. ртути (I).
4. В раствор, который содержит катионы меркурия ( I), прибавили раствор хлороводородной кислоты. К образовавшемуся осадку прилили раствор аммиака. Укажите химический состав вновь образовавшегося осадка:
A. [HgNH2 ]Cl + Hg. B. [HgNH2 ]Cl. C. HgO + Hg D. Hg(OH)2 + [HgNH2 ]Cl. E. Hg2 Cl2 + Hg.
5. В химико-аналитической лаборатории идентифицировали катионы серебр в лекарственной субстанции. Какой аналитический эффект наблюдается при действии щелочи на раствор, который содержит катионыAg+ ?
A. Выпадает черный осадок серебра, который растворяется. B. Выпадает бурый осадок оксида серебра. C. Выпадает белый осадок гидроксида серебра, который буреет. D. Раствор окрашивается в желтый цвет, затем буреет. E. Раствор окрашивается в черный цвет.
6. К исследуемому раствору прибавили 2М раствор HCl. При этом образовался белый осадок, который при добавлении горячей воды полностью растворился. Какой катион присутствует в растворе?
A. Pb2+ . B. Ba2+ . C. Mg2+ . D. Ag+. E. Hg2 2+ .
7. В химико-аналитической лаборатории идентифицировали катионы свинца. Какой осадок выпадает при действии избытка щелочи на раствор, который содержит катионы Pb2+ ?
A. белый аморфный осадок гидроксида свинца. B. осадок в данных условиях не выпадает. C. белый кристаллический осадок гидроксида свинца. D. белый осадок гидроксида свинца, который затем растворяется. E. желтый осадок оксида свинца.
8. В химико-аналитической лаборатории идентифицировали фармпрепарат «Колларгол», содержащий катионы серебра, действием НС l. Какие химические соединения образуются при взаимодействии хлорида серебра с избытком раствора аммиака?
A. [Аg(NН3 )2 ]Сl. B. [Аg4 (NН2 )3 ]С1. C. АgОН. D.АgNH2 . E. Реакция не идет.
Критерии оценки: см. 3.1. Формы и методы оценивания
Тема 2.3. Катионы III аналитической группы. Катионы IV аналитической группы.
Выполнение контрольно-аналитической задачи
Провести анализ растворов, содержащих катионы третьей аналитической группы.
Отчет по контрольно-аналитической задаче должен содержать:
1) краткое описание выполненных действий;
2) уравнения проведенных химических реакций в молекулярной и сокращенной молекулярно-ионной формах с указанием наблюдаемых аналитических эффектов;
3) названия полученных продуктов реакций;
4) выводы о результатах анализа по каждому анализируемому раствору;
5) ответ контрольно-аналитической задачи.
Вопросы для самоконтроля знаний:
1. Какое применение находят в медицине соли Ca2+, Sr2+, Ba2+?
2. Какими реакциями обнаруживают Ca2+, Sr2+, Ba2+?
3. Как можно обнаружить при совместном присутствии Ca2+, Sr2+, Ba2+?
4. Можно ли обнаружить Ba2+ в присутствии Ca2+ и Sr2+ реакцией с серной кислотой?
5. Можно ли обнаружить Ba2+ в присутствии Ca2+ и Sr2+ реакцией с K2Cr2O7?
6. Рассчитайте рН 0,01 М раствора муравьиной кислоты (Ка = 2,2·10‾4).
7. Определите рН в 0,001 М растворе азотной кислоты.
Критерии оценки: см. 3.1. Формы и методы оценивания
Эталон ответа:
Тема 2.4. Катионы V аналитической группы. Катионы VI аналитической группы.
Тестовые задания «Аналитические группы катионов»
1. Согласно кислотно-основной классификации все катионы делят:
1. на 3 группы; 2. на 2 группы; 3. на 4 группы; 4. на 6 групп.
2. На чем основана кислотно-основная классификация катионов:
1. на различной растворимости фосфатов в воде; 2. на различной растворимости сульфидов в воде; 3. на различной растворимости нитратов в воде; 4. на различной растворимости хлоридов, сульфатов, гидроксидов в воде, растворе аммиака, в растворе щелочей.
3. К первой аналитической группе катионов по кислотно-основной класси- фикации относятся катионы:
1. магния, калия, кальция; 2. алюминия, железа(II), хрома(III);
3. аммония, калия, натрия, лития; 4. кобальта(II), никеля(II), ртути(II).
4. Ко второй аналитической группе катионов по кислотно-основной класси- фикации относятся катионы:
1. серебра, свинца, ртути(I); 2. аммония, калия, кобальта(II);
3. магния, марганца(II), лития; 4. железа(II), ртути(II), никеля(II).
5. По кислотно-основной классификации к третьей аналитической группе ка- тионов относятся катионы:
1. натрия, серебра, калия; 2. бария, кальция, стронция;
3. магния, висмута(III), марганца(III); 4. свинца, кобальта(II), меди(II).
6. По кислотно-основной классификации к четвертой аналитической группе катионов относятся:
1. ионы калия, магния, бария; 2. ионы алюминия, хрома(III), цинка;
3. ионы меди(II), кобальта(II), никеля(II); 4. ионы натрия, лития, марганца(II).
7. К пятой аналитической группе катионов по кислотно-основной классифи- кации относятся катионы:
1. натрия, аммония, магния; 2. натрия, магния, кобальта(II) и никеля(II);
3. магния, марганца(II), железа(II), железа(III), висмута(III), а также сурь-
ма(III) и сурьма(V); 4. железа(III), алюминия, хрома(III), натрия.
8. К шестой аналитической группе катионов по кислотно-основной класси- фикации относятся катионы:
1. кобальта(II), никеля(II), кадмия, меди(II), ртути(II);
2. кобальта(II), меди(II), марганца(II), магния;
3. никеля(II), кадмия, калия, аммония; 4. бария, алюминия, никеля(II).
9. Гидроксиды железа(III), железа(II), марганца(II) и магния обладают общи- ми свойствами:
1. не растворяются в избытке раствора щелочи и аммиака, но растворяют-
ся в кислотах; 2. не растворяются в кислотах; 3. растворяются в избытке щелочи; 4. растворяются в воде.
10. Гидроксиды алюминия, хрома(III) и цинка имеют общие свойства:
1. не растворимы в кислотах; 2. растворимы в щелочах и кислотах;
3. растворимы в воде; 4. не растворимы в растворе щелочи.
11. С помощью каких реактивов можно отделить катионы четвертой анали- тической группы по кислотно-основной классификации?
1. раствора хлороводородной кислоты; 2. раствора серной кислоты;
3. раствора щелочи в присутствии пероксида водорода; 4. раствора аммиака.
12. Какими общими свойствами обладают катионы первой аналитической группы?
1. образуют хлориды, нерастворимые в воде;
2. образуют сульфаты, нерастворимые в воде; 3. образуют аммиачные комплексы;
4. хлориды, сульфаты, нитраты калия, натрия, лития, аммония хорошо
растворимы в воде.
13. Какими общими свойствами обладают катионы бария, кальция, стронция:
1. хлориды не растворимы в воде; 2. сульфаты малорастворимы в воде;
3. нитраты не растворимы в воде; 4. ацетаты не растворимы в воде.
14. Какой из перечисленных реагентов применяется для отделения катионов третьей аналитической группы по кислотно-основной классификации:
1. 2 М раствор соляной кислоты; 2. 2 М раствор серной кислоты;
3. 2 М раствор щелочи; 4. 2 М раствор аммиака.
15. Какой из перечисленных ниже реактивов можно использовать для отде- ления катионов пятой группы?
1. 2 М раствор серной кислоты; 2. 2 М раствор соляной кислоты;
3. 2 М раствор азотной кислоты; 4. 2 М раствор аммиака.
16. Какими общими свойствами обладают гидроксиды кобальта(II), никеля(II), меди(II), кадмия и ртути(II)?
1. растворимы в избытке щелочи;
2. нерастворимы в концентрированном растворе аммиака;
3. растворимы в воде;
4. растворимы в концентрированном растворе аммиака с образованием
комплексов.
17. Какой из перечисленных реактивов применяется для отделения катионов шестой аналитической группы?
1. 2 М раствор соляной кислоты; 2. 2 М раствор серной кислоты;
3. 2 М раствор азотной кислоты; 4. концентрированный раствор аммиака.
18. Реакцию обнаружения катионов калия с гексанитрокобальтатом(III) натрия проводят:
1. в щелочной среде; 2. в нейтральной среде;
3. в сильнокислой среде; 4. нет верного ответа.
19. Гидротартрат натрия применяется для обнаружения катионов:
1. калия; 2. бария; 3. никеля(II); 4. свинца.
20. Реактив Несслера применяется для обнаружения катионов:
1. цинка; 2. бария; 3. аммония; 4. свинца.
21. Окрашенный осадок хромата серебра образуется:
1. в щелочной среде; 2. в сильнокислой среде; 3. в нейтральной среде; 4. нет верного ответа.
22. Реакция «серебряного зеркала» - это реакция катионов серебра:
1. с формальдегидом; 2. тиоцианатом калия;
3. с гексацианоферратом(II) калия; 4. нет верного ответа.
23. Катионы ртути(I) образуют осадки:
1. с хлорид-ионами; 2. с хромат-ионами;
3. с ацетат-ионами; 4. нет верного ответа.
24. Диметилглиоксим (диметилдиоксим, реактив Чугаева) используется при обнаружении катионов:
1. бария; 2. никеля(II); 3. хрома(III); 4. висмута(III).
25. Гексацианоферрат(II) калия применяется для обнаружения катионов:
1. лития; 2. цинка; 3. меди(II); 4. магния.
26. Катионы кадмия с сульфид-ионами образуют осадок:
1. белого цвета; 2. желтого цвета; 3. черного цвета; 4. нет верного ответа.
27. Дитизон применяется для обнаружения катионов:
1. цинка; 2. натрия; 3. бария; 4. аммония.
28. Висмутат натрия применяется для качественного обнаружения катионов:
1. лития; 2. марганца(II); 3. цинка; 4. бария.
29. Персульфат аммония применяется для качественного обнаружения катионов:
1. лития; 2. марганца(II); 3. хрома(III); 4. бария.
30. Тиоцианат аммония применяется для обнаружения катионов:
1. натрия; 2. железа(III); 3. кобальта(II); 4. марганца(II).
31. Родизонат натрия используется для обнаружения катионов:
1. калия; 2. бария; 3. аммония; 4. лития.
32. Раствор аммиака является групповым реактивом на катионы:
1. бария, стронция, лития; 2. серебра, ртути(I), свинца; 3. меди(II), кадмия, никеля, ртути(II), кобальта(II); 4. кадмия, бария, свинца, стронция.
33. Групповым реагентом на катионы натрия, калия, лития, аммония является:
1. дитизон; 2. винная кислота; 3. уротропин; 4. нет группового реагента.
34. К групповым реагентам относятся:
1. хлороводородная кислота; 2. серная кислота; 3. диметилглиоксим; 4. хромат калия.
35. Амфотерные свойства проявляют осадки гидроксидов:
1. цинка; 2. хрома(III); 3. никеля(II); 4. висмута.
36. Тиомочевина применяется для обнаружения катионов:
1. бария; 2. висмута; 3. цинка; 4. магния
37. 8-гидроксихинолин применяют для обнаружения катионов:
1. калия и аммония; 2. магния и висмута(III); 3. никеля(II) и железа(III); 4. бария и кальция.
38. Ионы ртути(II) восстанавливаются до металлической ртути на пластинкеиз:
1. меди; 2. золота; 3. серебра; 4. нет верного ответа.
39. Сульфид натрия (сероводород) не взаимодействует с катионами:
1. ртути(II); 2. сурьмы(III); 3. железа(II); 4. нет верного ответа.
40. Ализарин применяется для качественного обнаружения катионов:
1. кальция; 2. алюминия; 3. лития; 4. стронция.
41. Окисление катионов хрома(III) до хромат-ионов и дихромат-ионов про-
водят с применением:
1. гидроксиламина; 2. пероксида водорода; 3. сульфата аммония; 4. раствора иода.
42. Появление желтой окраски раствора при обработке его избытком NaOH и
H2O2 указывает на наличие в анализируемом растворе катионов:
1. алюминия; 2. хрома(III); 3. цинка; 4. нет верного ответа.
43. В избытке щелочи растворяются гидроксиды:
1. цинка; 2. кобальта; 3. магния; 4. ртути(II).
44. Бесцветные комплексы с раствором аммиака образуют катионы:
1. цинка; 2. кадмия; 3. никеля(II); 4. кобальта(II).
45. Гидроксид алюминия растворяется:
1. в избытке щелочи; 2. в избытке раствора аммиака; 3. в кислотах; 4. нет верного ответа.
46. С родизонатом натрия не образуют окрашенные осадки катионы:
1. бария; 2. стронция; 3. кальция; 4. калия.
47. Для растворения сульфатов бария и стронция осадок растворяют в:
1. растворе гидроксида натрия; 2. растворе азотной кислоты;
3. растворе уксусной кислоты; 4. нет верного ответа.
48. При взаимодействии группового реагента (кислотно-основная классифи-
кация) с катионами третьей аналитической группы в осадок выпадают:
1. фториды; 2. сульфаты; 3. карбонаты; 4. фосфаты.
49. Катионы кальция, бария и натрия относятся к катионам:
1. второй аналитической группы катионов; 2. третьей аналитической группы катионов;
3. шестой группы катионов; 4. нет верного ответа.
50. Оксалат аммония образует белый кристаллический осадок с катионами:
1. натрия; 2. кальция; 3. калия; 4. лития.
51. Гексацианоферрат(II) калия образует белый кристаллический осадок с катионами:
1. кальция; 2. натрия; 3. лития; 4. нет верного ответа.
52. Продуктом аналитической реакции катионов кадмия с гидроксидом на-
трия является:
1. желтый осадок; 2. белый осадок; 3. зеленый осадок; 4. голубой осадок.
53. Гидроксиды катионов шестой аналитической группы (кислотно-основная
классификация) растворяются в избытке:
1. гидроксида натрия; 2. аммиака; 3. хлорида натрия; 4. нет верного ответа.
54. Для качественного обнаружения катионов магния применяют:
1. дитизон; 2. гидрофосфат натрия; 3. пероксид водорода; 4. реактив Несслера.
55. Висмут(III) с иодидом калия образует:
1. осадок; 2. внутрикомплексное соединение;
3. соединение, имеющее фиолетовую окраску; 4. нет верного ответа.
56. Для окисления катионов марганца(II) используют:
1. висмутат натрия; 2. раствор иода; 3. хлорную воду; 4. нет верного ответа.
57. Осадок «берлинской лазури» образуется при взаимодействии катионов железа(III):
1. с гексацианоферратом(II) калия; 2. с гексацианоферратом(III) калия;
3. с тиоцианатом калия; 4. нет верного ответа.
58. Окислительно-восстановительные реакции используют для обнаружения катионов:
1. марганца(II); 2. магния; 3. кадмия; 4. бария.
59. В разбавленных минеральных кислотах (H2 SO 4, HCl) не растворяются сульфиды следующих катионов:
1. марганца(II); 2. висмута(III); 3. железа(II); 4. железа(III).
60. Бесцветные аммиачные комплексы образуют катионы:
1. меди(II); 2. кадмия(II); 3. кобальта(II); 4. никеля(II).
61. Сульфид ртути(II) растворяется:
1. в растворе щелочи; 2. в конц. серной кислоте;
3. в «царской водке»; 4. в конц. хлороводородной кислоте.
62. С иодид-ионами образуют окрашенные осадки катионы:
1. ртути(II); 2. натрия; 3. калия; 4. бария.
63. Обнаружение борат-ионов проводят:
1. по реакции с дифениламином; 2. по реакции образования сложных эфиров;
3. с реактивом Несслера; 4. нет верного ответа.
64. Для обнаружения фосфат-ионов применяется:
1. реактив Несслера; 2. хлорид натрия; 3. молибдат аммония; 4. нет верного ответа.
65. Сульфит бария растворяется:
1. в разбавленной серной кислоте;
2. в разбавленной хлороводородной кислоте с выделением оксида серы(IV);
3. в растворе хлорида натрия; 4. нет верного ответа.
66. Оксид серы(IV), выделяющийся при разложении сульфитов, обнаруживают:
1. методом К. Фишера; 2. по обесцвечиванию водного раствора иода;
3. с применением иодид-крахмальной бумаги; 4. нет верного ответа.
Критерии оценки: 3.1. Формы и методы оценивания
Эталон ответа:
| № вопроса | Вариант ответа | № вопроса | Вариант ответа |
| 1 | 4 | 34 | 1 2 |
| 2 | 4 | 35 | 1 2 |
| 3 | 1 3 | 36 | 2 |
| 4 | 1 | 37 | 2 |
| 5 | 2 | 38 | 1 |
| 6 | 2 | 39 | 4 |
| 7 | 3 | 40 | 2 |
| 8 | 1 | 41 | 2 |
| 9 | 1 | 42 | 2 |
| 10 | 2 | 43 | 1 |
| 11 | 3 | 44 | 1 2 |
| 12 | 4 | 45 | 1 3 |
| 13 | 2 | 46 | 4 |
| 14 | 2 | 47 | 4 |
| 15 | 4 | 48 | 2 |
| 16 | 4 | 49 | 4 |
| 17 | 4 | 50 | 2 |
| 18 | 2 | 51 | 1 |
| 19 | 1 | 52 | 4 |
| 20 | 3 | 53 | 2 |
| 21 | 3 | 54 | 2 |
| 22 | 1 | 55 | 1 |
| 23 | 1 2 | 56 | 1 |
| 24 | 2 | 57 | 1 |
| 25 | 2 3 | 58 | 1 |
| 26 | 2 | 59 | 2 |
| 27 | 1 | 60 | 2 |
| 28 | 2 | 61 | 3 |
| 29 | 2 3 | 62 | 1 |
| 30 | 2 3 | 63 | 2 |
| 31 | 2 | 64 | 3 |
| 32 | 3 | 65 | 2 |
| 33 | 4 | 66 | 2 |
Тема 2.5. Анионы I- III аналитических групп.
Выполнение практических заданий:
1. Обнаружение сульфат-иона.
2. Обнаружение карбонат-иона. 3. Обнаружение фосфат-иона.
4. Обнаружение хлорид-иона.
5. Обнаружение иодид - иона и бромид - иона в одной пробирке.
6. Обнаружение нитрат-иона.
7. Анализ смеси анионов в исследуемом растворе.
Критерии оценки: 3.1. Формы и методы оценивания
Эталон ответа:
1. Обнаружение сульфат-иона.
Хлорид бария BaCl2 в нейтральной или слабощелочной среде осаждает анионы 1-й группы в виде труднорастворимых солей бария:
SO42- + Ba2+ → BaSO4↓
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
белый
CO32- + Ba2+ → BaCO3↓
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
белый
HPO42- + Ba2+ → BaHPO4↓
Na2HPO4 + BaCl2 → BaHPO4↓ + 2NaCl
белый
В присутствии щелочей или NH4OH, переводящих ион HPO42- в PO43-, получается средняя соль:
2Na2HPO4 + 2NH4OH + 3BaCl2 → Ba3(PO4)2↓ + 4NaCl + 2NH4Cl + 2H2O
Осадки BaCO3, BaHPO4, Ba3(PO4)2 растворяются в HCl, а осадок BaSO4 не растворяется. На этом основано обнаружение SO42- в присутствии CO32-, PO43-.
2. Обнаружение карбонат-иона.
Кислоты (HCl, H2SO4) разлагают карбонаты с выделением оксида углерода (IV):
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
3. Обнаружение фосфат-иона.
Магнезиальная смесь (MgCl2 + NH4OH + NH4Cl) выделяет из растворов гидрофосфата натрия и фосфата натрия белый кристаллический осадок фосфата магния – аммония:
Na2HPO4 + MgCl2 + NH4OH → MgNH4PO4↓ + 2NaCl + H2O
HPO42- + Mg2+ + NH4OH → MgNH4PO4↓ + H2O
4. Обнаружение хлорид-иона.
Нитрат серебра образует с анионами 2-й группы галогениды серебра, которые не растворимы в воде и разбавленной азотной кислоте:
Cl- + Ag+ → AgCl↓
белый творожистый осадок
NaCl + AgNO3 → AgCl↓ + NaNO3
Br- + Ag+ → AgBr↓
желтоватый осадок
NaBr + AgNO3 → AgBr↓ + NaNO3
J- + Ag+ → AgJ↓
бледно-желтый творожистый осадок
NaJ + AgNO3 → AgJ↓ + NaNO3
При добавлении к осадку анионов 2-ой группы NH4OH (реактив для растворения AgCl) осадок AgCl растворяется с образованием хлорида диаммин–серебра (I).
AgCl + 2NH4OH → [Ag(NH3)2]Cl + H2O
Осадки AgJ, AgBr не растворяются, но AgBr растворяется в избытке NH4OH.
К раствору (центрифугату), содержащему Cl- прибавляют HNO3, комплексный ион [Ag(NH3)2]+ разрушается в результате образования более прочного катиона NH4+ и хлорид серебра снова выпадает в осадок:
[Ag(NH3)2]Cl + 2HNO3 → AgCl↓ + 2NH4NO3
5. Обнаружение иодид - иона и бромид - иона в одной пробирке.
При одновременном присутствии J- и Br- хлорная вода сначала окисляет J- с образованием свободного йода:
2KJ + Cl2 → 2KCl + J2
2J- + Cl2 → 2Cl- + J2
J2 трудно растворим в воде, но хорошо растворим в бензоле (C6H6), четыреххлористом углероде (CCl4). При этом органический растворитель окрашивается в фиолетовый цвет.
Реакцию проводят в растворе, подкисленном 2Н. серной кислотой, т.к. в щелочной среде окраска йода обесцвечивается.
При дальнейшем прибавлении к исследуемому раствору хлорной воды, ее избыток окисляет получившийся йод до иодноватой кислоты:
J2 + 5Cl2 + 6H2O → 2HJO3 + 10HCl
Фиолетовая окраска органического растворителя в результате этого процесса обесцвечивается.
После этого хлорная вода содержится в необходимом количестве для окисления Br- с выделением свободного брома, окрашивающего слой органического растворителя в красновато-бурый цвет:
2NaBr + Cl2 → 2NaCl + Br2
2Br- + Cl2 → 2Cl- + Br2
Анализ смеси анионов в исследуемом растворе
| № операции |
операции |
|
операции |
|
|
|
|
|
|
|
2-3К. задачи + 3-4К. BaCl2. Образование белого осадка укажет на присутствие 1-й группы анионов. К осадку с раствором прилить 2-3К. HCl, если осадок не растворяется, то в растворе присутствует SO42-.
|
|
|
|
|
|
|
|
5К. задачи + 5К. 2Н. HCl, выделение пузырьков CO2укажет на присутствие CO32-
|
|
|
|
|
|
|
|
2-3К. задачи + 3-4К. магнезиальной смеси. Образование белого осадка укажет на присутствие PO43-
|
|
|
|
|
|
|
|
5К. задачи + 1К. HNO3 + 5К. AgNO3. Образование осадка укажет на присутствие анионов 2-ой группы. Осадок отцентрифугировать, центрифугат перенести в другую пробирку (он не нужен). Осадок промыть 2 раза водой и растворить в 5 К. реактива для растворения AgCl. Анион Cl- перейдет в раствор, отцентрифугировать. Центрифугат перенести в другую пробирку и добавить 3-5 к. 2Н.HNO3. Появление мути укажет на присутствие Cl-.
|
|
|
|
|
|
|
|
2К. задачи + 1К. H2SO4 + 5К. CCl4 + 3-4К. хлорной воды, хорошо встряхнуть. Фиолетовое окрашивание CCl4укажет на присутствие J-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Раздел 3 Количественный анализ
Тема 3.1.Титриметрические методы анализа
Собеседование по вопросам:
1. Перечислите виды мерной химической посуды, используемой в титриметрическом анализе.
2. Сформулируйте закон, который лежит в основе расчетов в титриметрическом анализе. Напишите его математическое выражение.
3. Перечислите основные способы выражения концентрации растворов, применяемые в титриметрическом анализе.
4. Дайте определения понятий: «титрование», «титрант», «аликвотная доля», «точка эквивалентности», «конечная точка титрования».
5. Какие требования предъявляются к химическим реакциям, применяемым в титриметрическом анализе?
6. Перечислите требования, предъявляемые к стандартным веществам.
7. Какие растворы называются стандартными? Что такое стандартизация раствора?
8. Что такое интервал перехода окраски индикатора, показатель титрования рТ? Для чего используют индикаторы при титровании?
9. Какие вещества можно определять методом кислотно-основного титрования? Что такое ацидиметрия и алкалиметрия?
10. Какие титранты применяют в методе кислотно-основного титрования?
11. Назовите основные стандартные вещества метода кислотноосновного титрования и напишите их формулы. Чем объясняется щелочная реакция раствора натрия тетрабората?
12. Назовите наиболее часто применяемые индикаторы метода кислотно-основного титрования. Укажите интервалы перехода окраски и рТ для этих индикаторов.
13. В чем состоит сущность методики стандартизации раствора хлороводородной кислоты по натрия тетраборату? Напишите соответствующие уравнения реакций.
14. Дайте определение понятиям: «кривая титрования», «скачок титрования».
15. От каких факторов зависит интервал скачка титрования?
16. В каком интервале значений рН лежат скачки титрования при титровании сильного основания сильной кислотой, слабого основания сильной кислотой и слабой кислоты сильным основанием, если молярные концентрации эквивалента используемых растворов равны по 0,1 моль/л?
17. Почему при титровании слабого основания сильной кислотой (и наоборот) точка эквивалентности и точка нейтральности не совпадают?
18. По каким формулам рассчитывают рН растворов сильных и слабых кислот и оснований?
19. По каким формулам рассчитывают рН растворов средних и кислых солей, слабых одно- и двухосновных кислот?
20. Перечислите виды индикаторных ошибок.
21. В чем состоит сущность методики определения массы щелочи в растворе методом кислотно-основного титрования?
22. В чем состоит сущность методики определения массы щелочи и карбонатов в растворе при совместном присутствии?
23. Напишите в ионной форме уравнения реакций, протекающих при титровании натрия карбоната хлороводородной кислотой с индикаторами фенолфталеином и метиловым оранжевым.
Критерии оценки: 3.1. Формы и методы оценивания
Тема 3.2. Методы кислотно-основного титрования
Проверочная работа
Письменно ответить на вопросы:
1. Сущность и классификация методов кислотно-основного титрования
2. Титрование сильной кислоты сильной щелочью и наоборот.
3. Титрование слабой кислоты сильной щелочью.
4. Титрование слабого основания сильной кислотой
5. Индикаторы в кислотно-основном титровании
Критерии оценки: 3.1. Формы и методы оценивания
Эталон ответа:
1.Сущность и классификация методов кислотно-основного титрования
В основе кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами:
Н+ + ОН- = Н2О, Н3О+ + ОН- = 2Н2О
При помощи этого метода определяют кислоты, основания, соли, способных гидролизоваться в водных растворах, а также их смеси, азот, серу в органических соединениях, некоторые органические соединения (формальдегид, спирты и др.).
В качестве титрантов в кислотно-основном титровании применяют в основном растворы сильных кислот (НС1, Н2SО4) и сильных оснований (КОН, NaOH).
В зависимости от природы титранта кислотно-основное титрование включает два основных метода: ацидиметрия и алкалиметрия. В ацидиметрии титрантом служит раствор кислоты, а применяют ее для определения различных оснований. В алкалиметрии титрант - раствор щелочи, а применяется для определения кислот,
Титранты кислотно-основного титрования относятся к титрантам второго типа - стандартизированные или с установленным титром (см.3.3). В качестве исходных веществ для установления титра рабочих растворов кислот используют тетраборат натрия (Na2B4O7*10H2O) или карбонат натрия безводный (Na2CO3), а для установления титра растворов щелочей – щавелевую (Н2С2О4*2Н2О) или янтарную (Н2С4Н4О4) кислоту.
Кислотно-основное титрование не сопровождается внешним эффектом, а лишь изменением рН. Реакция среды в точке эквивалентности определяется природой взаимодействующих кислот и оснований.
В кислотно-основном методе титрования различают три случая титрования:
Титрование сильной кислоты сильной щелочью и наоборот:
НСl + NaOH = NaCl + H2O; H+ + OH- = H2O
Точка эквивалентности находится в нейтральной среде (рН=7), т.к. образующаяся соль не подвергается гидролизу.
Титрование слабой кислоты сильной щелочью:
СН3СООН + NaOH = CH 3COONa + H2O
В ионном виде: СН3COOH + OH- = CH3COO- + H2O
В точке эквивалентности образуется соль слабой кислотой и сильного основания, которая вступает в реакцию гидролиза:
СH3COONa + HOH ↔ CH3COOH + NaOH
В ионном виде: СН3СОО- + НОН ↔ СН3СООН + ОН-
В растворе накапливаются ионы ОН- и точка эквивалентности будет находиться в щелочной среде (рН 7 ), не совпадая с точкой нейтральности.
Титрование слабого основания сильной кислотой:
NH4OH + HCl = NH4Cl + H2O
В ионном виде: NH4OH + H+ = NH4+ + H2O
Образующаяся соль слабого основания и сильной кислоты (NH4Cl) подвергается гидролизу, и в растворе накапливаются ионы Н+, что вызывает смещение точки эквивалентности в кислую среду. Следовательно, и в третьем случае точка эквивалентности не совпадает с точкой нейтральности.
Поскольку кислотно-основное титрование не сопровождается внешним эффектом, например, изменением окраски, для фиксирования точки эквивалентности применяют индикаторы.
Индикаторы в кислотно-основном титровании
титрование осадительный тицианометрия индикатор
Индикаторы кислотно-основного титрования представляют собой слабые органические кислоты и основания, у которых молекулярная и ионная формы отличаются окраской. В процессе диссоциации эти две формы находятся в равновесии. Изменение рН в кислотно-основном титровании нарушает равновесие процесса диссоциации индикатора, что вызывает накопление в растворе одной из форм индикатора, окраску которой можно визуально наблюдать.
Окраска некоторых индикаторов
| Индикатор | Окраска недиссоциированных молекул | Окраска анионов |
| Метиловый оранжевый | красная | желтая |
| Метиловый Красный | красная | желтая |
| Фенолфталеин | бесцветная | малиновая |
| Лакмус | красная | синяя |
Для каждого индикатора есть свой интервал значений рН, в пределах которого индикатор изменяет свою окраску. Этот интервал называется областью перехода окраски индикатора. Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение рН, лежащее внутри области перехода, которое называют показателем титрования этого индикатора.
Важнейшие индикаторы имеют следующие области перехода и показатели титрования:
Область перехода Показатель титрования (рТ) рН рТ
Метиловый оранжевый 3,1 – 4,4 4,0
Метиловый красный 4,4 – 6,2 5,5
Лакмус 5,0 – 8,0 7,0
Фенолфталеин 8,0 – 10,0 9,0
Для правильного выбора индикатора в различных случаях титрования необходимо знать предел скачка рН на кривой титрования. Для каждого случая титрования пригодны только те индикаторы, показатели титрования которых входят в пределы скачка рН на кривой.
Предел скачка рН для случая титрования сильной кислоты сильной щелочью составляет 4 – 10. Так как рТ всех индикаторов входят в предел скачка рН, фиксирование точки эквивалентности для данного случая титрования возможно всеми вышеперечисленными индикаторами.
Предел скачка рН для случая титрования слабой кислоты сильным основанием составляет 8 – 10. В этот предел скачка рН входит только рТ индикатора фенолфталеина. Для данного случая титрования точку эквивалентности можно зафиксировать только с фенолфталеином.
Предел скачка рН для случая титрования слабого основания сильной кислотой составляет 4 – 6,2. В этот предел скачка рН входят рТ метилового оранжевого и метилового красного с помощью которых можно точно зафиксировать точку эквивалентности для данного случая титрования.
Тема 3.3. Методы окислительно-восстановительного титрования.
Выполнение тестовых заданий
I. Из следующих за утверждением ответов выберите один правильный.
1. Фактор эквивалентности титранта при йодометрическом титровании равен:
а) 1/6;
б) 1/5;
в) 1/2;
г) 1/4;
д) 1.
Ответ: д.
2. Для определения КТТ при перманганатометрическом определении ионов железа(III) титрование проводят:
а) в присутствии индикатора метилового оранжевого;
б) в присутствии индикатора крахмала;
в) без индикатора;
г) в присутствии индикатора тропеолина 00;
д) в присутствии индикатора дифениламина. Ответ: в.
3. Титриметрический фактор пересчета 0,050 моль/л раствора калия перманганата по железу равен:
а) 1,8 • 10-3 г/мл;
б) 2,8 • 10-3 г/мл;
в) 5,6 • 10-3 г/мл;
г) 6,4 • 10-3 г/мл;
д) 5,6 • 10-4 г/мл. Ответ: б.
4. Окраска индикатора метилового оранжевого при броматометрическом определении мышьяка(III) меняется в КТТ:
а) из бесцветной в желтую;
б) из желтой в бесцветную;
в) из розовой в желтую;
г) из желтой в розовую;
д) из розовой в бесцветную. Ответ: д.
II. Задание на установление соответствия
Инструкция. Установите соответствие. Каждый ответ может быть использован один раз, несколько раз или не использован совсем.
Задание. Подберите каждому методу окислительно-восстановительного титрования соответствующий титрант.
Ответы: 5 - б, 6 - а, 7 - г, 8 - в.
Задание. Подберите каждому веществу метод количественного определения. Напишите в ионном виде уравнение реакции, протекающее при количественном определении натрия тиосульфата.
Ответы: 9 - а, 10 - б, 11 - г, 12 - г.
III. Задания с выбором одного или нескольких правильных ответов
Инструкция. Для каждого незаконченного утверждения один или несколько ответов являются правильными. Выберите номера правильных ответов.
13. При использовании в окислительно-восстановительном титровании следующие индикаторы являются необратимыми:
а) метиловый оранжевый;
б) ферроин;
в) метиловый красный;
г) фенилантраниловая кислота. Ответ: а, в.
14. Величина скачка при окислительно-восстановительном титровании зависит:
а) от природы реагирующих веществ;
б) концентрации реагирующих веществ;
в) рН титруемого раствора;
г) температуры. Ответ: а, б, в, г.
15. Укажите вещества, которые можно количественно определить перманганатометрическим титрованием:
а) натрия оксалат;
б) калия бромид;
в) водорода пероксид;
г) новокаин.
Напишите соответствующие уравнения реакций в ионном виде. Ответ: а, в.
16. Укажите стандартные вещества или титрованные растворы, используемые для стандартизации титранта в методе нитритометрического титрования:
а) калия бромат;
б) сульфаниловая кислота;
в) натрия оксалат;
г) раствор калия перманганата. Ответ: б, г.
IV. Тестовые пункты на определение причинно-следственных взаимосвязей
Инструкция. Вопрос состоит из двух утверждений, соединенных союзом «потому что». Проверьте, верно или неверно каждое утверждение в отдельности, а затем связь между ними. Для выбора ответов используйте приведенную ниже схему.
17. При броматометрическом титровании в качестве индикатора применяется метиловый оранжевый, потому что его окраска зависит от рН раствора.
Ответ: б.
18. Для создания кислой среды при перманганатометрическом титровании в титруемый раствор добавляют азотную кислоту, потому что с ростом кислотности среды окислительные свойства перманганат-ионов увеличиваются.
Ответ: г.
19. При йодиметрическом определении в титруемый раствор добавляют натрия гидрокарбонат для создания слабощелочной среды, потому что в кислой среде йод диспропорционирует.
Ответ: в.
Критерии оценки: 3.1. Формы и методы оценивания
Тема 3.4. Методы осаждения.
Собеседование по вопросам:
1. Сущность и классификация методов осадительного титрования
2. Способы обнаружения конечной точки титрования
3. Метод Мора
4. Метод Фольгарда.
5. Метод Фаянса
6. Аргенометрия
7. Тицианометрия
Критерии оценки: 3.1. Формы и методы оценивания
Эталон ответа:
Сущность и классификация методов осадительного титрования
Метод объединяет титриметрические определения, основанные на реакциях образования осадков малорастворимых соединений. В этих целях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался.
Наименования отдельных методов осаждения происходят от названий применяемых титрантов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Этим методом определяют содержание ионов С1- и Вг- в нейтральных или слабощелочных средах.
Тиоцианатометрия основана на применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и служит для определения следов Сl- и Br-, но уже в сильнощелочных и кислых растворах. Используют ее и для определения содержания серебра в рудах или сплавах.
Дорогостоящий аргентометрический метод определения галогенов постепенно вытесняется меркурометрическим. В последнем используют раствор нитрата ртути (I) Hg2 (NO3)2
Рассмотрим более подробно аргентометрическое и тиоцианатомет-рическое титрование.
Способы обнаружения конечной точки титрования
Метод Мора
Индикатором служит хромат-ион, который образует красно-кирпичный осадок Ag2CrO4, более растворимый, чем галогениды серебра(S (Ag2CrO4,) = 3√ Ks/4 = 6,5*10-5M , S (AgBr) = √ Ks = 7,2*10-7M) При титровании хромат серебра не образуется, пока не будет оттитрован галогенид-ион. Важно правильно выбрать концентрацию хромат-ионов. Если она будет очень мала, потребуется слишком большой избыток ионов серебра для образования заметного визуально осадка. При слишком большой концентрации СrO42- образование осадка начинается раньше, чем оттитруется галогенид-ион. В пределах погрешности титрования ±0,1% концентрацию СrО2,- можно изменять от 0,35 М до 1,1*10-4 М (при c Cl- =0,1М). На практике обычно создают концентрацию CrO42-, равную 0,01 - 0,005 М.
Титрование по методу Мора следует проводить в слабокислой среде. В кислой среде необходимо учитывать протолитическую реакцию
CrO42- + H+ ↔ HCrO4- и 2HCrO4- ↔ Cr2O72- + H2O
В щелочной среде следует иметь в виду возможность протекания реакций
Ag+ + OH- = AgOH↓
2AgOH = Ag2O↓ + H2O
Метод Мора непригоден для определения иодид- и тиоцианат-ионов.
Метод Фольгарда.
Метод основан на титровании раствора ионов Ag+ раствором KSCN в присутствии ионов Fe (III):
Ag+ + SCN - = AgSCN↓
Fe3+ + nSCN - = Fe(SCN)n(3 – n)+
После оттитровывания ионов Ag избыток титранта дает с ионами Fe3+ красный комплекс. Обычно создают концентрацию Fe3+ около 0,01М. Титрование проводят в кислой среде.
Для определения анионов этим методом (СI -, Вr -, CN-, СО32- , СrО42, S2-, РО43-) используют обратное титрование. К раствору титруемого иона добавляют избыток стандартного раствора нитрата серебра. После образования осадка оттитровывают избыток стандартным раствором KSCN в присутствии раствора хлорида железа (III). При образовании осадков, менее растворимых, чем AgSCN, возможно непосредственное титрование избытка Ag+ над осадком, но при определении Сl- более растворимый AgCl может частично перейти в AgSCN, поэтому необходимо отделить его (фильтрованием или добавлением тяжелого органического растворителя, покрывающего осадок и предохраняющего его от контакта с раствором).
Метод Фаянса (титрование с адсорбционными индикаторами).
В процессе титрования поверхность осадка имеет некоторый заряд. Например, при титровании галогенид-ионов раствором нитрата серебра осадок AgCl до ТЭ заряжен отрицательно вследствие адсорбции собственных Сl- -ионов. После ТЭ осадок перезаряжается и становится положительно заряженным из-за адсорбции Ag+-ионов. Если в растворе присутствуют ионы красителя, имеющие определенный заряд, то они могут служить противоионами и придавать осадку окраску. Например, флуоресцеин - слабая органическая кислота желто-зеленого цвета, диссоциирует с образованием аниона, который адсорбируется на положительно заряженном осадке AgCl после ТЭ. При адсорбции окраска красителя изменяется на розовую (возможно, из-за образования малорастворимого комплекса с ионами серебра).
При титровании с адсорбционными индикаторами существенно значение рН, поскольку должна доминировать ионная форма индикатора. Поэтому при титровании в более кислой среде следует использовать краситель с более сильными кислотными свойствами, например дихлор-флуоресцеин вместо флуоресцеина.
Необходимым условием применения адсорбционного индикатора является его способность служить противоионом, но не вытеснять первично-адсорбированный ион осадка.
Аргенометрия
Метод основан на реакции осаждения ионов Сl- и Вr- катионами серебра с образованием малорастворимых галогенидов:
Сl - + Ag+ = AgCl↓, Br- + Ag+ = AgBr↓
При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия).
Для понимания процесса аргентометрического титрования большое значение имеют кривые титрования. Интервал скачка при аргентометрическом титровании зависит от концентрации растворов и от произведения растворимости осадка. Чем меньше величина ПР получающегося в результате титрования соединения, тем шире интервал скачка на кривой титрования и тем легче фиксировать конечную точку титрования с помощью индикатора.
Наиболее распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хроматом калия до побурения белого осадка
Возможности применения аргентометрии довольно ограничены. Ее используют только при титровании нейтральных или слабощелочных растворов (рН от 7 до 10). Анализируемый раствор не должен содержать Ва2+, Sr2+, Pb2+, Bi3+ и других ионов, дающих осадки с хроматом калия. Тем не менее аргентометрия удобна при анализе бесцветных растворов, содержащих Сl- и Вr- - ионы.
Тицианометрия
Тиоцианатометрическое титрование основано на осаждении ионов Ag+ (или Hg22+) тиоцианатами:
Ag* + SCN- = AgSCN↓
Определяют Ag+ или Hg22+ прямым титрованием раствором тиоцианата NH4SCN или KSCN.
Тиоцианатометрическое определение галогенов выполняют по методу Фолыарда. Суть его можно выразить схемами:
Сl - + Ag+ = AgCl+Ag +(остаток); Ag+(ocтаток)+SCN- = AgSCN↓
Иначе говоря, к жидкости, содержащей Сl-, приливают избыток титрованного раствора нитрата серебра. Затем остаток AgNO3 обратно оттитровывают раствором тиоцианата и вычисляют результат.
Индикатор в методе Фольгарда - насыщенный раствор железоаммонийных квасцов NH4Fe (SO4)2*12H2O. Пока в титруемой жидкости имеются ионы Ag+ прибавляемые анионы SCN- связываются с выделением осадка AgSCN, но не взаимодействуют с ионами Fe3+. Однако после точки эквивалентности малейший избыток NH4SCN (или KSCN) вызывает образование кроваво-красных ионов [Fe(SCN)]2+ и [Fe(SCN)2]+. Вследствие этого удается определить эквивалентную точку.
Тиоцианатометрические определения применяют чаще, чем арген-тометрические. Присутствие кислот не мешает титрованию по методу Фольгарда и даже способствует получению более точных результатов, так как кислая среда подавляет гидролиз соли Fe3+. Метод позволяет определять ион С1- не только в щелочах, но и в кислотах. Определению не мешает присутствие Ва2+, Pb2+, Bi3+ и некоторых других ионов. Однако если в анализируемом растворе имеются окислители или соли ртути, то применение метода Фольгарда становится невозможным: окислители разрушают ион SCN-, а катион ртути осаждает его.
Щелочной исследуемый раствор нейтрализуют перед титрованием азотной кислотой, иначе ионы Fe3+, входящие в состав индикатора, дадут осадок гидроксида железа(III).
Тема 3.5. Метод комплексонометрии.
Вопросы для самопроверки
1. Перечислите требования, предъявляемые к реакциям комплексообразования в титриметрическом анализе.
2. Какие органические вещества называются комплексонами? Перечислите наиболее известные комплексоны.
3. Дайте химическое название ЭДТА и напишите схематически структурную формулу этого соединения.
4. Напишите в общем виде уравнения реакций взаимодействия ЭДТА с двух- и трехзарядными катионами металлов.
5. Какие органические вещества используют в качестве индикаторов в методе комплексонометрического титрования? Каков принцип их действия?
6. Перечислите требования, предъявляемые к металлохромным индикаторам метода.
7. В каком случае при проведении комплексонометрического титрования используют метод обратного титрования?
8. Какие реакции лежат в основе прямого и обратного методов комплексонометрического определения катионов металлов в растворе?
9. Катионы каких металлов можно определить методом комплексонометрического титрования?
Критерии оценки: 3.1. Формы и методы оценивания
Тема 3.6. Физические и физико-химические методы анализа
Творческое задание, подготовка презентаций по темам:
1.Физзико-фимические методы анализа
2. Количественный анализ с применением инструментальных методов
3. Спектральные методы количественного анализа
4. Сущность электрохимических методов анализа
5. Сущность рентгеновских методов анализа
Критерии оценки: 3.1. Формы и методы оценивания
4.3. Задания для промежуточного контроля
4.3.1. Перечень теоретических вопросов промежуточного контроля
4.3.2. Перечень практических заданий промежуточного контроля
(задачи и ситуации)
4.3.3.. Перечень справочной литературы, нормативной документации,
разрешенной к использованию на зачете (дифзачете или экзамене)
1.
2.
3.
4.3.4. Экзаменационные билеты
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федерального государственного автономного образовательного учреждения высшего образования
«КРЫМСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ им. В.И. ВЕРНАДСКОГО»
(ФГАОУ ВО «КФУ им. В.И. Вернадского)
МЕДИЦИНСКИЙ КОЛЛЕДЖ
Рассмотрено на ЦМК УТВЕРЖДАЮ
Клинических дисциплин № 2 Зам. директора по учеб. работе
Председатель ЦМК __________________А.С.Быкова
_____________ И.О.Фамилия « _______» ____________20___г.
«______» ____________20___г.
Дифференцированный зачет (экзамен) по учебной дисциплине
(форма проведения промежуточной аттестации)
Учебная дисциплина _________________________________________________
(код учебной дисциплины, название)
Специальность _____________________________________________________
(код специальности, название)
Билет № ____
Коды проверяемых знаний / умений: З1, З2, …../ У1, У2, …..
________________________________________________________________________
Время выполнения задания _____________________
Теоретическое задание:
Практическое задание:
Преподаватель________________________________________ ФИО
(подпись, расшифровка)
5. Идентификатор изменений в комплекте контрольно-оценочных средств
В связи с _________________________________________________________
______________________________________в комплект контрольно- оценочных средств
(указать причину)
дисциплины _______________________________________________________
для специальности 00.00.00 "Наименование специальности" вносятся следующие изменения:
1)_____________________________________________________________________________________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
2)____________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________
3)____________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________
Рассмотрен и утвержден на заседании ЦМК экономических дисциплин
«___»________________20__г. Протокол №_____
Председатель ЦМК И.О.Фамилия
Примерный перечень форм и оценочных средств
| № п/п | Форма оценки | Процедура | Оценочные средства в фонде |
| 1 | 2 | 3 | 4 |
| 1 | Деловая и/или ролевая игра | Совместная деятельность группы обучающихся и преподавателя под управлением преподавателя с целью решения учебных и профессиональных задач путем игрового моделирования реальной проблемной ситуации. Позволяет оценивать умение анализировать и решать типичные профессиональные задачи. | Тема (проблема), концепция, роли и ожидаемый результат по каждой игре |
| 2 | Кейс-задача | Проблемное задание, в котором обучающемуся предлагают осмыслить реальную профессионально-ориентированную ситуацию, необходимую для решения данной проблемы. | Задания для решения кейс-задачи |
| 3 | Зачет | Средство контроля усвоения учебного материала темы, раздела или разделов дисциплины, организованное как учебное занятие в виде собеседования преподавателя с обучающимся. | Вопросы по темам/разделам дисциплины |
| 4 | Контрольная работа | Средство проверки умений применять полученные знания для решения задач определенного типа по теме или разделу. | Комплект контрольных заданий по вариантам |
| 5 | Круглый стол, дискуссия, полемика, диспут, дебаты | Оценочные средства, позволяющие включить обучающихся в процесс обсуждения спорного вопроса, проблемы и оценить их умение аргументировать собственную точку зрения. | Перечень дискуссионных тем для проведения круглого стола, дискуссии, полемики, диспута, дебатов |
| 6 | Портфолио | Целевая подборка работ студента, раскрывающая его индивидуальные образовательные достижения в одной или нескольких учебных дисциплинах. | Структура портфолио |
| 7 | Проект | Конечный продукт, получаемый в результате планирования и выполнения комплекса учебных и исследовательских заданий. Позволяет оценить умение обучающихся самостоятельно конструировать свои знания в процессе решения практических задач и проблем, ориентироваться в информационном пространстве и уровень сформированности аналитических, исследовательских навыков, навыков практического и творческого мышления. Может выполняться в индивидуальном порядке или группой обучающихся. | Темы групповых и/или индивидуальных проектов |
| 8 | Рабочая тетрадь | Дидактический комплекс предназначенный для самостоятельной работы обучающегося и позволяющий оценивать уровень усвоения им учебного материла. | Образец рабочей тетради |
| 9 | Разноуровневые задачи и задания | Различают задачи и задания: а) ознакомительного - позволяющие диагностировать и оценивать знания фактического материала (базовые понятия, алгоритмы, факты) и умение правильно использовать специальные термины и понятия, узнавание объектов изучения в рамках определенного раздела дисциплины; б) репродуктивного уровня - позволяющие оценивать и диагностировать умения синтезировать, анализировать, обобщать фактический и теоретический материал с формулированием конкретных выводов, установлением причинно-следственных связей; в) продуктивного уровня – позволяющие оценивать и диагностировать умения, интегрировать знания различных областей, аргументировать собственную точку зрения, выполнять проблемные задания. | Комплект разноуровневых задач и заданий |
| 10 | Задания для самостоятельной работы | Средство проверки умений применять полученные знания по заранее определенной методике для решения задач или заданий по модулю или дисциплине в целом. | Комплект заданий |
| 11 | Реферат | Продукт самостоятельной работы студента, представляющий собой краткое изложение в письменном виде полученных результатов теоретического анализа определенной научной (учебно-исследовательской) темы, где автор раскрывает суть исследуемой проблемы, приводит различные точки зрения, а также собственные взгляды на нее. | Темы рефератов |
| 12 | Доклад, сообщение | Продукт самостоятельной работы студента, представляющий собой публичное выступление по представлению полученных результатов решения определенной учебно-практической, учебно-исследовательской или научной темы.
| Темы докладов, сообщений |
| 13 | Собеседование | Средство контроля, организованное как специальная беседа преподавателя с обучающимися на темы, связанные с изучаемой дисциплиной, и рассчитанное на выяснение объема знаний обучающегося по определенному разделу, теме, проблеме и т.п. | Вопросы по темам, разделам дисциплины |
| 14 | Творческое задание | Частично регламентированное задание, имеющее нестандартное решение и позволяющее диагностировать умения, интегрировать знания различных областей, аргументировать собственную точку зрения, Может выполняться в индивидуальном порядке или группой обучающихся. | Темы групповых и/или индивидуальных творческих заданий |
| 15 | Тест | Система стандартизированных заданий, позволяющая автоматизировать процедуру изменений уровня знаний и умений обучающегося. | Фонд тестовых заданий |
| 16 | Тренажер | Техническое средство, которое может быть использовано для контроля приобретенных студентом профессиональных навыков и умений по управлению конкретным материальным объектом. | Комплект заданий для работы а тренажере |
| 17 | Эссе | Средство, позволяющее оценить умение обучающегося письменно излагать суть поставленной проблемы, самостоятельно проводить анализ этой проблемы с использованием концепции и аналитического инструментария соответствующей дисциплины, делать выводы, обобщающие авторскую позицию по поставленной проблеме. | Тематика эссе |












