
« ВСЯКОЕ ВЕЩЕСТВО –ОТ САМОГО ПРОСТОГО ДО САМОГО СЛОЖНОГО – ИМЕЕТ ТРИ РАЗЛИЧНЫЕ, НО ВЗАИМОСВЯЗАННЫЕ СТОРОНЫ – СВОЙСТВА, СОСТАВ, СТРОЕНИЕ»
Б.М.КЕДРОВ

« …Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку мерцал переливающийся огонь. Ни в чьём воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана … Страшный пёс, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами.
Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте
- Фосфор, -сказал я».

Тема урока «Фосфор и его соединения»

Цели урока : • рассмотреть особенности строения атома фосфора, его свойства, аллотропные видоизменения элемента; • дать сведения о значении фосфора для живой природы; • сформировать знания о строении получении, химических и физических свойств фосфора и его соединений; • развить у школьников способности к самостоятельному мышлению.
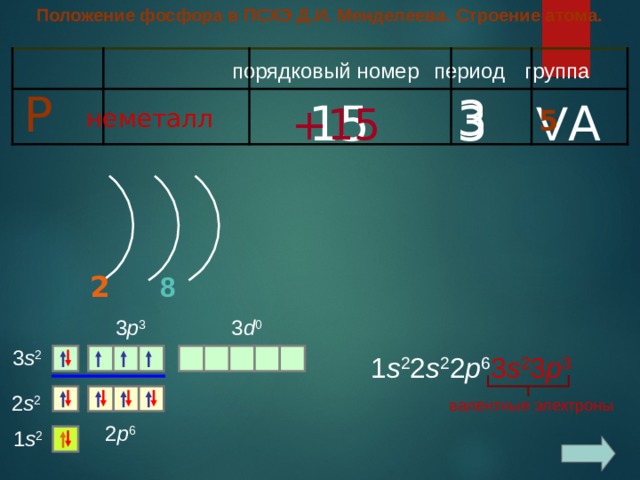
Положение фосфора в ПСХЭ Д.И. Менделеева. Строение атома.
период
группа
порядковый номер
Р
3
V A
1 5
3
+1 5
неметалл
5
8
2
3 p 3
3 d 0
3 s 2
1 s 2 2 s 2 2 p 6 3 s 2 3 p 3
2 s 2
валентные электроны
2 p 6
1 s 2

- 2)СРАВНИТЕ СВОЙСТВА АТОМА ФОСФОРА СО СВОЙСТВАМИ ЭЛЕМЕНТОВ, СТОЯЩИМИ РЯДОМ В ПЕРИОДЕ И ПОДГРУППЕ.
- N
- Si P S
- As

ИСТОРИЯ ОТКРЫТИЯ ФОСФОРА
В 17 веке разорившийся купец из Гамбурга Геннинг Бранд занялся алхимией, пытался получить так называемый «философский камень». Камень, который превращает любой металл в золото. В ходе одного из опытов он выпарил мочу, смешал остаток с углем, песком и продолжил выпаривание. Вскоре в реторте образовалось вещество, светившееся в темноте. Так был открыт белый фосфор.
Ca 3 (PO 4 ) 2 +5C+3SiO 2 =3CaSiO 3 +2P+5CO
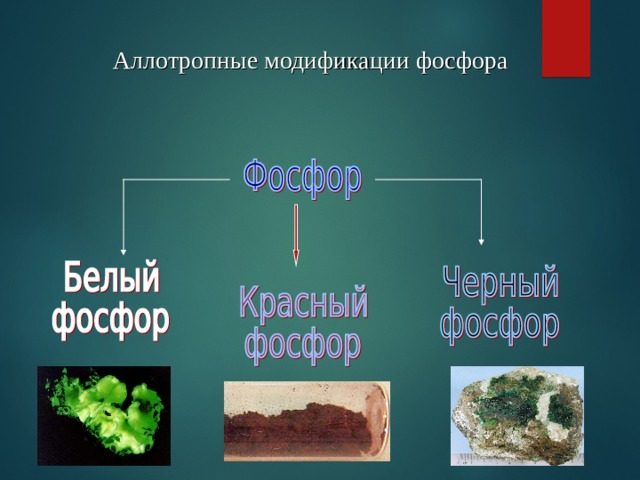
Аллотропные модификации фосфора

Белый фосфор
Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р 4.
Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44 о С. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.При нагревании без доступа воздуха до 250-300 градусов белый фосфор превращается в красный.

КРАСНЫЙ ФОСФОР
Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор, нерастворим в воде и сероуглероде, не светится в темноте и не самовоспламеняется, абсолютно безвреден. Температура возгорания – 260 о С.Большое число атомов фосфора связано друг с другом в цепи , кольца …


ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
А) Взаимодействие с кислородом:
Р + О 2 →
Б) Взаимодействие с галогенами:
P+Cl2 →
В) Взаимодействие с активными металлами:
Mg + P →
Г) Взаимодействие с бертолетовой солью:
Р + KClO 3 → P 2 O 5 + KCl
Д) Взаимодействие с азотной кислотой
P+5HNO 3 = H 3 PO 4 +5NO 2 +H 2 O
Допишите уравнения реакций. Какую роль выполняет фосфор в этих реакциях? Составьте электронный баланс к данным реакциям.

Фосфин РН 3 получают косвенно, например: Ca 3 P 2 +6HCl=3CaCl 2 +2PH 3 Фосфин – очень ядовитый газ с неприятным запахом. Легко воспламеняется на воздухе. Это свойство объясняет появление блуждающих огней. Блуждающие огни появляются в таких местах, как кладбища, болота; эти явления и другие случаи свечения фосфора и его соединений вызывали суеверный страх у многих людей, не знакомых с сущностью этих явлений.

ОКСИД ФОСФОРА Р 2 О 5 +Н 2 О → Р 2 О 5 + СаО → Р 2 О 5 + N аОН →

ОРТОФОСФОРНАЯ КИСЛОТА Н 3 РО 4 твердое кристаллическое вещество, бесцветное, хорошо растворимо в воде. Кислота средней силы + 3- Н 3 РО 4 → 3H + РО 4

Соли ортофосфорной кислоты: 1) средние: фосфаты N а 3 РО 4 2) кислые: а) гидрофосфаты N аНРО 4 б ) дигидрофосфаты N аН 2 РО 4
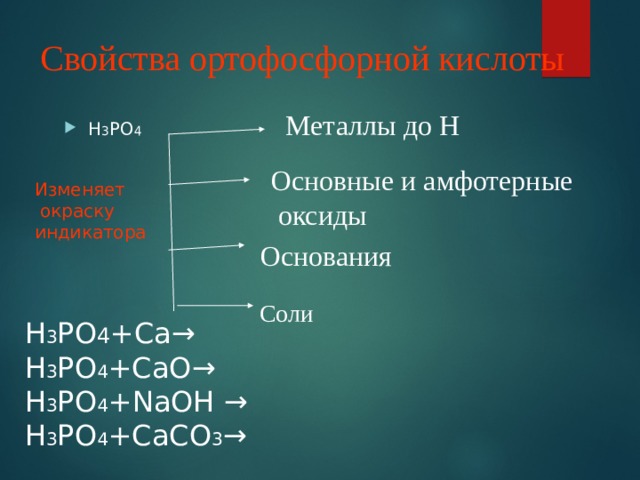
Свойства ортофосфорной кислоты
Металлы до Н
Основные и амфотерные
оксиды
Изменяет
окраску
индикатора
Основания
Соли
Н 3 РО 4 +Са→
Н 3 РО 4 +СаО→
Н 3 РО 4 + N аОН →
Н 3 РО 4 +СаСО 3 →

Качественная реакция на фосфат ион- ионы серебра
- K 3 PO 4 +3 Ag NO 3 = Ag 3 PO 4 ↓+3KNO 3
при этом выпадает жёлтый осадок фосфат серебра

НАХОЖДЕНИЕ В ПРИРОДЕ
Фосфор встречается в природе только в связанном состоянии. Массовая доля фосфора в земной коре – около 0,12%.
Важнейшие минералы:
С a 3 (PO 4 ) 2 – фосфорит;
3 С a 3 (PO 4 ) 2 ∙Ca(OH) 2 – гидроксиапатит;
3 С a 3 (PO 4 ) 2 ∙CaF 2 – фторапатит.
По содержанию в организме человека фосфор относится к макроэлементам ( w (Р) = 0,95%).
Фосфор входит в состав костной, нервной и мозговой тканей, крови, молока.
Фосфором богаты яйца, мясо, молоко, хлеб.

Фосфор и его соединения имеют большое значение для химической промышленности. Фосфор необходим для жизнедеятельности растений, животных и человека. Ежесуточная потребность взрослого человека в фосфоре от 1 до 1,2г. Академик А.Е. Ферсман назвал фосфор «элементом жизни и мысли»

ПРИМЕНЕНИЕ ФОСФОРА
- Более половины объема мирового производства фосфора перерабатывается в соединения, используемые в синтетических моющих средствах.
- Соединения фосфора используют для получения антикоррозионных добавок к маслам и горючему для автомобилей.
- Фосфор используется при производстве спичек.
- Из фосфора получают фосфорную кислоту, которая идет на производство удобрений .
Что мы узнали о фосфоре?

Творческая задача.
Сравните содержание фосфора в простом и двойном суперфосфате. Какое из перечисленных соединений представляет большую ценность для минерального питания растений?
Простой (Са(Н 2 РО 4 ) 2 •Н 2 О+Са S О 4 •2Н 2 О
Двойной (Са(Н 2 РО 4 ) 2 •Н 2 О

Рефлексия
Если согласны с утверждением, поставьте «+»
- На уроке было над чем подумать.
- Я понял новую тему.
- Я вижу практическое применение темы.
- Думаю, что тему урока усвоил(а) на (баллы)

Домашнее задание §28, упр.2,3,5
Спасибо за внимание!



















































