
ОРГАНИЧЕСКАЯ ХИМИЯ
ТЕМА 2. ОСНОВНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
3. ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ

ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Это органические соединения, образующиеся при замене атомов водорода в углеводородах на атомы галогенов.
Моногалогенопроизводные предельных углеводородов называются алкилгалогенидами . Их состав выражается общей формулой C n H 2n+1 X, где Х может быть F, Cl, Br, I

По числу атомов галогена
1- хлорэтан
1,1- дихлорэтан
CH 3 CH 2 Cl
CH 3 CH Cl
Моно-
Ди-
Cl
Галогенопроизводные
Cl
C Cl Cl
Поли-
1,1,1- тихлорэтан
CH 3
По природе атома углерода
CH 3 CH 2 CH 2 Cl
Первичные
CH 3
Вторичные
CH CH 3
Cl
CH 3
C CH 3
Cl
Третичные
2-хлор- 2-метилпропан
CH 3
Алифатические
По природе связанного с
галогеном радикала
этилхлорид
CH Cl
CH
2
3
Ароматические
фенилхлорид
Cl
Фторопроизводные
этил фтористый этил бромистый
этил хлористый этил иодистый
По природе галогена
CH 3 CH 2 F
Бромопроизводные
CH 3 CH 2 Br
Хлоропроизводные
CH 3 CH 2 Cl
Йодопроизводные
CH 3 CH 2 I

НОМЕНКЛАТУРА
Номенклатура ИЮПАК производит названия галогенсодержащих соединений от названий углеводородов, причем впереди ставится название галогена и цифра, обозначающая, при каком атоме углерода от начала цепи находится галоген
CH CH 3 Cl CH 2 CH CH 3
Cl
CH 3 Cl CH 3
хлорметан
CH 3
1-хлор- 2метилпропан
2- хлорпропан
Если в углеводороде присутствуют и кратная связь, и атом галогена, то начало нумерации определяет кратная связь
H 2 C CH CH 2 CH 2 Br
CH 3 C C CH 2 CH 2 Br
CH 3 Cl
5- бром-2-метил-3хлорпентен- 2
4- бромбутен- 1

ИЗОМЕРИЯ (Углеродного скелета)
CH 3 CH 2 CH 2 CH 2 Cl CH 3 CH CH 2
CH 3
Cl
1-хлорбутан
1- хлор- 2-метилпропан
ИЗОМЕРИЯ (Положения галогена)
CH 3 CH 2 CH CH 3
I
CH 3 CH 2 CH 2 CH 2 I
2- иодбутан (вторичный бутилиодид)
1- иодбутан (бутилиодид)

ФИЗИЧЕСКИЕ СВОЙСТВА
- Агрегатное состояние: первые низшие представители - газы, последующие до С 12 - жидкости, выше - твердые тела.
- Имеют резкий неприятный специфический запах практически все
представители.
- Очень плохо растворимы в воде, однако сами - отличные растворители. В органических соединениях растворяются очень
- Очень плохо растворимы в воде, однако сами - отличные растворители. В органических соединениях растворяются очень
хорошо.
- Температуры кипения и плавления увеличиваются с ростом числа атомов углерода в главной цепи.
- Все соединения, кроме фторпроизводных, тяжелее воды.
- Все соединения, кроме фторпроизводных, тяжелее воды.
- Чем больше разветвлений в главной цепи, тем ниже температура
кипения вещества.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические реакции аренов
Замещения
Отщепления
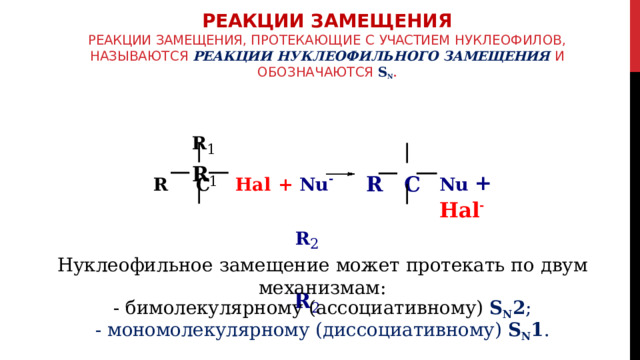
РЕАКЦИИ ЗАМЕЩЕНИЯ Реакции замещения, протекающие с участием нуклеофилов, называются реакции нуклеофильного замещения и обозначаются S N .
R 1 R 1
Nu + Hal -
R C Hal + Nu - R C
R 2 R 2
Нуклеофильное замещение может протекать по двум механизмам:
- бимолекулярному (ассоциативному) S N 2 ;
- мономолекулярному (диссоциативному) S N 1 .

МЕХАНИЗМ РЕАКЦИЙ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
Реакционная способность галогенопроизводных в реакциях S N зависит от строения углеводородного радикала и природы галогена, большую роль играют также условия реакции (t, наличие или отсутствие катализатора) и характер растворителя, в среде которого взаимодействуют вещества.
Таким образом, соединения с третичными радикалами реагируют по S N 1, а с первичными – по S N 2 механизму. Соединения с вторичным радикалом
могут реагировать по любому механизму в зависимости от природы нуклеофила, уходящей группы и растворителя.
H C 2 H 5 C Cl
CH 3 C 2 H 5 C Cl
H C 2 H 5 C Cl
H
CH 3
вторичный
CH 3
третичный
первичный
![В случае вторичных и первичных алкилгалогенидов, как правило, реакция идёт как бимолекулярное нуклеофильное замещение S N 2 : атакующая частица постепенно вытесняет уходящую группу. Образование новой и разрыв старой связи происходит одновременно (синхронно). Скорость реакции S N 2 зависит как от концентрации нуклеофила, так и концентрации субстрата: V = k[R-Hal][Nu] Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта.](https://fsd.multiurok.ru/html/2022/06/27/s_62b94b4f572c0/img9.jpg)
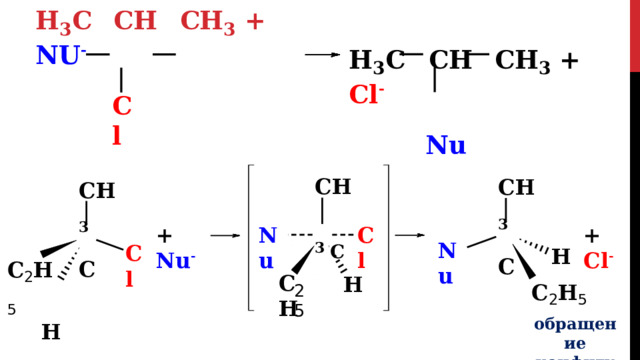
В случае вторичных и первичных алкилгалогенидов, как правило, реакция идёт как бимолекулярное нуклеофильное замещение S N 2 : атакующая частица постепенно вытесняет уходящую группу.
Образование новой и разрыв старой связи происходит одновременно (синхронно).
Скорость реакции S N 2 зависит как от концентрации нуклеофила, так и концентрации субстрата:
V = k[R-Hal][Nu]
Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является
стереохимическая инверсия образующегося продукта.
H 3 C CH CH 3 + Nu -
H 3 C CH CH 3 + Cl -
Nu
Cl
CH 3 C C H 3
CH 3
C
CH 3
C
Cl
Nu
+ Nu -
+ Cl -
Nu
Cl
H
CH 3
C 2 H 5
H
C 2 H 5
обращение конфигурации
- инверсия
C H
H
2 5
![В случае третичных алкилгалогенидов нуклеофильное замещение идёт по механизму мономолекулярного нуклеофильного замещения S N 1 Реакция не является синхронным процессом и состоит из двух основных стадий. В первой стадии (определяет скорость реакции) участвует только одна молекула, которая диссоциирует под воздействием среды с образованием карбокатиона и уходящей группы. Далее, нуклеофил быстро атакует карбокатион, образуя конечный продукт. Скорость реакции S N 1 (в упрощённом виде) не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата V = k[R- Hal]](https://fsd.multiurok.ru/html/2022/06/27/s_62b94b4f572c0/img11.jpg)
В случае третичных алкилгалогенидов нуклеофильное замещение идёт по механизму мономолекулярного нуклеофильного замещения S N 1 Реакция не является синхронным процессом и состоит из двух
основных стадий.
В первой стадии (определяет скорость реакции) участвует только одна молекула, которая диссоциирует под воздействием среды с
образованием карбокатиона и уходящей группы.
Далее, нуклеофил быстро атакует карбокатион, образуя конечный продукт.
Скорость реакции S N 1 (в упрощённом виде) не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата
V = k[R- Hal]
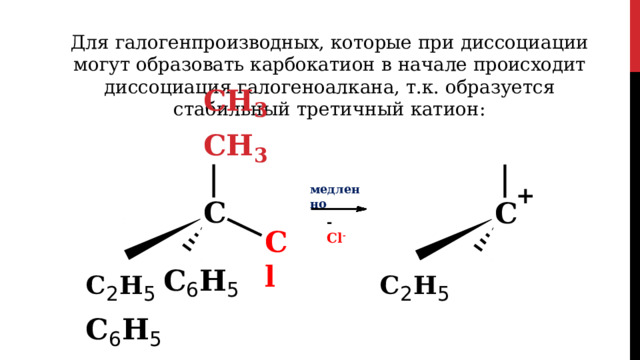
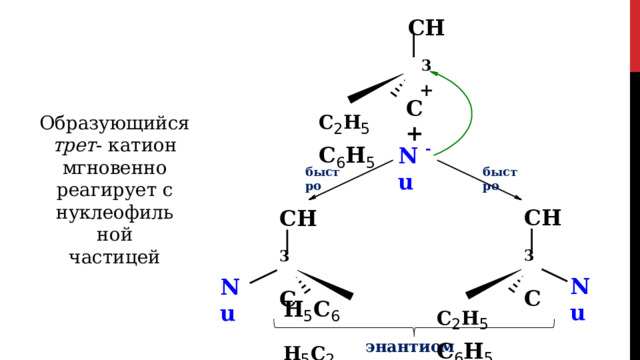
Для галогенпроизводных, которые при диссоциации могут образовать карбокатион в начале происходит диссоциация галогеноалкана, т.к. образуется стабильный третичный катион:
CH 3 CH 3
+
медленно
C
C
- Cl -
Cl
C 2 H 5 C 6 H 5 C 2 H 5 C 6 H 5
CH 3
+
C
C 2 H 5 C 6 H 5
Образующийся трет - катион мгновенно
реагирует с нуклеофильной частицей
+
-
Nu
быстро
быстро
CH 3
C
CH 3
C
Nu
Nu
C 2 H 5 C 6 H 5
H 5 C 6 H 5 C 2
энантиомеры
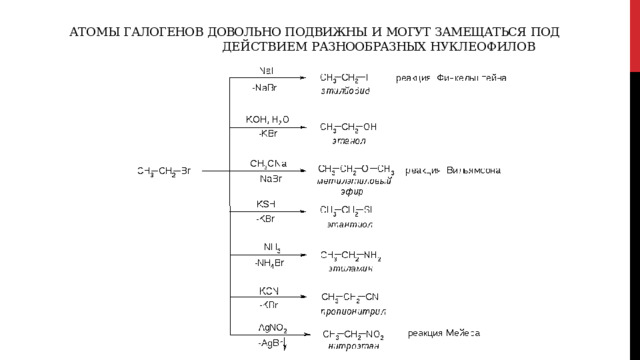
Атомы галогенов довольно подвижны и могут замещаться под действием разнообразных нуклеофилов

Факторы, влияющие на реакции нуклеофильного замещения
С увеличением объема и числа заместителей при атакуемом атоме углерода затрудняется атака нуклеофилом. Для реакций, протекающих по бимолекулярному механизму, это сопровождается серьезными пространственными затруднениями в
переходном состоянии и скорость их падает.
- Замена одного растворителя другим может приводит к изменению механизма одной и той же реакции, что нередко используется на практике.
- Замена растворителя может приводить к изменению сольватации и вызывать соответствующие изменения в реакции.

- ВЛИЯНИЕ ВСТУПАЮЩЕЙ ГРУППЫ
Замена вступающей группы (на более нуклеофильную, например) не приводит к изменению скорости реакции, протекающей по механизму S N 1 (они не принимают участия на стадии, определяющей скорость реакции).
Если же реакция протекает по механизму S N 2, то скорость реакции возрастает с увеличением нуклеофильности атакующей частицы.
Общим правилом является: чем выше основность уходящей группы, тем труднее она будет замещаться атакующим нуклеофилом . Однако, подобные группы могут быть легко замещены в кислой среде, когда в результате
предварительного протонирования улучшаются условия для атаки нуклеофилом (больший положительный заряд на атоме углерода), а сама группа уходит в виде нейтральной молекулы.
Скорость реакции, протекающей по механизму S N 1 зависит от природы покидающей группы, чем ниже энергия связи этой группы с атакуемым атомом углерода, тем легче идет замещение по механизму SN1.

РЕАКЦИИ ОТЩЕПЛЕНИЯ (элиминирования)
Наиболее характерная особенность реакций элиминирования состоит в том, что от субстрата под
действием реагента отщепляются два фрагмента и в результате образуется продукт элиминирования. В результате этой реакции в продукте элиминирования обычно образуется новая σ- или π- связь.
Если оба отщепляющихся фрагмента связаны с одним и тем же атомом углеродного скелета, то такой процесс называется α-элиминированием, в результате образуется электронодефицитная частица – карбен.
A B D X
A B
D
- XD
X
Если уходящие группы связаны с соседними атомами, то реакция отщепления, приводящая к возникновению новой σ-связи, протекает путем β-элиминирования с образованием двойной связи.
A R A R X X D
- XD
Реакции элиминирования групп, расположенных далеко друг от друга, приводят к циклическим соединениям
- XD
X D

В реакциях бимолекулярного элиминирования (E2) две группы отщепляются одновременно
X
H
H H
-HX
H
H
B:
H H
H
H
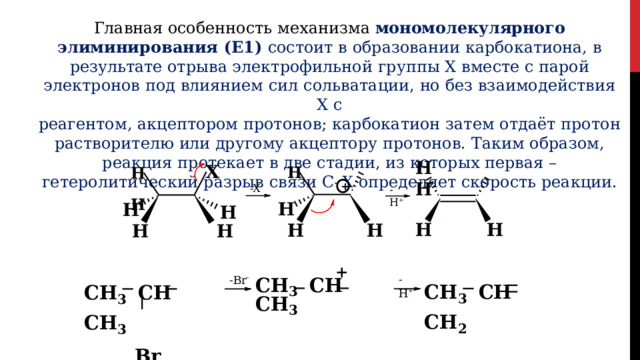
Главная особенность механизма мономолекулярного элиминирования (E1) состоит в образовании карбокатиона, в результате отрыва электрофильной группы Х вместе с парой электронов под влиянием сил сольватации, но без взаимодействия Х с
реагентом, акцептором протонов; карбокатион затем отдаёт протон растворителю или другому акцептору протонов. Таким образом, реакция протекает в две стадии, из которых первая – гетеролитический разрыв связи С–Х определяет скорость реакции.
H X H H
H H
+
-X -
-H +
H
H
H
H
H H
H
H
H
+
CH 3 CH CH 3
CH 3 CH CH 3
Br
- H +
- Br -
CH 3 CH CH 2

ПОЛУЧЕНИЕ
1. Галогенирование алканов при облучении светом
h v
CH CH + Cl
CH 3 CH 2 Cl + HCl
3 3
2
2. Из спиртов
- Взаимодействие пентагалогенидов фосфора со спиртами в мягких условиях
RCl + HCl +POCl 3
R OH + PCl 5
- Реакции с галогеноводородной кислотой
OH + HBr RBr
R
- HOH
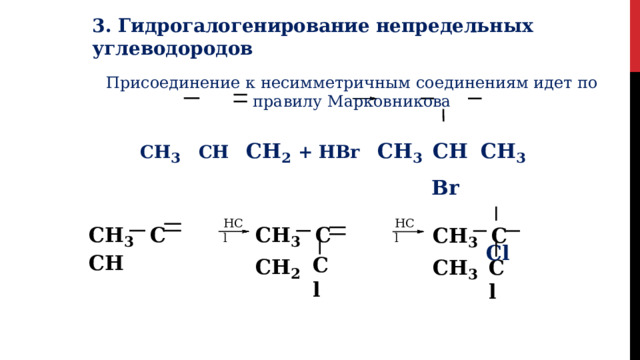
3. Гидрогалогенирование непредельных углеводородов
Присоединение к несимметричным соединениям идет по правилу Марковникова
CH 3 CH CH 2 + HBr CH 3 CH CH 3
Br
Cl
HCl
HCl
CH 3 C CH 2
CH 3 C CH
CH 3 C CH 3
Cl
Cl
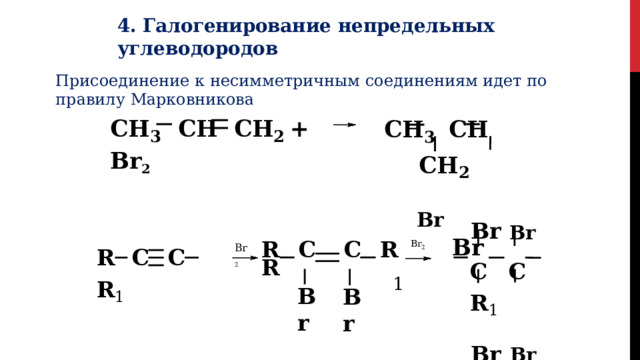
4. Галогенирование непредельных углеводородов
Присоединение к несимметричным соединениям идет по правилу Марковникова
CH 3 CH CH 2
Br Br
CH 3 CH CH 2 + Br 2
Br Br
C C R 1
Br Br
Br 2
R C C R Br 2 R
1
R C C R 1
Br
Br

5. Получение фтористых алкилов
Фтороводород к алкенам не присоединяется, а вызывает их полимеризацию.
Поэтому фтористые алкилы получают действием фторида серебра на иодистые
алкилы
CH 3 CH 2 I + AgF CH 3 CH 2 F + AgI














![В случае вторичных и первичных алкилгалогенидов, как правило, реакция идёт как бимолекулярное нуклеофильное замещение S N 2 : атакующая частица постепенно вытесняет уходящую группу. Образование новой и разрыв старой связи происходит одновременно (синхронно). Скорость реакции S N 2 зависит как от концентрации нуклеофила, так и концентрации субстрата: V = k[R-Hal][Nu] Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта.](https://fsd.multiurok.ru/html/2022/06/27/s_62b94b4f572c0/img9.jpg)

![В случае третичных алкилгалогенидов нуклеофильное замещение идёт по механизму мономолекулярного нуклеофильного замещения S N 1 Реакция не является синхронным процессом и состоит из двух основных стадий. В первой стадии (определяет скорость реакции) участвует только одна молекула, которая диссоциирует под воздействием среды с образованием карбокатиона и уходящей группы. Далее, нуклеофил быстро атакует карбокатион, образуя конечный продукт. Скорость реакции S N 1 (в упрощённом виде) не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата V = k[R- Hal]](https://fsd.multiurok.ru/html/2022/06/27/s_62b94b4f572c0/img11.jpg)






























