
Гибридизация атомных орбиталей

Способы описания химической связи
В настоящее время используется два метода для описания ковалентных связей:
- Метод валентных связей (МВС).
- Метод молекулярных орбиталей (ММО/МО ЛКАО).
ММО рассматривает образующуюся связь как собственность не двух атомов, а всей молекулы в целом.

Основы метода валентных связей
1. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных облаков и между атомами возникает зона с повышенной электронной плотностью. Это приводит к уменьшению потенциальной энергии системы.
2. В пространстве связь располагается по направлению, в котором возможность перекрывания электронных облаков наибольшая. Из нескольких связей, образуемых данным атомом, наиболее прочной будет та связь, у которой перекрывание атомных орбиталей наибольшее.
3. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность.
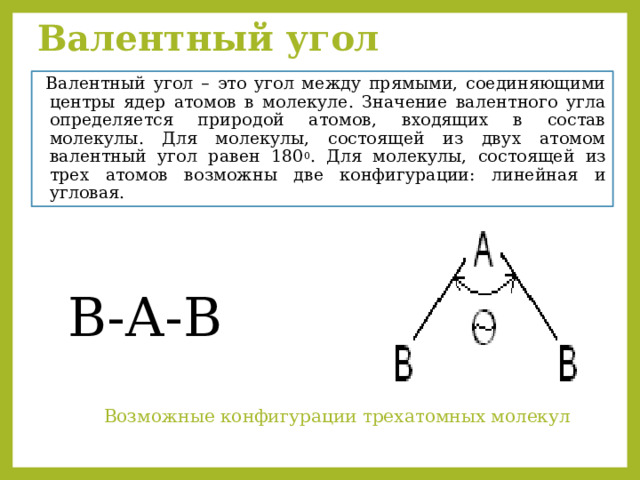
Валентный угол
Валентный угол – это угол между прямыми, соединяющими центры ядер атомов в молекуле. Значение валентного угла определяется природой атомов, входящих в состав молекулы. Для молекулы, состоящей из двух атомом валентный угол равен 180 0 . Для молекулы, состоящей из трех атомов возможны две конфигурации: линейная и угловая.
В-А-В
Возможные конфигурации трехатомных молекул

Донорно-акцепторный механизм образования ковалентной связи
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь (лакуну):
А : + В = А : В
Пример образования ковалентной связи в ионе аммония (1)
7 N имеет 1 пару электронов на 2s подуровне и 3 неспареных электрона на 2p подуровне 2S 2 2p 3
1 H имеет 1 неспареный электрон – 1s 1

Пример образования ковалентной связи в ионе аммония (2)
В молекуле аммиака есть 1 пара электронов.
В ионе атома водорода (H + ) нет электронов, зато есть вакантная орбиталь 1s:
В соединениях, образованных по донорно-акцепторному типу связи электрический заряд равномерно распределен по всей частице, все связи равноценны.

Насыщаемость ковалентной связи
Насыщаемость ковалентной связи (валентные возможности атома, максимальная валентность) характеризует способность атомов участвовать в образовании определенного ограниченного числа ковалентных связей.
Валентность элемента (В) - его способность к образованию химических связей. В представлении МВС численное значение валентности соответствует числу ковалентных связей, которые образует атом.
В ряде случаев атом, имеющий пару электронов может перейти в возбужденное состояние (промотирование электрона):
6С 2s2 2p2 → 6C 2s1 2p3
Происходит это в тех случаях, когда выделение энергии от образования химической связи больше, чем поглощение энергии, затрачиваемой на промотирование.

Гибридизация
Гибридизация – выравнивание по форме и энергии электронных облаков с образованием новых, одинаковых по форме и энергии. Новые облака называются гибридными, их число равно сумме электронных облаков, участвующих в гибридизации.
Основные положения теории гибридизации
1. Если у атома, вступающего в химическую связь, имеются разные АО (s-, р-, d- или f-АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО.
2. Форма гибридной АО отличается от формы исходных АО. В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи.
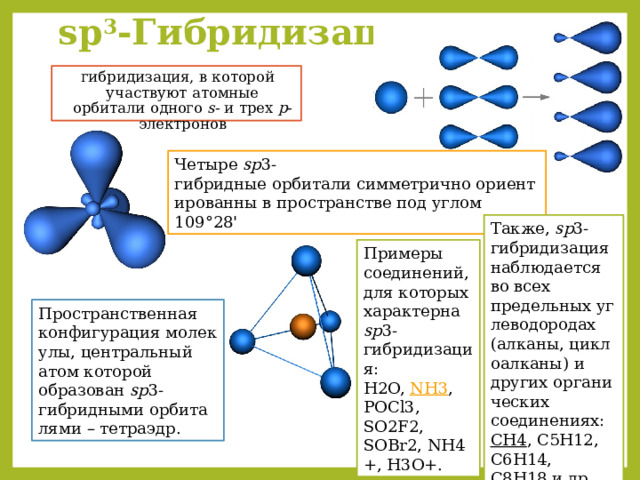
sp 3 -Гибридизация –
гибридизация, в которой участвуют атомные орбитали одного s - и трех p -электронов
Четыре sp 3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'
Также, sp 3-гибридизация наблюдается во всех предельных углеводородах (алканы, циклоалканы) и других органических соединениях:
CH4 , C5H12, C6H14, C8H18 и др.
Примеры соединений, для которых характерна sp 3-гибридизация:
H2O, NH3 , POCl3, SO2F2, SOBr2, NH4+, H3O+.
Пространственная конфигурация молекулы, центральный атом которой образован sp 3-гибридными орбиталями – тетраэдр.
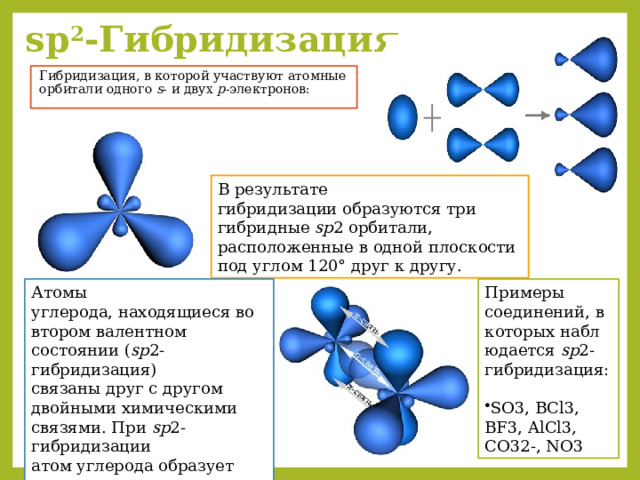
sp 2 -Гибридизация –
Гибридизация, в которой участвуют атомные орбитали одного s - и двух p -электронов:
В результате гибридизации образуются три гибридные sp 2 орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Примеры соединений, в которых наблюдается sp 2-гибридизация:
- SO3, BCl3, BF3, AlCl3, CO32-, NO3
Атомы углерода, находящиеся во втором валентном состоянии ( sp 2-гибридизация) связаны друг с другом двойными химическими связями. При sp 2-гибридизации атом углерода образует три σ -связи и одну π -связь с соседними атомами углерода.
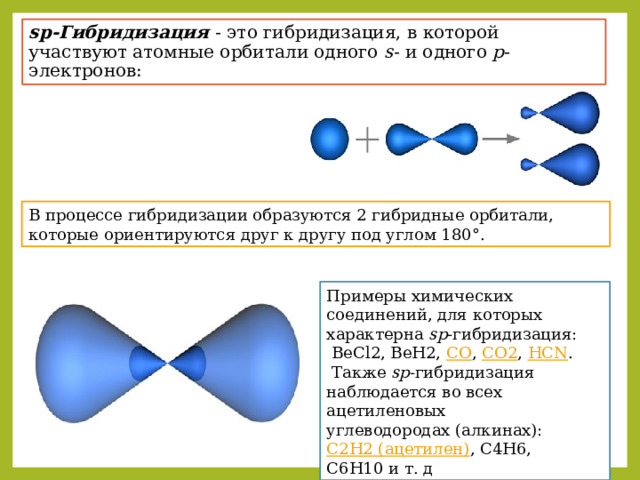
sp-Гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s - и одного p -электронов:
В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°.
Примеры химических соединений, для которых характерна sp -гибридизация:
BeCl2, BeH2, CO , CO2 , HCN .
Также sp -гибридизация наблюдается во всех ацетиленовых углеводородах (алкинах): C2H2 (ацетилен) , C4H6, C6H10 и т. д
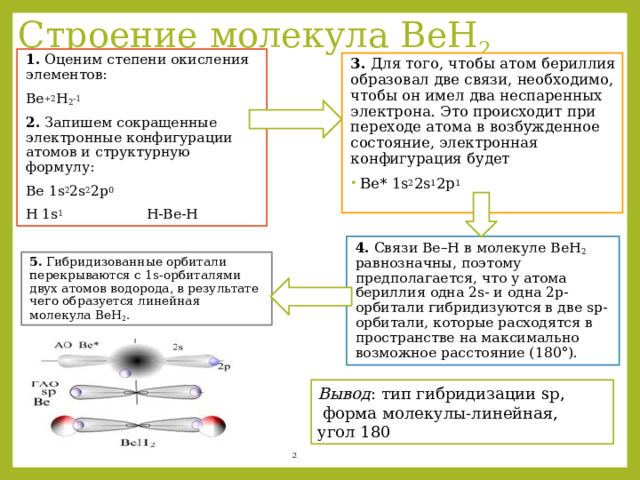
Строение молекула BeH 2
1. Оценим степени окисления элементов:
Be +2 H 2 -1
2. Запишем сокращенные электронные конфигурации атомов и структурную формулу:
Be 1s 2 2s 2 2p 0
H 1s 1 Н-Ве-Н
3. Для того, чтобы атом бериллия образовал две связи, необходимо, чтобы он имел два неспаренных электрона. Это происходит при переходе атома в возбужденное состояние, электронная конфигурация будет
4. Связи Be–H в молекуле BeH 2 равнозначны, поэтому предполагается, что у атома бериллия одна 2s- и одна 2p-орбитали гибридизуются в две sp-орбитали, которые расходятся в пространстве на максимально возможное расстояние (180°).
5. Гибридизованные орбитали перекрываются с 1s-орбиталями двух атомов водорода, в результате чего образуется линейная молекула BeH 2 .
Вывод : тип гибридизации sр,
форма молекулы-линейная,
угол 180
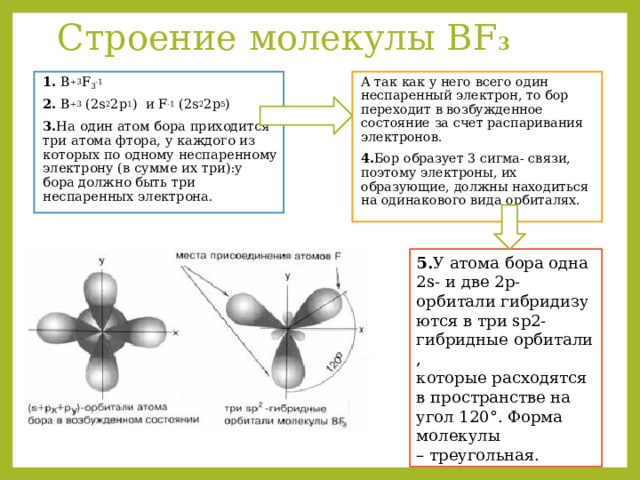
Строение молекулы ВF 3
1. B +3 F 3 -1
А так как у него всего один неспаренный электрон, то бор переходит в возбужденное состояние за счет распаривания электронов.
2. B +3 (2s 2 2p 1 ) и F -1 (2s 2 2p 5 )
4. Бор образует 3 сигма- связи, поэтому электроны, их образующие, должны находиться на одинакового вида орбиталях.
3. На один атом бора приходится три атома фтора, у каждого из которых по одному неспаренному электрону (в сумме их три):у бора должно быть три неспаренных электрона.
5. У атома бора одна 2s- и две 2p-орбитали гибридизуются в три sp2-гибридные орбитали, которые расходятся в пространстве на угол 120°. Форма молекулы – треугольная.
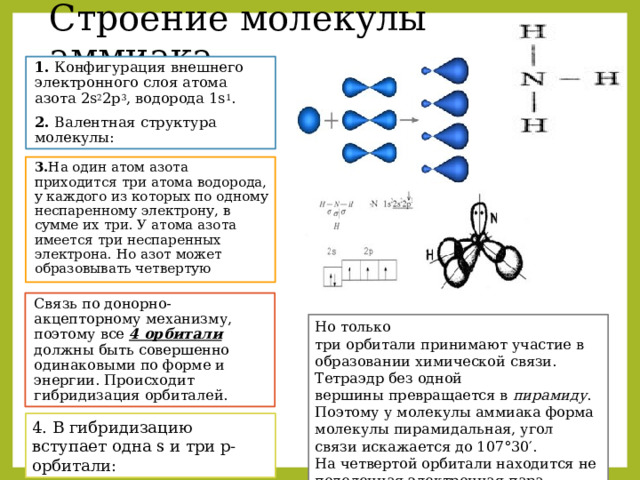
Строение молекулы аммиака
1. Конфигурация внешнего электронного слоя атома азота 2s 2 2р 3 , водорода 1s 1 .
2. Валентная структура молекулы:
3. На один атом азота приходится три атома водорода, у каждого из которых по одному неспаренному электрону, в сумме их три. У атома азота имеется три неспаренных электрона. Но азот может образовывать четвертую
Связь по донорно- акцепторному механизму, поэтому все 4 орбитали должны быть совершенно одинаковыми по форме и энергии. Происходит гибридизация орбиталей.
Но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду . Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′.
На четвертой орбитали находится неподеленная электронная пара.
4. В гибридизацию вступает одна s и три р-орбитали:
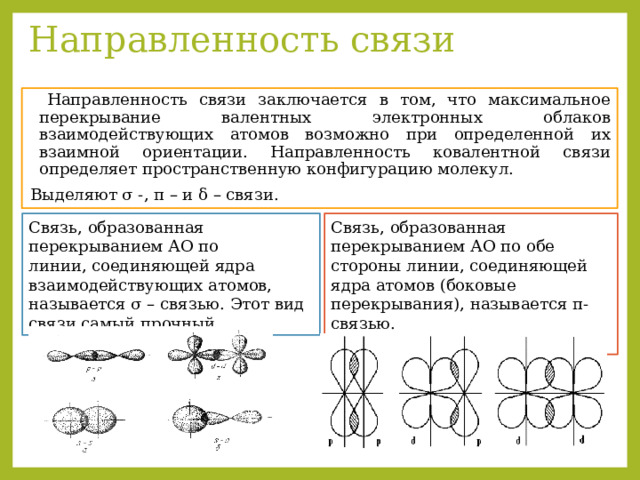
Направленность связи
Направленность связи заключается в том, что максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Направленность ковалентной связи определяет пространственную конфигурацию молекул.
Выделяют σ -, π – и δ – связи.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ – связью. Этот вид связи самый прочный.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью.
 двойной одинарной. Кратность – количество связей между двумя атомами. Двойная связь обозначается двумя черточками, тройная тремя. Полярность химической связи Общая электронная пара может быть смещена к более электроотрицательному атому. Такая связь называется полярной. Возникает в случае, если два атома обладают различной электроотрицательностью. В неполярной связи общая электронная пара находится посередине между двумя атомами. " width="640"
двойной одинарной. Кратность – количество связей между двумя атомами. Двойная связь обозначается двумя черточками, тройная тремя. Полярность химической связи Общая электронная пара может быть смещена к более электроотрицательному атому. Такая связь называется полярной. Возникает в случае, если два атома обладают различной электроотрицательностью. В неполярной связи общая электронная пара находится посередине между двумя атомами. " width="640"
Кратность связи
Связь, которая образована одной электронной парой между двумя атомами, называется одинарной. Одинарная связь всегда σ – связь.
Связь, образованная более чем одной электронной парой, называется кратной (двойной или тройной).
Энергия тройной связи двойной одинарной.
Кратность – количество связей между двумя атомами.
Двойная связь обозначается двумя черточками, тройная тремя.
Полярность химической связи
Общая электронная пара может быть смещена к более электроотрицательному атому. Такая связь называется полярной. Возникает в случае, если два атома обладают различной электроотрицательностью.
В неполярной связи общая электронная пара находится посередине между двумя атомами.

Поляризуемость химической связи
Поляризуемость связи характеризует способность становиться полярной (или более полярной) в результате действия на молекулу внешнего электрического поля.
В результате воздействия внешнего поля может произойти разрыв связи:

Выберите правильный ответ .
- 1. Тип гибридизации электронных облаков в молекуле CF 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Тип гибридизации электронных облаков в молекуле СO 2
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.

- 1. Тип гибридизации электронных облаков в молекуле СаCl 2:
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Тип гибридизации электронных облаков в молекуле ВСl 3:
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd.

Выберите правильный ответ
- 1. При гибридизации происходит:
- 1) образование электронных орбиталей одинаковой формы и энергии;
- 2) выравнивание всех электронных облаков;
- 3) образование тетраэдрической формы молекулы;
- 4) приобретение одинаковых валентных углов.
- 2. Пространственная форма молекулы NF3, если угол между связями равен 102°:
- 1) треугольная пирамида с атомом азота в одной из вершин;
- 2) треугольник с атомом азота в центре;
- 3) треугольник с атомом аз 4) плоский четырехугольник с атомом азота в одной из вершин. ота на одной из сторон;

Выберите правильный ответ
- 1. Тип гибридизации электронных облаков в молекуле СCl 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Тип гибридизации электронных облаков в молекуле ВеJ 2
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.

Выберите правильный ответ
- 1. Тип гибридизации электронных облаков в молекуле GeCl 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Тип гибридизации электронных облаков в молекуле SiCl 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.

Установите соответствие
- Тип гибридизации:
- 1) sp-
- 2) sp 2 -
- 3) sp 3 -
- Механизм и форма молекул:
- а) гибридизация одной s- и трех р-орбиталей
- б) тетраэдрическая в) гибридизация одной s- и двух р-орбиталей
- г) треугольная д) гибридизация одной s- и одной р- орбитали
- е) линейная

Пространственная форма молекулы BF 3 , если угол между связями равен 120°
- 1) треугольная пирамида с атомом бора в одной из вершин;
- 2) плоский треугольник с атомом бора в центре;
- 3) плоский треугольник с атомом бора на одной из сторон;
- 4) плоский четырехугольник с атомом бора в одной из вершин.

Выберите правильный ответ
- 1. Тип гибридизации электронных облаков в молекуле BCl 3
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Молекула, имеющая линейное строение 1) аммиак;
- 2) вода;
- 3) сероводород;
- 4) хлорид стронция.

- 1. Молекула, в которой наблюдается sp-гибридизация
- 1) SiH 4 ;
- 2) GaBr 3 ;
- 3) MgCl 2 ;
- 4) CH 4 .
- 2. Молекула, имеющая форму тетраэдра
- 1) FlCl 3
- 2) BaCl 2
- 3) NH 3
- 4) SiF 4

Установите соответствие
- Механизм образования и форма молекул.
- а) гибридизация одной s- и трех р-орбиталей
- б) тетраэдрическая
- в) гибридизация одной s- и двух р- орбиталей
- г) треугольная
- д) гибридизация одной s- и одной р- орбитали
- е) линейная
1) sp-;
2) sp²-;
3) sp³-;






















 двойной одинарной. Кратность – количество связей между двумя атомами. Двойная связь обозначается двумя черточками, тройная тремя. Полярность химической связи Общая электронная пара может быть смещена к более электроотрицательному атому. Такая связь называется полярной. Возникает в случае, если два атома обладают различной электроотрицательностью. В неполярной связи общая электронная пара находится посередине между двумя атомами. " width="640"
двойной одинарной. Кратность – количество связей между двумя атомами. Двойная связь обозначается двумя черточками, тройная тремя. Полярность химической связи Общая электронная пара может быть смещена к более электроотрицательному атому. Такая связь называется полярной. Возникает в случае, если два атома обладают различной электроотрицательностью. В неполярной связи общая электронная пара находится посередине между двумя атомами. " width="640"





















