
Гидролиз органических и неорганических соединений

Гидролиз органических веществ.
1. Гидролиз галогеналканов.
С 2 Н 5 С l + Н 2 О → С 2 Н 5 ОН + НС l
2. Гидролиз сложных эфиров.
СН 3- СОО-С 2 Н 5 + Н 2 О → СН 3- СООН +С 2 Н 5 ОН
3. Гидролиз дисахаридов.
С 12 Н 22 О 11 + Н 2 О →С 6 Н 12 О 6 + С 6 Н 12 О 6
4. Гидролиз полисахаридов.
(С 6 Н 10 О 5 ) n + n Н 2 О → n С 6 Н 12 О 6

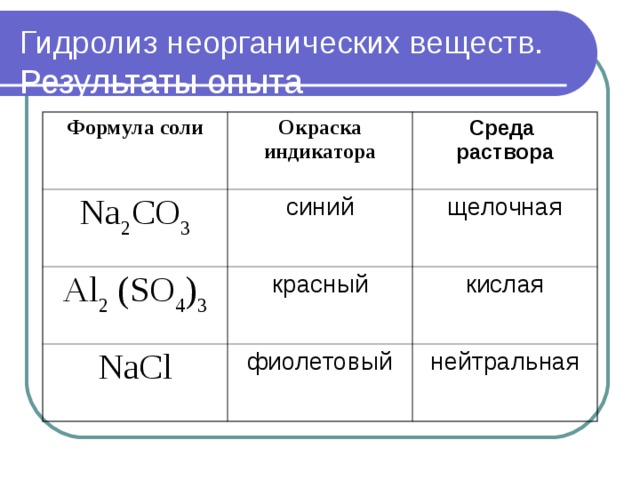
Гидролиз неорганических веществ. Результаты опыта
Формула соли
Окраска индикатора
Среда
раствора
Гидролиз неорганических веществ. Результаты опыта
Формула соли
Окраска индикатора
Na 2 CO 3
Среда
раствора
синий
Al 2 (SO 4 ) 3
красный
щелочная
NaCl
кислая
фиолетовый
нейтральная

Гидролиз неорганических веществ.
→
Н 2 О ↔ H + + OH ¯
- Гидролиз – это реакция обменного разложения веществ водой.

Гидролиз неорганических веществ. Типы солей.
4 типа солей

с оль, образованная сильным основанием
и слабой кислотой, Na2CO3
с оль, образованная слабым основанием и
сильной кислотой, Al2 (SO4)3
с оль, образованная сильным основанием и
сильной кислотой, NaCl
с оль, образованная слабым основанием и слабой
Кислотой , (NH4)2 CO3 .

1. Соли, образованные сильным основанием и слабой кислотой
K2 SiO3 Na2S Na2SO3 K2CO3
2. Соли, образованные сильной кислотой и слабым основанием
AlCl3 Zn(NO3)2 CuSO4 NH4CL
3. Соли, образованные сильной кислотой и сильным основанием
KNO3 Ba(NO3)2 Na2SO4 NaCl
4 . Соли, образованные слабой кислотой и
слабым основанием
NH4CN (NH4)2 S CH3COONH4 (CH3COO)2Cu

Соли, образованные сильным основанием и слабой кислотой.
Среда раствора щелочная

Соли, образованные сильной кислотой и слабым основанием.
среда раствора кислотная

Соли, образованные сильной кислотой и сильным основанием.
Среда раствора нейтральная

Соли, образованные слабой кислотой и слабым основанием.
Реакция среды или нейтральная, или слабокислая, или слабощелочная, что зависит от констант диссоциации кислоты и основания.

Гидролиз в заданиях ЕГЭ по химии.
1. Фенолфталеин можно использовать для обнаружения в водном растворе соли
1) ацетата алюминия 2) нитрата калия
3) сульфата алюминия 4) силиката натрия
2. Среда раствора карбоната калия 1) щелочная 2) кислая 3) нейтральная
4) слабокислая
3. Установите соответствие между названиями солей и средой их растворов.
НАЗВАНИЕ СОЛИ СРЕДА РАСТВОРА
1) нитрит калия А) кислая 2) сульфат железа Б) нейтральная
3) карбонат калия В) щелочная 4) хлорид алюминия) кислая
































