
Карбоновые кислоты

Карбоновые кислоты
Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: С n H 2n O 2
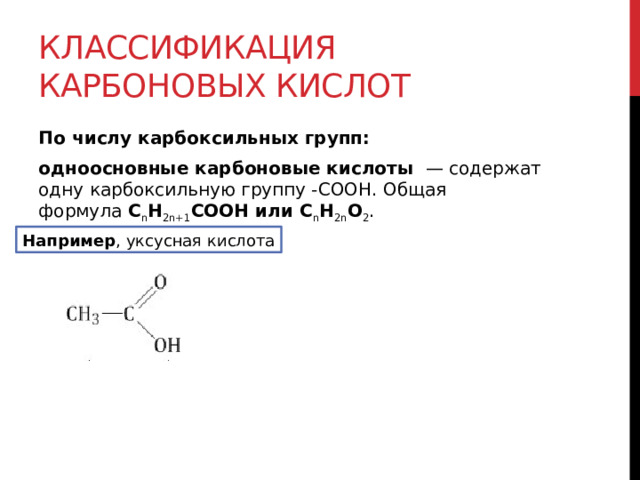
Классификация карбоновых кислот
По числу карбоксильных групп:
одноосновные карбоновые кислоты — содержат одну карбоксильную группу -СООН. Общая формула C n H 2n+1 COOH или C n H 2n O 2 .
Например , уксусная кислота

многоосновные карбоновые кислоты — содержат две и более карбоксильные группы СООН. Например, общая формула двухосновных карбоновых кислот C n H 2n (СОOH) 2 или C n H 2n-2 O 4 .
Например , щавелевая кислота
Классификация по строению углеводородного радикала
Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН 3 –СООН.
Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН 2 =СН–СООН.
Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С 6 Н 5 СООН.
Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С 3 Н 5 СООН.

Строение карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp 2 -гибридизации, образует три σ-связи и одну π-связь.

Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.

Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.

Непредельные одноосновные карбоновые кислоты

Двухосновные карбоновые кислоты

Ароматические карбоновые кислоты

Изомерия предельных карбоновых кислот
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия .
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
Например. Формуле С 4 Н 8 О 2 соответствуют бутановая и 2-метилпропановая кислота

Межклассовая изомерия
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и спиртов, и простых эфиров — C n H 2n О 2 .
Например. Межклассовые изомеры с общей формулой С 2 Н 4 О 2 : уксусная кислота СН 3 –CОOH и метилформиат H–COOCH 3
Общую формулу С n H 2n O 2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.

Химические свойства карбоновых кислот
Для карбоновых кислот характерны следующие свойства:
кислотные свойства, замещение водорода на металл;
замещение группы ОН
замещение атома водорода в алкильном радикале
образование сложных эфиров — этерификация

1. Кислотные свойства
Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н.
Карбоновые кислоты – кислоты средней силы.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO – + H +

1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода .
CH 3 COOH + NaOH = CH 3 COONa + H 2 O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
Например, уксусная кислота растворяет осадок гидроксида меди (II)
Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония
CH 3 COOH + NH 3 = CH 3 COONH 4

1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород .
Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды .
Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды.

1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
Например, уксусная кислота растворяет карбонат кальция
2. Реакции замещения группы ОН
Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов.

2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты

2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:

2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров .
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
При этом фенол не вступает в реакцию этерификации с карбоновыми кислотами. Сложные эфиры фенола получают косвенными способами.

2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты

3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу.
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
Например, уксусная кислота реагирует с бромом в присутствии красного фосфора

4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов.

4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):

4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO 4 + 3H 2 SO 4 → 5CO 2 + 2MnSO 4 + K 2 SO 4 + 8H 2 O

4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:

5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
5.2. Реакции замещения в бензольном кольце
Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
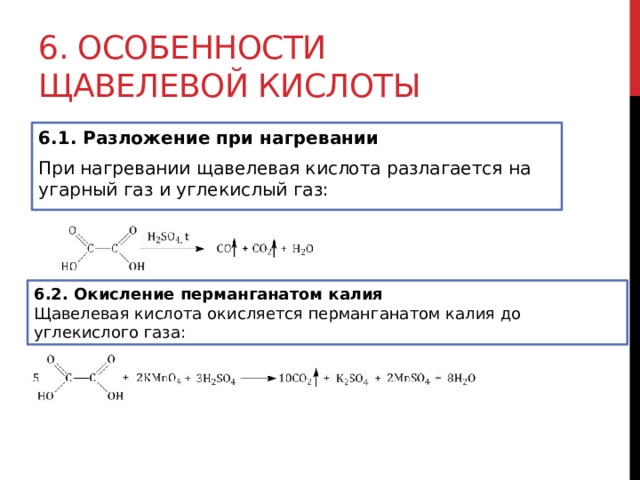
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:

7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:

7.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:

Получение карбоновых кислот
1. Окисление спиртов, алкенов и алкинов
При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия образуются карбоновые кислоты.
Например, при окислении этанола в жестких условиях образуется уксусная кислота

2. Окисление альдегидов
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота.
Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты

3. Щелочной гидролиз тригалогенидов
Тригалогеналканы, в которых три атома галогена расположены у одного атома углерода, с избытком щелочи образуется соль кислоты. При этом сначала происходит замещение галогенов на группы ОН.
Образуется неустойчивое вещество, которое распадается с отщеплением воды:
Так как щелочь в избытке, то образуется не сама кислота, а её соль:

4. Получение карбоновых кислот из солей
Карбоновые кислоты можно получить из солей действием минеральной кислоты на раствор соли:
Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты:

5. Гидролиз сложных эфиров
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:
Например, метилацетат гидролизуется в кислой среде:

6. Кислотный гидролиз жиров
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин

7. Получение муравьиной кислоты из угарного газа
Соль муравьиной кислоты получают нагреванием оксида углерода (II) с твёрдым гидроксидом натрия под давлением:

8. Каталитическое окисление бутана
Уксусную кислоту в промышленности получают каталитическим окислением бутана:

9. Получение бензойной кислоты
Бензойную кислоту получают окислением гомологов бензола раствором перманганата калия в кислой среде.
Например, при окислении толуола образуется бензойная кислота:

10. Взаимодействие реактива Гриньяра с углекислым газом
При взаимодействии реактивов Гриньяра (алкилгалогенидов магния) с углекислым газом и последующем гидролизе образовавшегося промежуточного продукта образуется карбоновая кислота.























































