Интегрированный урок (физика + химия) по теме "Электролиз" (9 класс)
Тема: Электролиз
Цель урока:
Изучить сущность процесса электролиза и выяснить области его применения.
Задачи урока:
Образовательные:
Используя межпредметные связи создать информационно-образовательную среду, позволяющую обеспечить усвоение учащимися электрохимических процессов при электролизе;
усвоение учащимися понятий: гальваностегия, гальванопластика, рафинирование;
систематизировать знания учащихся о практическом применении электролиза.
Развивающие:
развитие познавательных умений (умение выделять главное, вести конспект, наблюдать, выполнять задания, объяснять результаты опытов, выдвигать гипотезы, классифицировать);
развитие мышления (логического, аналитического, синтезирующего).
Воспитательные:
воспитание положительного отношения к знаниям;
воспитание характера на пути достижения поставленной цели (при решении задач, добывания необходимой информации при работе с источниками).
Планируемый результат обучения, в том числе формирование УУД:
Познавательные УУД: самостоятельное выделение и формулирование познавательной цели, умение осознано и произвольно строить речевые высказывания в устной форме, поиск и выделение необходимой информации, умение наблюдать, анализировать, обобщать делать выводы.
Коммуникативные УУД: планирование учебного сотрудничества – определение цели, способов взаимодействия, умение с достаточной полнотой и точностью выражать свои мысли.
Регулятивные УУД: целеполагание как постановка учебной задачи на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё неизвестно; планирование; оценка, выделение и осознание того, что уже усвоено и что ещё подлежит усвоению, оценивание качества и уровня усвоения
Личностные УУД: смыслообразование, установление связи между целью учебной деятельности и её мотивом, адекватное самовосприятие, адекватное оценивание себя, других
Личностные:
Формирование целеустремленности, ответственного отношения к учению, создание основы для формирования интереса к углублению химических и физических знаний и выбора данных предметов в качестве сферы своей профессиональной деятельности.
Метапредметные:
Формирование коммуникативной компетентности в образовательной деятельности (умение слушать партнера, аргументировать свое мнение).
Овладение навыками самостоятельного приобретения знаний, формулирование выводов и заключений, развитие умений извлекать информацию из различных источников (схем, демонстрационных опытов).
Осуществление рефлексии в отношении действий по решению учебных задач, понимание проблемы, умение выдвигать гипотезы, давать определение понятиям.
Предметные:
Понять суть электролиза, дать определение понятию, вывести правила, осознать роль процесса.
Описывать демонстрационные опыты, используя язык химии и физики.
Оборудование: прибор для электролиза, амперметр, растворы электролитов, алюминиевая ложка, модель кристаллической решетки хлорида натрия, интерактивная доска, презентация, инструктивная карта урока, приложения, инструкции.
Тип урока: Урок усвоения новых знаний
Технологии обучения: проблемные технологии, интерактивные технологии.
Методы обучения: исследовательский, метод аналогий.
План урока. (88 мин)
Организационный момент – 3 мин.
Мотивация учебной деятельности. Сообщение цели и задач урока-14 мин
Выявление, актуализация и корректировка опорных знаний- 6 мин
Изучение нового материала – 50 мин
Проверка знаний –7 мин.
Подведение итогов – 4 мин.
Домашнее задание – 3 мин.
Рефлексия –1 мин.
Ход урока
Учитель физики
Добрый день, друзья! Мы рады вас видеть!
Вы работаете в команде и оценка за урок зависит от итогов работы команды. А наиболее активные участники урока получат ещё и дополнительную оценку.
Девизом нашего урока будут слова поэтессы Маргариты Алигер (кадр 1)
«О, физика, наука из наук
Все впереди так мало за плечами
Пусть химия нам будет вместо рук,
Пусть математика очами станет.
Не разлучайте этих трех сестёр
Познания в подлунном мире
Тогда лишь будет ум и глаз остёр
И знанье человеческое шире.»
1. Организационный этап
Преподаватель химии: Здравствуйте, мы в 9 классе рассмотрели теоретически процессы, проходящие при диссоциации. Ребята, сегодня мы закрепим и обобщим знания и практические умения по данной теме, не совсем обычно. Мы проведем интегрированный урок химии с физикой.
Преподаватель физики: Физика и химия – необыкновенные науки. Их законы универсальны. Они с успехом объясняют свойства кристаллов и живых клеток, помогают производить стыковку космических кораблей и выполнять сложнейшие операции. Сегодня мы рассмотрим связь между физикой и химией на примере одного процесса.
2. Мотивация учебной деятельности. Сообщение цели и задач урока.
Учитель химии
Постановка проблемы:
Наш сегодняшний урок мне хотелось бы начать с античной легенды:
«Некий мастер, имя которого история не сохранила, принес римскому императору Тиберию, правившему в начале I века н.э., чашу из металла, напоминающего серебро, но только более легкого. Подарок стоил жизни изобретателю: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро императорской сокровищницы». Согласно рассказу Плиния Старшего, этот металл, похожий на серебро, был получен из «глинистой земли».
Но история не знает безвозвратных потерь. В 1827 году немецкий ученый Фридрих Вёлер получает несколько граммов, а через несколько лет уже несколько килограммов нового легкого, прочного, блестящего металла. Но металл стоил также дорого, как серебро.
Французы изготовили из него кирасы охранникам императора и игрушки наследнику Его Величества. В этом ларце находиться изделие из этого металла. Оно необходимо каждому из нас. Что же находиться в ларце? (ответивший на вопрос достает из ларца алюминиевую ложку.)
(В презентации есть 2 подсказки, если будут затрудняться с ответом).(кадры 2,3)
Кстати, в 1852 году это чайная ложечка весом 25 граммов стоила бы 30 долларов.
Найдите, пожалуйста, на географической карте России, центры получения алюминия. (кадр 4)
Учащиеся называют города Волгоград, Красноярск, Братск, Шелехов.
Учитель физики
Почему же именно в этих городах расположены крупнейшие заводы по производству алюминия? Назовите факторы, влияющие на размещение производства. (Работа в группах и обсуждение. Смотри приложение 5)Один представитель группы выбирает задание для группы.
Учащиеся констатируют факт расположения заводов по производству алюминия вблизи крупных электростанций.
Таким образом, мы пришли к выводу, что для получения алюминия необходимы значительные затраты электроэнергии.
И мы сегодня вторгаемся в область электрохимии, и наш урок будет посвящен проблеме электролиза солей, одного из самых сложных и важных физико-химических процессов. Это понятие дается и в курсе физики, и в курсе химии.
Следовательно, попробуйте определить тему нашего урока («Электролиз). Запишите ее, пожалуйста, в инструктивную карту. (кадр 5)
Учащиеся записывают тему урока.
Как вы считаете, что является целью нашего урока?
Сегодня на уроке нам предстоит изучить сущность процесса электролиза и выяснить области его применения.(предполагаемый ответ учащихся)(кадр 6)
Учитель химии:
И наша задача: изучить процесс электролиза с точки зрения теории электролитической диссоциации, окисления и восстановления.
Учитель физики.
А также рассмотреть законы электролиза, которые были экспериментально установлены английским физиком Майклом Фарадеем. И, конечно же, ответить, на главный вопрос - где и с какой целью можно использовать этот процесс в практической деятельности.
3. Выявление, актуализация и корректировка опорных знаний.
Учитель химии:
Что же называется электролизом? «электро» – электрический ток, «лизис» –разложение. (кадр 7)
Следовательно,(работа с презентацией)
Электролиз – это окислительно–восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. (кадр 8)
Учащиеся записывают определение в инструктивную карту.(по презентации)
Учитель физики: Проверочная беседа.
Давайте посмотрим еще раз на определение электролиза и вспомним все основные понятия данного процесса.
1) Что представляет собой электрический ток? (Направленное движение заряженных частиц)
2) Назовите условия возникновения электрического тока? (наличие свободных заряженных частиц, источник тока)
3) Каковы действия электрического тока? (тепловое, магнитное, химическое, физиологическое)
Остановимся на химическом действии тока. В презентации вы видите «Первый закон Фарадея», запишите формулу в инструктивную карту. m=K*q=K*I*t
K- Электрохимический эквивалент вещества. (кадр 9)
Учитель химии:
Ребята:
А могут ли пропускать электрический ток расплавы и растворы других веществ помимо металлов? (да)
Как называются такие вещества? (электролиты)
Что же происходит при расплавлении и растворении электролитов, почему они становятся проводниками электрического тока? (появление заряженных частиц – ионов)
Как называется процесс распада молекул электролита на ионы при их расплавлении и растворении? (электролитическая диссоциация). (кадр 10)
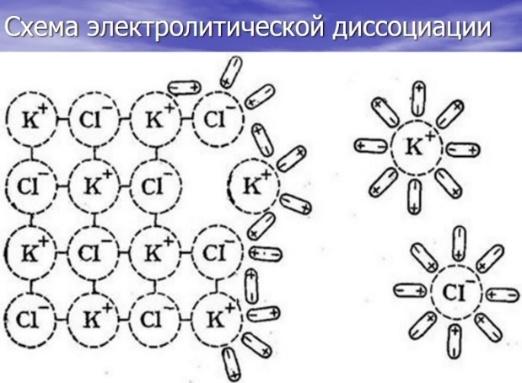
Итог сказанного (подводит учитель химии):
Итак, образовавшиеся в результате диссоциации молекул электролита ионы, свободно перемещаются друг относительно друга.
За чрезвычайные заслуги создания теории электролитической диссоциации» в 1902г. Сванте Аррениус (шведский химик) стал лауреатом Нобелевской премии.
4. Изучение нового материала. Создание проблемной ситуации.
Итак, электролиты распались на ионы.
При расплавлении NaCI диссоциирует на ионы. Напишите уравнение диссоциации NaCI.
Учащиеся записывают в инструктивной карте диссоциацию хлорида натрия.(по кадру 10)
А что же будет происходить с этими ионами при пропускании электрического тока?
4.1 Электролиз расплава хлорида натрия.
Давайте рассмотрим электролиз расплава хлорида натрия.
Прибор, в котором осуществляется электролиз, называется электролизером(лабораторный) или электролитической ванной(промышленный). (кадр 11)
Он состоит из стеклянной трубки и электродов, являющихся проводниками между электрическим током и проводящей средой.
Вспомните, как называются данные электроды? (Катод и анод)
Учащиеся записывают определение в инструктивную карту.
Отрицательно заряженный электрод называется катод и условно обозначается К(-).
Положительно заряженный электрод называется анод и обозначается А(+).
Под действием электрического тока катионы Na+ движутся к катоду, где принимают от него электроны. (кадр 12)
(кадр 13) Na+ +e = Na0- процесс восстановления.
(Восстановление- это процесс принятия электронов).
Анионы Cl – движутся к аноду и отдают электроны:
2Cl - - 2e = Cl20- процесс окисления.
(Окисление- это процесс отдачи электрона).
Согласно определению, электролиз является окислительно-восстановительным процессом, так происходит изменение степени окисления элементов.
Давайте запишем молекулярное уравнение электролиза.
2NaCl ====2Na + Cl2
Какое вещество образуется на катоде?
Какое вещество образуется на аноде?(предполагаемые ответы учащихся)
Вывод: на катоде выделяется металлический натрий, а на аноде – газообразный хлор.
Сообщение учителя.
В результате расплава получают активные металлы, 70% Mg, большое количество K, Li, Ca, Ba, Sr, Be, Mn, а также тугоплавкие металлы: титан, W, Mo, V, ниобий. Эти металлы широко используются в авиации, космонавтике, атомной промышленности, электротехнике, медицине. Практически весь алюминий в настоящее время получают электролизом расплава оксида алюминия, содержащегося в глиноземе и бокситах. Из расплавов получают также галогены – хлор, фтор.
В 1886 г. Анри Муассан после многих попыток впервые получил несколько пузырьков газообразного фтора электролизом безводного фтороводорода и был удостоен за свой способ получения Нобелевской премии.
4.2 Электролиз водного раствора электролита.
Учитель физики:
Чем электролиз раствора соли отличается от электролиза расплава? Я думаю, что после небольшого исследования вы, ребята, сможете найти ответ не только на этот вопрос ,но и помочь врачу Дональду Чейзу, главному герою фантастического произведения Гарри Гаррисона «Космический врач».
Сюжет данного произведения: с космическим кораблем произошла авария, из офицерского состава в живых остался врач Дональд Чейз, к которому переходит командование кораблем. Дональду приходится решать множество проблем, одна из которых - нехватка кислорода на борту, т.к. многие его производители – зеленые одноклеточные водоросли – погибли. «…Где взять кислород в глубине межпланетного пространства? Думай! Он вбивал все это в свой утомленный мозг, но там была лишь полная пустота. И, тем не менее, его терзала мысль, что ответ находится прямо перед глазами. Единственной вещью, находящейся перед ним, были водоросли в их водяной купели. Они делали все, что могли, он знал это, и, тем не менее, ответ где-то здесь. Но где?..»
Учитель физики:
Вопрос: Имеет ли практическое применение прохождение тока через растворы жидкостей?
А что произойдет, если мы в растворе электролита создадим электрическое поле? (возможные ответы)
Пояснение учителя физики: подвижные ионы примут направленное движение: «-» ионы будут притягиваться к «+» электроду – аноду. Поэтому они называются (можно спросит учащихся) анионами. А «+» ионы – к «-» электроду – катоду. Поэтому они называются (можно спросить учащихся) катионами. Мы получим электрический ток, текущий в двух направлениях.
Поскольку носителями электрического заряда являются частицы вещества, можно предположить, что на электродах произойдет его (вещества) выделение. Можем ли мы это увидеть? Можем ли мы измерить силу тока в растворе электролита? На эти вопросы даст ответ эксперимент.
А, сейчас проведем эксперимент прохождения электрического тока через раствор соли NaCl.
Перед проведением эксперимента вспомним технику безопасности:
убрать со стола все лишнее
следует строго соблюдать правила работы с электрическими приборами, замыкание и размыкание ключа проводить строго с разрешения учителя
включать собранную электрическую цепь только после проверки учителем
не допускать разбрызгивания электролита
при попадании раствора химического вещества на кожу рук её немедленно промыть водой с мылом
по ходу выполнения эксперимента сделать записи определений новых понятий в инструктивную карту.
Пояснение учителей по ходу эксперимента. (кадр 14)

Учитель физики:
Я думаю, что теперь вы сможете ответить на вопрос, поставленный перед изучением темы: где взять кислород на борту космического корабля? Ответ – получить его электролизом воды, в которую добавлена нужная соль.
На борту МКС путем электролиза система «Электрон» разделяет молекулы воды на водород и кислород; последний идет в атмосферу станции, первый – за борт.
Учитель химии.
Проведем исследование электролиза раствора сульфата меди (II) – CuSO4.
А ваша задача после исследования электролиза сульфата меди, записать уравнение диссоциации сульфата меди. В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды, которые также могут участвовать в процессе окисления и восстановления на электродах.
Для написания уравнения электролиза нам понадобится инструкция, которая находится у вас на столах.
Записать уравнение диссоциации сульфата меди.
В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды, которые также могут участвовать в процессе окисления и восстановления на электродах.
Схема процесса:

Для подбора коэффициентов используем метод электронно-ионного баланса:

Признаки реакции: выделение красной металлической меди на катоде и кислорода (газа, вызывающего загорание тлеющей лучины) на аноде. (кадр 15)
Учитель физики:
Тема «Электролиз» тесно связывает две науки: химию и физику. Законы электролиза, основные понятия заложил физик Фарадей. А М. В .Ломоносов говорил о том, что , « сии две науки так соединены между собой, что одна без другой в совершенстве быть не могут. ….»
4.3 А теперь решим задачи:
Задачи по электролизу можно решать химическим и физическим способами.
Задача №1: Рассчитайте массу меди, полученной при электролизе водного раствора сульфата меди c графитовыми электродами, если на аноде выделилось 6,4 г кислорода. (кадр 16)
Как будем решать эту задачу?
По химическому уравнению.
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
2 моль 1 моль
n(O2) = 6,4/32 = 0,2 моль
n(Cu) = 2n(O2) = 2×0,2моль = 0,4моль
m(Cu) = 0,4 моль×64 г/моль = 25,6 г
(кадр 17)
Задача №2: Рассчитайте время получения данной массы меди (25,6 г), при показании амперметра 10 А, К=0,33*10-6кг/Кл. (кадр 18)
Как будем решать эту задачу?
По закону электролиза (по закону Фарадея)
m(Cu) = k(Cu) It (кадр 19) t= m/k*I= 25,6*10-3кг/10А*0,33*10-6кг/Кл = 7636с=2ч
Учитель физики: Мы с вами решили задачу двумя способами, и нашли массу меди, а где это может быть применено (получение металлов, электрометаллургия).
Любое научное открытие интересно только тогда, когда находит практическое применение. Сегодня на уроке мы узнали, что электролиз широко используется в
В электрометаллургии:
получение активных щелочных, щелочноземельных металлов, алюминия, магния (K, Na, Ca, Mg, Al и др.) электролизом расплавов природных соединений;
В химической промышленности: получение газов: F2, Cl2, H2, O2; щелочей: NaOH, KOH и др.
Однако, электролиз находит широкое применение не только в промышленности, но и в искусстве.
4.4 Сообщения учеников.
1. Гальванопластика
2. Электролитическое рафинирование.
3. Гальваностегия
4.Электроэпиляция (косметология)
Завершение сообщений учеников о применении электролиза кадрами из презентации (кадры 20-25)
5. Проверка результативности совместной работы.
Учитель химии
Итоговое тестирование. (кадр 26)
Сейчас, предлагаю вам написать небольшой тест, который находится у вас на столах. Ответы: да, нет (1 общий ответ от команды)
Проверим правильность ваших ответов.(взаимопроверка - команды обмениваются работами, на презентации появляются правильные ответы, каждый верный ответ - 1 балл)(кадр 27)
6. Подведение итогов урока.
Считаются баллы команд и выставляются оценки за работу
1 место - 52
2 место - 5
3 место - 4
4 место - 4
Учителя называют фамилии учащихся, получивших дополнительные оценки.( Это те учащиеся, которые делали сообщения(4 человека - "5") и те, кто наиболее активно работал на уроке ("5").
7.Домашнее задание (объявить)
Оно есть в инструктивных картах.
1. Инструктивная карта (знать)
2. Занимательные проблемы: (решить)
(историческая)
-Институт прикладной физики Китайской академии наук сообщил о результатах исследования гробницы полководца Джоц-Чжу, похороненного в 237 г н. Спектральный анализ орнамента украшающего саркофаг показал, что он состоит из сплава содержащего 85% Al 10% меди 5% Mg.
Как могли древние китайские мастера получить сплав?
(современная)
-Водород, полученный электролизом воды, экономически выгодное и экологически чистое топливо? Где можно использовать это топливо?
Представители немецкой компании Siemens считают, что именно водород, полученный электролизом воды, может обеспечить энергетическую независимость Германии. Амбициозные планы Германии включают полную реструктуризацию энергетической экономики к 2020 году на 30%, а к 2050-на 80%. Для этого необходимо строительство заводов электролиза, которые будут выделять из воды водород для дальнейшего хранения и распределения. Далее водород может использоваться в привычных газотурбинных генераторах или как топливо для автомобилей. Такой водородный запас также поможет сгладить нерегулярность поставок энергии и обеспечить достаточное количество электричества в пики потребления.
8.Рефлексия «Лестница знаний» (кадр 28)
Оцените свою деятельность на лестнице знаний:
-Все понимаю, все получится;
-Понимаю, но нужно еще поработать;
-Плохо понимаю новый материал.
Прошу поднять руку тех учеников, которые оценивают себя - все понимаю, все получится;
Прошу поднять руку тех учеников, которые оценивают себя - понимаю, но нужно еще поработать;
Прошу поднять руку тех учеников, которые оценивают себя - плохо понимаю новый материал.
Считаем количество.
Каждый ученик должен оценить свою работу на уроке, заполнив лист самооценки.
Молодцы! Всем спасибо. (кадр 29)
Приложение 1
Команда №
Итоговое тестирование.
1.Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием электрического тока?
2.На катоде происходит процесс электрохимического окисления?
3.Катион Na + будет восстанавливаться на катоде в водном растворе?
4.Анион Cl – будет окисляться на аноде в водном растворе?
5.При электролизе расплава NaCl можно получить Na и Cl2
Баллы: _______________
Приложение 2

Приложение 3
Инструктивная карта урока
Тема урока____________________________________________
Электролиз- это __________________________________________
_________________________________________________________
__________________________________________________________
Первый закон Фарадея
1.Электролиз расплава NaCI
NaCI
К А
2.Электролиз раствора NaCI
NaCI
К А
3.Электролиз раствора СиSO4
СиSO4
К А
Задача №1: Рассчитайте массу меди, полученной при электролизе водного раствора сульфата меди c графитовыми электродами, если на аноде выделилось 6,4 г кислорода.
Задача №2: Рассчитайте время получения данной массы меди (25,6 г), при показании вашего амперметра, К=0,33*10-6кг/Кл
Домашнее задание:
1. Инструктивная карта. (Знать.)
Занимательные проблемы: (решить)
2. Институт прикладной физики Китайской академии наук сообщил о результатах исследования гробницы полководца Джоц-Чжу, похороненного в 237 г н.э. Спектральный анализ орнамента украшающего саркофаг показал, что он состоит из сплава содержащего 85% Al 10% меди 5% Mg.
Как могли древние китайские мастера получить сплав?
3. Водород, полученный электролизом воды, экономически выгодное и экологически чистое топливо? Где можно использовать это топливо?
Приложение 4.
Инструкция
Для определения результатов электролиза водных растворов существуют следующие правила:
Процесс на катоде не зависит от материала катода, а зависит от положения металла в электрохимическом ряду напряжений.
1. Если катион электролита находится в начале ряда напряжений (по Al включительно), то на катоде идёт процесс восстановления воды (выделяется Н2). Катионы металла не восстанавливаются, остаются в растворе.
2. Если катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
3. Если катион электролита находится в ряду напряжений после водорода, то на катоде идёт только процесс восстановления ионов металла.
Катодные процессы в водных растворах солей.
| Электрохимический ряд напряжений металлов |
| Li, K, Ca, Na, Mg, Al | Mn, Zn, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
|  - не восстанавливается - не восстанавливается
2Н2О + 2ē = Н2↑ + 2ОН‾ |  + nē = + nē = 
2Н2О + 2ē = Н2↑ + 2ОН‾ |
|  + nē = + nē =   
|
Процесс на аноде зависит от материала анода и от природы аниона.
Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идёт процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идёт процесс окисления воды (выделяется кислород); анион не окисляется, остаётся в растворе.
Анодные процессы в водных растворах.
| Анод | Кислотный остаток  |
| бескислородный | кислородсодержащий |
| Нерастворимый | Окисление аниона (кроме фторидов)  - mē = - mē = 
| В кислой, нейтральной средах: 2Н2О – 4ē = О2↑ + 4Н+ |
Приложение 5
1.Почему в городе Братск расположен алюминиевый комбинат? Назовите факторы, влияющие на размещение производства.
2.Почему в городе Волгоград расположен алюминиевый комбинат? Назовите факторы, влияющие на размещение производства.
3.Почему в городе Красноярск расположен алюминиевый комбинат? Назовите факторы, влияющие на размещение производства.
4.Почему в городе Шелехов расположен алюминиевый комбинат? Назовите факторы, влияющие на размещение производства.
Ответ.
1. Рядом есть месторождения руды (Кроме Волгограда, там привозное сырьё, в остальных городах - местное).
2. Энергоресурсы (название ГЭС) (дешёвая электроэнергия)
3. Вода (название реки)
Дополнительные вопросы.
1. Какие электростанции? (ГЭС)
2. Где они строятся? (На реках)
3. Назовите реку, на которой стоит ГЭС и название ГЭС.
Братск - Братская ГЭС на реке Ангаре
Волгоград - Волжская ГЭС на реке Волге
Красноярск - Красноярская ГЭС на реке Енисее
Шелехов - Иркутская ГЭС на реке Ангаре
Литература:
1. Г.Я. Мякишев, О.А. Крысанова. Физика 10 – 11 классы. Углубленный уровень.Рабочие программы. Физика. 10 – 11 классы. Углубленный уровень: учебно-методическое пособие / сост. И.Г. Власова. – М.: Дрофа, 2013. – 314 с.
2. Мякишев. Г.Я. Физика: Электродинамика. 10 - 11 кл. Углубленный уровень: Учебник / Г.Я. Мякишев, А.З. Синяков. – 3 – е изд., стереотип – М.: Дрофа, 2015. – 476.
3. Рымкевич А.П. Физика. Задачник. 10-11 кл.: - 5-е изд., перераб. - М.: Дрофа, 2015. 192с.:ил.
4. Химия. 11 класс: Профильный уровень: учебник для учащихся общеобразовательных учреждений/ О.С. Габриелян, Г.Г. Лысова. -14-е изд., стереотип. – М.: Дрофа, 2014, 2015.- 398, [2] c. : ил





















