3
Урок по теме «Среда водных растворов».
Цель: Рассмотреть количественные характеристики кислотной, щелочной и нейтральной среды водных растворов, используемых в повседневной жизни веществ.
Задачи:
1. Сформировать представление о водородном показателе рН.
2. Сформировать умение проводить химический эксперимент по установлению типа реакции среды.
3. Научить определять рН, пользуясь эталонной шкалой и устанавливать тип реакции среды водных растворов.
Оборудование: Реактивы: Желудочный сок, туалетное мыло, мыло «Dove», таблетка «Гастала», почвенная вытяжка, талая вода, универсальный индикатор (полоски бумаги). Эталонная шкала для рН (цветная).
Основные понятия темы:
Водородный показатель. Кислотная, нейтральная, щелочная среда водных растворов.
Методы: Исследовательский метод.
Тип урока: изложение нового материала.
Методы и приемы обучения: словесно – наглядно, практически;, работа в группах.
Ход урока.
1.Организационный момент.
Здравствуйте, ребята. Наше занятие сегодня будет не совсем обычным, уже потому что это последний открытый урок для вас в нашей школе. Вы уже давно повзрослели и совсем скоро вступите во взрослую жизнь.
Но в любом возрасте мы любим, читать и слушать сказки, взрослея мы находим новы книги сказок-фентези. Сейчас я прочитаю вам небольшой отрывок из книги «Странствия мага», автор книги Ник Перумов. А вы постарайтесь нарисовать, создать образы в своем воображении. Закройте глаза и послушайте меня и пусть звуки дождя помогут вам в этом.
Аудио: Шум дождя и грозы. Слайд № 1 Гроза
«…Им было нелегко последние столетия, в населённых землях исчезали, их адепты, капища сносились, тяжёлые молоты дробили в мелкую пыль алтари и жертвенники. Первобытные племена отступали всё глубже и дальше под напором того, что потом стало именоваться «прогрессом» и «культурой».…Шаманы совещались - как всегда, мысленно, без слов. Они не могли победить
… Племенам суждено погибнуть…Они не могут принять рабства. Значит, они могут только умереть. Вопрос только в том как.
И тогда военные вожди отдали приказ к атаке. В неё пошли все, от мала до велика, все уцелевшие, включая женщин и детей.
Небеса набрякли чёрным. Алые молнии вспороли подбрюшья туч, первые крупные капли иссиня-чёрного дождя устремились к земле. Гром грохотал непрерывно, тучи опускались всё ниже и ниже, словно решив наконец познакомиться с землей, над которой всё время лишь и длился их бесконечный полёт. Войско южан попятилось.
Чёрный дождь хлестнул по замершим рядам южан. Кто-то первым закричал от невыносимой боли- капли обжигали, словно кипяток, но мало того, они разъедали плоть, так что из-под её лохмотьев быстро начали проглядывать кости. Пытаясь прикрыться щитами, южане побежали, но в этот миг их настигли. «Дикари» пробежали отделявшее их от врага расстояние. Их точно так же жёг чёрный дождь, они точно так же падали под ноги своих товарищей. А черные облака, сея смерть, опустились наконец до самой земли, и битва стихла сама собой. А потом чёрные облака стали медленно рассеиваться. Мертвы были все - и те, кто защищался, и те, кто нападал…..»
2. Изучение материала
Вопросы для фронтальной беседы с учащимися:
Как вы думаете, что же за чудовищный дождь описывает, Ник Перумов в своей книге?
Фантастика, скажете вы красивая, но страшная литературная аллегория? А может быть это реалии нашего времени?
Видеофрагмент – кассета «Кислотные дожди».
Слайд № 2 Кислотный дождь
Сам термин «кислотный дождь» существовал уже более 100 лет, впервые его использовал британский исследователь Роберт Ангус Смит в 1882 году
Из истории наблюдений за кислотными дождями (ученик)
Впервые кислотные дожди были отмечены в Западной Европе и Северной Америке в 50 г. 20 века.
В среднем кислотность осадков, выпадающих в виде дождя в Западной Европе и Северной Америке на 10 млн. км2, составляла 3–4,5, а туманы нередко имели рН, равный 3–2,5. Дождевая вода, образующаяся при конденсации водяного пара, должна иметь pH. Но даже в самом чистом воздухе имеется углекислый газ и дождевая вода, растворяя его чуть подкисляется (pH 5,6 – 5,7).. Уменьшение рН на одну единицу означает увеличение кислотности в 10 раз, на две — в 100 раз и т.д. Мировой рекорд принадлежит шотландскому городку Питлокри, где 20 апреля 1974 г. выпал дождь с рН 2,4, — это уже не вода, а что-то вроде столового уксуса.
В последние годы кислотные дожди стали наблюдаться в промышленных районах Азии, Латинской Америки и Африки.
В России наиболее высокие уровни выпадений кислотных осадков наблюдаются в густонаселенных и промышленных регионах: центральном, центрально-черноземном, Уральском. На локальных ареалах (до 1 тыс. км.) около металлургических предприятий, крупных ГРЭС, больших городов (Москва, Омск и др.)
Слайд № 3
«Кислотный дождь» – это дождь, подкисленный до рН
1) Хотели бы вы знать, какой дождь капает Вам на голову?
2) Что тогда для этого тогда нужно знать? (обратитесь к определению, что вам из него неизвестно - рН )
Тема нашего урока:
Как узнать какой дождь капает нам на голову или что такое «рН - растворов»?
Слайд №4: Среда растворов. Водородный показатель.
Беседа с классом.
Какие ионы обеспечивают кислую среду?
Какие - щелочную?
В каком случае мы можем сказать, что среда нейтральная?
[Н+]= [ОН-]=10-7 моль/л
Тогда как можно записать выражение для кислой и щелочной сред?
[Н+][ОН-] – кислая среда
[Н+]10-7 моль/л
[Н+]-] – щелочная среда
[Н+]-7 моль/л
Для дальнейшего разговора введем новое понятие: константа диссоциации воды, ионное произведение воды, водородный показатель.
Вода – слабый электролит, диссоциирующий на ионы H+ и OH- - анионы.
Н2О↔Н++ОН-
КН2О= [Н+]·[ОН-]
КН2О=10-14 при 25°С
Этому процессу соответствует константа диссоциации воды:
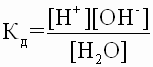 ,
,
так как диссоциирует ничтожная часть молекул воды, то [H2O] – постоянная величина (знаменатель)
Кд* [H2O] = К H2O = [H+] [OH-] – ионное произведение воды,
К H2O = 1*10-14 (при 25° С)К H2O = [H+] [OH-]= 10-14
К H2O – величина постоянная.
Как будет выглядеть выражение для концентрации Н+ и ОН -, используя выражение для константы диссоциации?
Зная [H+] , можно вычислить [OH-] и наоборот.
При [H+] = [OH-] = 10 -7 моль/л – среда нейтральная
При [H+] [OH-], [H+ ] 10-7 моль/л – среда кислая
При [H+] -], [H+ ]-7 моль/л – среда щелочная
Водородный показатель (рН)
В воде всегда присутствует немного катионов водорода и гидроксид-ионов, которые образуются в результате обратимой диссоциации:
H2O → H+ + OH-
В 1 л чистой воды при комнатной температуре содержится 1 .10-7 моль катионов водорода и 1 .10-7 моль гидроксид-ионов.
Поскольку оперировать числами такого порядка неудобно, для количественной характеристики кислотности среды используют так называемый водородный показатель рН .
Это понятие было введено в 1909 году датским химиком Сёренсеном.
Водородный показатель pH – это показатель кислотности (или щелочности) раствора.
Показатель называется pH, по первым буквам латинских слов potentiahydrogeni — сила водорода, или pondushydrogenii — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную -lgX, а буква H в данном случае обозначает концентрацию ионов водорода (H).
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH-] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию.
При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] [OH-] говорят, что раствор является кислым, а при [OH-] [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
Водородный показатель pH , который определяется как отрицательный десятичный логарифм концентрации ионов водорода [H+]
pH = - lg [H+]
Каково же количественное соотношение между pH и концентрацией ионов водорода?
Задача 1(ученик):
Вычислим pH нейтрального раствора, т.е. раствора, когда
[H+] = [OH-] = 1*10-7
pH = -lg [H] = -lg (1*10-7) = - lg1 + (-lg 10-7 )= 0 +7*1=7=
pH нейтрального раствора равен 7 (т.е. показатель степени и есть пэ-аш)
Задача 2. Определите среду раствора, если рН = 5, рН=12, рН=9, рН= 3.
Задача 3. Определить концентрацию гидроксид-ионов, если концентрация ионов водорода равна 10-3 моль/л.
Ответ. [ОН-]=10-11моль/л;
если pH = 7 – среда нейтральная – дистиллированная водаpH
pH 7 - среда щелочная –(раствор мылаpH=9; 10 -9; pOH =5; 10-5)
pH-2; pOH =12, 10-12)
В частности, при 25°С pH + pOH = pH2O = 14
Учитель:
Давайте вспомним начало урока, ответили ли мы на вопрос: « Как узнать какой дождь капает нам на голову или что такое «рН - растворов»?»
Ответы учащихся: Лишь наполовину, что такое пэ-аш. Как узнать – нет
Как можно определить pH раствора, т. е. его среду?
1.Экспериментально, с помощью индикатора.
2. Сегодня мы узнали, что можно узнать путем вычисления, т. е. расчета.
3. Групповая работа.
Iгруппа – математики
Самостоятельное решение учащимися задач и проверка результатов.
Алгоритм:
Внимательно прочитайте условия задачи.
Запишите дано. Определите, что вам необходимо найти.
Запишите формулу для решения задачи, если необходимо, преобразуйте ее для нахождения неизвестной вам величины.
Проведите расчет. Запишите ответ.
Задача 1. В 1974 году в Шотландии зафиксирован европейский "рекорд" по значению кислотности атмосферных осадков. Водородный показатель для дождевой воды оказался равен 2,4. Рассчитайте для этого случая концентрацию катионов Н+ в шотландском "кислотном дожде". Ответ: [Н+] = 4 . 10--3 моль/л
Задача 2. Концентрация ионов водорода в желудочном соке человека 0,150 моль/л. Рассчитайте pH желудочного сока.
Задача 3. Во сколько раз концентрация ионов водорода в крови (pH = 7,36) меньше чем в желудочном соке?
Задача 4. На предприятии не хватило запаса соды для нейтрализации кислотных отходов, и 3,15 кг азотной кислоты были вылиты в канализацию, а оттуда попали в пруд емкостью 10000 м3. После этого в пруду погибла вся рыба, даже такая неприхотливая, как плотва. Определите водородный показатель воды, загрязненной азотной кислотой.
IIгруппа– химики
«Определение рН водных растворов».
Алгоритм:
1)Приготовить водные растворы предложенных веществ.
2)Нанести стеклянной палочкой каплю раствора на универсальную индикаторную бумагу.
3)Сравнить цвет бумаги по шкале на коробочке.
4)Записать значение рН исследуемого раствора
Лабораторный опыт «Исследование среды раствора».
Исследуйте при помощи универсального индикатора среду раствора предложенных веществ. Для этого пипеткой или стеклянной палочкой нанесите каплю исследуемой жидкости на полоску индикаторной бумаги. Сравните со шкалой.
Для твердых веществ: намочите индикаторную бумагу водой и приложите на несколько секунд к исследуемому веществу.
Внесите результаты в таблицу (+)
| [Н+] моль\л | 100 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | 10-8 | 10-9 | 10-10 | 10-11 | 10-12 | 10-13 | 10-14 |
| рН | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
|
|
|
| Норма |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Вещества |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Желудочный сок |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Раствор туалетного мыла |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Раствор мыла «Dave» |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Таблетка гастала |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Почвенная вытяжка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Талая вода |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Среда раствора | Сильно- кислотная | Слабокислотная | Нейт раль ная | Слабо- щелочная | Сильнощелочная |
Вывод: Сделайте вывод о значении рН среды растворов и влиянии на здоровье человека и окружающую среду.
Какой компонент желудочного сока обуславливает кислотную реакцию среды?
Какой из исследуемых растворов можно использовать для устранения изжоги?
Верхний слой кожи имеет рН =5,5, почему не рекомендуется для частого умывания использовать туалетное мыло?
Почему в известной телевизионной рекламе советуют использовать для ухода за кожей лица мыло «Dove»?
Ответы на вопросы:
Желудочный сок содержит соляную кислоту.
Для устранения изжоги используют раствор питьевой соды или таблетки от изжоги, например «Гастал», для нейтрализации избытка соляной кислоты в желудочном соке.
Возникает сухость кожи, так как раствор мыла имеет щелочную среду.
Мыло «Dove» имеет нейтральную среду и не сушит кожу.
Где вы сможете использовать приобретённые знания?
Выбор косметических средств;
Выбор продуктов питания, при нарушении секреторной функции ЖКТ.
IIIгруппа- биологи.
Прочитайте текст. Выполните задания.
«Воздействие рН на водоем».
Изменение рН воды реки, залива, пруда может повлиять на его флору и фауну. Водяные растения лучше всего растут в воде со значениями рН между 7 и 9.2. С увеличением кислотности водяные растения начинают погибать, лишая других животных водоема пищи. При рН=6 погибают пресноводные креветки и моллюски, их считают хорошими индикаторами загрязнения. Моллюски ведут донный образ жизни, причем прикрепляются к определенным участкам дна. Если этот участок подвержен воздействию загрязняющих веществ (например, тяжелых металлов), то этот загрязнитель попадает и в организм моллюсков. Губительное действие закисления водоемов на различные виды рыб начинается с рН ~ 6,0, Когда кислотность повышается до рН 5.5, погибают донные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон - крошечное животное, которое составляет основу пищевой цепи водоема и питается веществами, образующимися при разложении органических веществ. При рН = 5,6 погибают рыбы, фито- и зоопланктон, часть водорослей. Окунь, щука, сиг, хариус, угорь более устойчивы к кислотному воздействию, и погибают при рН=5,0. Когда кислотность достигает рН 4.5, погибает вся рыба, большинство лягушек и насекомых. При рН = 3,5 все нормальные формы жизни в водоеме исчезают и развиваются патогенные организмы, например белый мох.
Задания: 1.Проведенные исследования в Швеции показали, что при закислении озер происходит гибель обитателей. В какой последовательности будут погибать живые организмы? Ответ представьте в виде таблицы:
2.Как вы думаете, может ли закисление водоемов привести к смене сукцессии одной экосистемы на другую? Приведите доказательство из текста.
3.В какой последовательности будут погибать живые организмы? Ответ запишите в виде шестизначного числа.
Лосось, форель (рН = 5,6)
Окунь, щука, сиг, хариус (рН = 5,0)
Ракообразные, моллюски (рН = 6,0)
Донные бактерии, фито - зоопланктон (рН = 5,5)
Угорь, голец (рН = 4,8)
Насекомые, лягушки (рН = 3,0)
Последний слайд: мы доказали, что знание рН является немаловажным фактором сохранения здоровья человека и постоянства среды. Не хватило времени сказать о влиянии рН на жизнь сухопутных и водных животных, памятники архитектуры и многом-многом другом. Но ведь это еще не последний урок – все еще впереди.
4. Рефлексия Рефлексивный прием, «Мысли во времени» способствующий развитию умения осмысливать свой опыт и давать личностную оценку проживаемому опыту. Ключевое слово ДОЖДЬ.
В течение 1 минуты учащимся необходимо непрерывно записывать свои мысли, которые "приходят в голову" и связаны с заданным словом. По истечении времени. Ученики читают записи про себя. Затем мысленно отвечают на следующие вопросы.
Почему я записал именно эти слова?
О чем я думал, когда писал эти слова?
Чтобы я хотел в записях изменить?
Написанное мной имеет или не имеет для меня значение?
Учитель: Спасибо за урок, всего самого доброго!
3





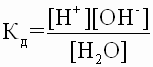 ,
,









