Муниципальный конкурс профессионального мастерства педагогических
работников учреждений общего, дополнительного и дошкольного
образования
«Методическая разработка – 2017»
Использование метода электронно-ионного баланса (метода полуреакций) в новых заданиях ЕГЭ по химии
Автор: Краснокутская Татьяна Юрьевна,
учитель химии и биологии МАОУ «СОШ №21»
г. Миасс Челябинской области
Миасский городской округ
2017г.
Введение
Задания с развёрнутым ответом в ЕГЭ по химии предусматривают комплексную проверку усвоения на углубленном уровне нескольких (двух и более) элементов содержания из различных содержательных блоков. Они подразделяются на следующие разновидности: – 1) Задания, проверяющие усвоение важнейших элементов содержания, таких, например, как «окислительно-восстановительные реакции», «реакции ионного обмена»; – 2) Задания, проверяющие усвоение знаний о взаимосвязи веществ различных классов (на примерах превращений неорганических и органических веществ); –3) Расчётные задачи. Задания с развёрнутым ответом ориентированы на проверку умений: – 1) объяснять обусловленность свойств и применения веществ их составом и строением, характер взаимного влияния атомов в молекулах органических соединений, взаимосвязь неорганических и органических веществ, сущность и закономерность протекания изученных типов реакций; - 2) проводить комбинированные расчёты по химическим уравнениям. В современных заданиях по ОВР ученику самостоятельно предстоит определить среду реакции и продукты этой реакции. В связи с этими тенденциями становится актуальным метод полуреакций, который рассматривается в данной методической разработке.
Цель данной работы показать суть метода полуреакций, которая состоит в двух утверждениях:
а) в этом методе рассматривают переход электронов от одних частиц к другим с обязательным учётом характера среды (кислая, щелочная или нейтральная), что становится актуальным в свете новой демоверсии ЕГЭ по химии в 2017-18 учебном году;
б) при составлении уравнения электронно-ионного баланса записывают только те частицы, которые реально существуют в ходе протекания данной ОВР – в виде ионов записываются реально существующие катионы или анионы; вещества малодиссоциирующие, нерастворимые или выделяющиеся в виде газа пишут в молекулярной форме;
Данная методическая разработка будет полезна для учащихся 9-11 классов ОУ и учителей химии, занимающихся подготовкой учащихся к ОГЭ и ЕГЭ.
План
Введение
-
Основные понятия
-
Окислители-акцепторы электронов
-
Восстановители – доноры электронов
-
Метод полуреакций, правила оформления ОВР протекающих:
-
в кислотной среде
-
в щелочной среде
-
в нейтральной среде.
ОВР – это такие реакции, в которых одновременно протекают процессы окисления и восстановления, и изменяются степени окисления элементов.
Процесс отдачи ē – окисление.
Процесс принятия ē – восстановление.
Частица, отдающая ē – восстановитель.
Частица, принимающая ē – окислитель.
Число отдаваемых ē восстановителем равняется количеству ē, принимаемых окислителем.
Элемент, имеющий максимальную степень окисления (с.о.), может быть только окислителем. Например, N+5 - окислитель
| N+5+5 ē N0 N0 |
окислитель |
| N+5 +1 ē N+4 N+4 |
| N+5 +2 ē N+3 N+3 |
| N+5 +3 ē N+2 N+2 |
| N+5 +8ē N-3 N-3 |
Элемент, имеющий минимальную с.о., может быть только восстановителем. Например, S-2 – восстановитель
| S-2 -2 ē  S0 S0 | восстановитель |
| S-2 -6 ē  S+4 S+4 |
| S-2 -8 ē  S+6 S+6 |
Элемент,имеющий промежуточную с.о., может быть и окислителем и восстановителем.
| S0 +2 ē  S-2 S-2 | окислитель |
| S0 -4 ē  S+4 S+4 | восстановитель |
| S0 -6 ē  S+6 S+6 | восстановитель |
Окислители — акцепторы электронов
1. Окислители, проявляющие окислительные свойства при повышенной или очень высокой температуре:
Cl2 , F2 , КСIО3 , К2FeO4 , КМпО4, КNO3 , K2S2O8 , МпO2, NaBiO3, Na2O2, O2, PbO2, (Pb2IIPblV)O4
2. Окислители, проявляющие окислительные свойства в кислотной среде (вещества расположены по уменьшению окислительной способности):
F2, Na2O2, NiO(OH), (PbIIPblV)O4 O3, K2S2O8 , K2FeO4, NaBiO3, CoO(OH), H2O2, КМпО4, KBrO3, PbO2, Cl2, K2Cr2O7, МпO2, O2,KNO2, KIO3, Br2, HNO3, (конц.), I2, H2SO4(конц.), H+(разб.)
3. Окислители, проявляющие окислительные свойства в щелочной среде:
F2, K2S2O8 , Cl2O3, Na2O2, Br2, H2O2, NaCIO, NaBrO, КМпО4, I2, O2,PbO2, (PbIIPblV)O4, K2Cr2O4, H2O
4. Окислительные свойства проявляют кислородсодержащие соединения галогенов в кислотной среде:
НС1+1O а также соли →Г-1 например НСl, НВг, КСl
НС1+3O2 а также соли →Г-1 например НСl, НВг, КСl
НСI+5O3 а также соли →Г-1 например НСl, НВг, КСl
НВг+5O3 а также соли →Г-1 например НСl, НВг, КСl
НС1+7O4 а также соли→Г-1 например НСl, НВг, КСl
Однако 2НI+5O3, а также соли +10е→ I20
-
Окислительные свойства проявляет азотная кислота

6. Окислительные свойства проявляет азотистая кислота, а также нитриты и нитраты: 2Н+ + (N+3O2)- → N+2O (всегда) + H2O
t
но NH4NO2 → N20↑ +2H2O
NaNO3 (щ. с.) + акт. мет. (Zn) → NH3
NaNO3 (щ. с.) + акт. мет. (Zn) → (N+3O2)-
7. Окислительные свойства проявляет оксид серы (IV) SO2
SO2 + СИЛЬНЫЙ вос. → S0↓
8. Окислительные свойства проявляет концентрированная серная кислота:

могут образоваться одновременно в разных соотношениях.
9. Окислительные свойства проявляет пероксид водорода
H2O2 +2H+ +2e → 2H2O
H2O2 +2e →2OH-
10. Перманганат калия KMn+7O4
 в кислотной среде (H+) Mn2+
в кислотной среде (H+) Mn2+
KMn+7O4 в щелочной среде (OH-) MnO42-
в щелочной среде (OH-) MnO42-
 в нейтральной среде (H20) Mn+4O2
в нейтральной среде (H20) Mn+4O2
11. Соединение хрома:
Cr2O72-  В кислотной среде Cr3+
В кислотной среде Cr3+
Cr3+  В щелочной среде CrO42-
В щелочной среде CrO42-
Восстановители – доноры электронов
-
Me: Al; Ca; K; Mg; Na
-
неМе: C (kokc); H2; S; Si; Se; P
-
Бинарные соединения неМе: галогеноводороды, халькогеноводороды, гидриды, сульфиды, нитриды, фосфиды, галогениды, бориды, селениды, телуриды, арсениды, силициды.
Анионы могут окислять до с.о. 0 или высшей положительной с.о.: например нитрид
2N-3 - 6 ē N20
N20
N-3 - 8 ē  N+5
N+5
-
Некоторые металлы в щелочной среде (OH-)
Zno - 2 ē  ZnO22- (Na2ZnO2 цинкат Na или Na2[Zn(OH)4] тетрагидроксоцинкат Na)
ZnO22- (Na2ZnO2 цинкат Na или Na2[Zn(OH)4] тетрагидроксоцинкат Na)
Al0 - 3 ē  [Al(OH)4-]- (Na[Al(OH)4-] тетрагидроксоаллюминат Na)
[Al(OH)4-]- (Na[Al(OH)4-] тетрагидроксоаллюминат Na)
Pb0 - 2 ē  [ Pb(OH)3]- (K+[Pb(OH)3]- тригидроксоплюмбат (II) калия )
[ Pb(OH)3]- (K+[Pb(OH)3]- тригидроксоплюмбат (II) калия )
-
Тиосульфат ион S2O62-
 На воздухе (H+; H2O)
На воздухе (H+; H2O)  SO42- + S0
SO42- + S0
S2O32-  + Сильный окислитель
+ Сильный окислитель  2SO42-
2SO42-
 + I2
+ I2  S4O62- (Тетратионат анион)
S4O62- (Тетратионат анион)
-
Пероксид водорода
H2O2-1 - 2 ē  O2 + 2H+
O2 + 2H+
H2O2-1 + 2OH- - 2 ē  O2 + 2H2O (восстановительный распад)
O2 + 2H2O (восстановительный распад)
-
В органических соединениях в ряду алкан – алкен – алкин – спирт – альдегид – карбоновая кислота – оксид углерода (II) повышается с. о. углерода, уменьшается способность к окислению.
Сила окислителей увеличивается в кислотной среде, а восстановителей – в щелочной среде.
Запись сильных и слабых электролитов
Сильные электролиты (кислоты, щелочи, соли) – в водных растворах полностью дисcоциируют на ионы, поэтому в ионных уравнениях и полуреакциях их записывают в виде ионов.
Кислоты: HClO4; HClO3; HNO3; H2SO4; H2SeO4; HCl; HBr; HI; HBrO3; HBrO4; HIO3; HIO4; HNCS; HMnO4; H2Cr2O7; H3PO2
Щелочи: LiOH; NaOH; KOH; RbOH; Sr(OH)2; Ba(OH)2; Ca(OH)2
Соли: почти все
Слабые электролиты в водных растворах не полностью диссоциируют на ионы. В ионных уравнениях, а также в полуреакциях формулы слабых электролитов, оксидов, веществ в твердом и газообразном состоянии записывают в молекулярном виде.
Кислоты: HClO2; HClO; HNO2; H2SO3; H2CO3; H2SiO3; H3PO4; H3PO3; HPO2; HBO3; HIO6; HIO; H2S; HCN; HF; HBrO; CH3COOH
Основания: Fe(OH)2; Fe(OH)3; Cu(OH)2; NH4OH; Al(OH)3; Zn(OH)2; Cr(OH)3, все амфотерные гидроксиды.
Органические вещества.
Вода: H2O.
Подбор коэффициентов методом электронно-ионного баланса
(метод полуреакций)
При подборе коэффициентов методом ЭИБ отпадает необходимость нахождения степеней окисления элементов, легко определяются стехиометрические коэффициенты в молекулярном уравнении.
Правила оформления уравнений ОВР, протекающих в кислотной среде
-
Записать схему реакции. Определить молекулы или ионы, которые участвуют в процессе окисления и восстановления.
-
Записать в ионном виде полуреакции окисления и восстановления. Слабые электролиты, твердые и газообразные вещества записываются в молекулярном виде.
-
На основании закона сохранения массы и энергии при составлении уравнений полуреакций следует соблюдать баланс веществ и баланс зарядов.
Для уравнивания числа атомов кислорода в ту часть полуреакции, где он в избытке, добавляют столько катионов водорода Н+, чтобы, связавшись с атомами кислорода, образовались молекулы Н2О. В противоположную часть добавляют молекулы Н2О.
Уравнять кислород, затем водород, затем уравнивают электроны.
-
Балансируют (уравнивают) число отданных и принятых ē в полуреакциях.
-
Суммируют сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой. Результат – суммарное ионное уравнение.
-
Подчеркивают и сокращают одинаковые ионы и молекулы.
-
Добавляют недостающие катионы или анионы. Количество добавляемых ионов в левую и правую части ионного уравнения должно быть одинаковым. Результат – молекулярное уравнение.
Например:
| 1 | Схема уравнения | S0+HNO3-  H2SO42- + NO0 H2SO42- + NO0 |
| 2 | 1-я полуреакция | 1  S0 + 4H2O0 -6ē S0 + 4H2O0 -6ē  SO42- + 8H+ SO42- + 8H+
|
| 3 | 2-я полуреакция | 2 NO3- + 4H+ + 3ē NO3- + 4H+ + 3ē  NO0 + 2H2O0 NO0 + 2H2O0 |
| 4 | Суммарное ионное уравнение | S + 4H2O + 2NO3- + 8H+  SO42- + 8H+ + 2NO + 4H2O SO42- + 8H+ + 2NO + 4H2O S + 2NO3- SO42- + 2NO SO42- + 2NO |
| 5 | Добавляемые ионы | 2H+ = 2H+ |
| 6 | Итоговое молекулярное уравнение | S +2HNO3 = H2SO4 + 2NO |
1.
KNO2- + HClO3- KNO3- + HCl-
KNO3- + HCl-
3  NO2- + H2O0 - 2ē
NO2- + H2O0 - 2ē NO3- + 2H+
NO3- + 2H+
1  ClO3- + 6H+ + 6ē
ClO3- + 6H+ + 6ē  Cl- + 3H2O0
Cl- + 3H2O0
3NO2- + 3H2O + ClO3- + 6H+ 3NO3- + 6H+ + Cl- + 3H2O
3NO3- + 6H+ + Cl- + 3H2O
3NO2- + ClO3- 3NO3- + Cl-
3NO3- + Cl-
3K+ + H+ = 3K+ + H+
3KNO2 + HClO3 = 3KNO3 + HCl
2.
KI- + KNO2- + H2SO4 I20 + NO0 + K2SO4 + H2O
I20 + NO0 + K2SO4 + H2O
1 2I- - 2ē
2I- - 2ē  I20
I20
2 NO2- + 2H+ + 1ē
NO2- + 2H+ + 1ē NO0 + H2O
NO0 + H2O
2I- + 2NO2- + 4H+  I2 + 2NO + 2H2O
I2 + 2NO + 2H2O
2K+ + 2K+ + 2SO42- = 4K+ + 2SO42-
2KI + 2KNO2 + 2H2SO4 = I2 + 2NO + 2K2SO4 + 2H2O
+ 2K2SO4 + 2H2O
3.
HCl- + HClO3-  Cl20 + H2O
Cl20 + H2O
5 Cl- - 1ē
Cl- - 1ē  Cl0
Cl0
1 ClO3- + 6H+ + 5ē
ClO3- + 6H+ + 5ē  Cl0 + 3H2O
Cl0 + 3H2O
5Cl- + ClO 3-+ 6H+  5Cl0 +Cl0 + 3H2O
5Cl0 +Cl0 + 3H2O
5HCl + HClO3 = 3Cl2 + 3H2O
4.
KMnO4- + Fe2+SO4 + H2SO4 Mn2+SO4 + Fe23+(SO4)3 + K2SO4 + H2O
Mn2+SO4 + Fe23+(SO4)3 + K2SO4 + H2O
2 MnO4- + 8H+ +5ē
MnO4- + 8H+ +5ē  Mn2+ +4H2O0
Mn2+ +4H2O0
5 2Fe2+ - 2ē
2Fe2+ - 2ē 2Fe3+
2Fe3+
2MnO4- +16H+ + 10Fe2+ 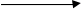 2Mn2+ +8H2O + 10Fe3+
2Mn2+ +8H2O + 10Fe3+
2K+ + 8SO42- +10SO42- = 2SO42- +2K+ + SO42- + 15SO42-
2KMnO4 + 8H2SO4 +10FeSO4 = 2MnSO4 + K2SO4 + 5Fe2(SO4)3 + 8H2O
5.
K2Cr2O72- + H2S2- + H2SO4  S0 + Cr23+(SO4)3 + K2SO4 + H2O
S0 + Cr23+(SO4)3 + K2SO4 + H2O
1  Cr2O72- + 14H+ + 6ē
Cr2O72- + 14H+ + 6ē 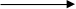 2Cr3+ + 7H2O
2Cr3+ + 7H2O
3  S2- -2ē
S2- -2ē  S0
S0
Cr2O72- + 14H+ + 3S2-  2Cr3+ + 7H2O +3S
2Cr3+ + 7H2O +3S
2K+ + 4SO42- = 3SO42- + 2K+ + SO42-
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 +K2SO4 + 3S +7H2O
6-10 ОВР попробуйте решить самостоятельно
6. KI + H2SO4  I2 + H2S + K2SO4 + H2O
I2 + H2S + K2SO4 + H2O
7. Сa + HNO3 Ca(NO3)2 + … +H2O
Ca(NO3)2 + … +H2O
8. K2Cr2O7 + KNO2 + H2SO4  … + KNO3 + K2SO4 +H2O
… + KNO3 + K2SO4 +H2O
9. Pb + HNO3  Pb(NO3)2 + … +H2O
Pb(NO3)2 + … +H2O
10. NaBr + NaBrO3 +H2SO4 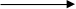 … + Na2SO4 +H2O
… + Na2SO4 +H2O
Правила оформления уравнений ОВР, протекающих в щелочной среде
-
Чтобы уравнять число атомов водорода и кислорода, добавляют воду в ту часть полуреакции, где избыток атомов кислорода, а в противоположную часть – удвоенное число гидроксид анионов.
-
Перед Н2О ставят коэффициент, показывающий разницу в числе атомов кислорода в левой и правой частях полуреакций, а перед ОН- - его удвоенный коэффициент. Получается так, что восстановитель присоединяет кислород из гидроксид анионов.
1.
MnO20 + KClO3- + KOH 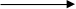 K2MnO42- + KCl- + H2O
K2MnO42- + KCl- + H2O
3  MnO20 + 4OH- -2 ē
MnO20 + 4OH- -2 ē  MnO42- + 2H2O
MnO42- + 2H2O
1  ClO3- +3 H2O +6 ē
ClO3- +3 H2O +6 ē Cl- + OH-
Cl- + OH-
3MnO2 + 12OH- + ClO3- + 3H2O  3MnO42- + 6H2O + Cl- + 6OH-
3MnO42- + 6H2O + Cl- + 6OH-
3MnO2 + 6OH- + ClO3-  3MnO42- + Cl- + 3H2O
3MnO42- + Cl- + 3H2O
6K+ + K+ = 6K+ + K+
3MnO2 + 6KOH + KClO3 = 3K2MnO4 + 3H2O + KCl
2.
I20 +KOH  KI- + KIO3- +H2O
KI- + KIO3- +H2O
5  I0 + 1 ē
I0 + 1 ē  I-
I-
1 I0 +6OH- -5 ē
I0 +6OH- -5 ē  IO3- + 3H2O
IO3- + 3H2O
5I0 + I0+6OH- 5I- + IO3- + 3H2O
IO3- + 3H2O
6K+ = 5K+ + K+
3I2 + 6KOH = 5KI + KIO3 + 3H2O
3.
MnO2 + KNO3 + KOH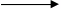 K2MnO4 + KNO2 + H2O
K2MnO4 + KNO2 + H2O
1 MnO20 + 4OH- -2ē
MnO20 + 4OH- -2ē 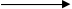 MnO42- + 2H2O0
MnO42- + 2H2O0
1  NO3- + H2O + 2ē
NO3- + H2O + 2ē 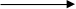 NO2- + 2OH-
NO2- + 2OH-
MnO2 + 4OH-+ NO3- +H2O  MnO42- + 2H2O + NO2- + 2OH-
MnO42- + 2H2O + NO2- + 2OH-
MnO2 + 2OH- + NO3-  MnO42- + H2O + NO2-
MnO42- + H2O + NO2-
2K+ + K+ = 2K + + K+
MnO2 + 2KOH + KNO3 = K2MnO4 + H2O + KNO2
4.
Na2SO32- + KMnO4- + KOH  Na2SO42- + K2MnO42- +H2O
Na2SO42- + K2MnO42- +H2O
1 SO32- + 2OH- -2ē
SO32- + 2OH- -2ē 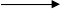 SO42- + H2O0
SO42- + H2O0
2  MnO4- +1ē
MnO4- +1ē 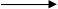 MnO42-
MnO42-
SO32- + 2OH- +2MnO4- 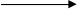 SO42- +H2O + 2MnO42-
SO42- +H2O + 2MnO42-
2Na+ + 2K+ + 2K+ = 2Na+ + 4K+
Na2SO3 + 2KOH + 2KMnO4 = Na2SO4 +H2O + 2K2MnO4
5.
NaCrO2- + Br20 + NaOH Na2CrO42- + NaBr- + H2O
Na2CrO42- + NaBr- + H2O
2 CrO2- + 4OH- -3ē
CrO2- + 4OH- -3ē  CrO42- + H2O0
CrO42- + H2O0
3  Br20 + 2ē
Br20 + 2ē 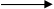 2Br -
2Br -
2CrO2- + 8OH- + 3Br2  2CrO42- + 4H2O + 6Br-
2CrO42- + 4H2O + 6Br-
2Na+ + 8Na+ = 4Na+ + 6Na+
2NaCrO2 + 8NaOH + 3Br2 = 2Na2CrO4 + 4H2O + 6NaBr
6-10 ОВР попробуйте решить самостоятельно
6. MnSO4 + Br2 +NaOH  Na2MnO4 + NaBr + Na2SO4 +H2O
Na2MnO4 + NaBr + Na2SO4 +H2O
7. SO2 + KMnO4 +KOH  K2SO4 +… +H2O
K2SO4 +… +H2O
8. Cr(NO3)3 + H2O2 + NaOH  Na2CrO4 + NaNO3 + …
Na2CrO4 + NaNO3 + …
9. Cr(OH)3 + Cl2 + NaOH  … + NaCl +H2O
… + NaCl +H2O
10. Na2SO3 + AgNO3 + NaOH 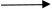 … + Ag
… + Ag + H2O + NaNO3
+ H2O + NaNO3
Правила оформления уравнений ОВР, протекающих в нейтральной среде
Cреду нейтральной считают условно. На самом деле вследствие гидролиза соли среда может быть слабокислотной (рН = 6-7) или слабощелочной (рН = 7-8), поэтому полуреакции можно оформить двумя способами:
-
без учета гидролиза соли. Так как среда нейтральная, то в левые части полуреакций добавляют воду. Тогда одну полуреакцию рассматривают как для кислотной среды, а другую, как для щелочной среды.
-
если по схеме реакции можно определить среду, то полуреакцию оформляют соответственно или, как для кислотной, или, как для щелочной среды.
1.
Na2SO32- + KMnO4- + H2O  MnO20 + Na2SO42- + KOH
MnO20 + Na2SO42- + KOH
3  SO32- + H2O -2ē
SO32- + H2O -2ē  SO42- + 2H+
SO42- + 2H+
2  MnO4- + 2H2O + 3ē
MnO4- + 2H2O + 3ē  MnO2 + 4OH-
MnO2 + 4OH-
3SO32- + 3H2O +4H2O + 2MnO4-  2MnO2 + 6H++ 8OH- + 3SO42-
2MnO2 + 6H++ 8OH- + 3SO42-
7H2O = 6H2O +2OH-
3SO32- + H2O + 2MnO4-  3SO42-+ 2MnO2 + 2OH-
3SO42-+ 2MnO2 + 2OH-
6Na+ + 2K+ = 6Na+ + 2K+
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 +2MnO2 + 2KOH
2.
Na2S2O32- + HOCl- + H2O  H2SO42- + NaCl- + HCl
H2SO42- + NaCl- + HCl
1  S2O32- + 5H2O0 - 8ē
S2O32- + 5H2O0 - 8ē  2SO42- + 10H+
2SO42- + 10H+
2 OCl- + H2O0 + 2ē
OCl- + H2O0 + 2ē  Cl- + OH-
Cl- + OH-
S2O32- + 5H2O +4H2O + OCl- 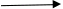 2SO42- + 4Cl- + 10H+ + 8OH-
2SO42- + 4Cl- + 10H+ + 8OH-
9H2O = 8H2O +2H+
S2O32- + H2O + 4OCl-  2SO42- + 4Cl- + 2H+
2SO42- + 4Cl- + 2H+
2Na+ + 4H+ = 4H+ + 2Na+
Na2S2O3 + H2O + 4HOCl = 2H2SO4 + 2NaCl + 2HCl
3.
SO20 + HClO4- + H2O  H2SO42- + HCl-
H2SO42- + HCl-
4 SO20 + 2H2O0 - 2ē
SO20 + 2H2O0 - 2ē  SO42- + 4H+
SO42- + 4H+
1  ClO4- + 4H2O + 8ē
ClO4- + 4H2O + 8ē  Cl- + 8OH-
Cl- + 8OH-
4SO2 + ClO4- + 8H2O +4H2O 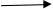 4SO42- +16H+ + 8OH-+ Cl-
4SO42- +16H+ + 8OH-+ Cl-
12H2O = 8H2O +8H+
4SO2 + ClO4- + 4H2O  4Н2SO42- + Cl- + 8H+
4Н2SO42- + Cl- + 8H+
H+ = H+
4SO2 + 4H2O + HClO4 = 4H2SO4 + HCl
4.
I20 + HClO- + H2O HIO3- + HCl-
HIO3- + HCl-
1 I20 + 6H2O - 10ē
I20 + 6H2O - 10ē  2IO3- + 12H+-
2IO3- + 12H+-
5  ClO- + H2O + 2ē
ClO- + H2O + 2ē  Cl- + 2OH-
Cl- + 2OH-
I2 + 5H2O + 6H2O + 5ClO-  2IO3- +12H+ + 10OH- + 5Cl-
2IO3- +12H+ + 10OH- + 5Cl-
11H2O = 10H2O +2H+
I2 + H2O + 5ClO-  2IO3- + 2H + 5Cl-
2IO3- + 2H + 5Cl-
5H+ = 2H+ + 3H+
I2 + H2O + 5HClO = 2HIO3 + 5HCl
5.
I20 + Cl20 + H2O HIO3- + HCl-
HIO3- + HCl-
1  I20 + 6H2O - 10ē
I20 + 6H2O - 10ē  2IO3- + 12H+
2IO3- + 12H+
5  Cl20 + 2ē
Cl20 + 2ē 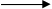 2Cl-
2Cl-
I2 + 6H2O + 5Cl2 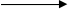 2IO3- +10Cl- + 12H+
2IO3- +10Cl- + 12H+
I2 + 6H2O + 5Cl2 = 2HIO3 + 10HCl
6-10 ОВР попробуйте решить самостоятельно
6. SO2 + HBrO3 + H2O  H2SO4 + Br2
H2SO4 + Br2
7. AuCl3 + Se + H2O H2SeO3 + … + Au
H2SeO3 + … + Au
8. P2O3 + AgNO3 +H2O  … + HNO3 +Ag
… + HNO3 +Ag
9. H2S + K2CrO7 + H2O S + KOH + …
S + KOH + …
10. K2S + KMnO4 + H2O  S + … + KOH
S + … + KOH
Проверь себя: 1) ОВР, протекающие в кислотной среде
6. KI- + H2SO42-  I20 + H2S2- + K2SO4 + H2O
I20 + H2S2- + K2SO4 + H2O
4  2I- -2ē
2I- -2ē  I20
I20
1  SO42- + 8H+ +8ē
SO42- + 8H+ +8ē  S2- +4H2O
S2- +4H2O

8I- + SO42- + 8H+  4I2 + S2- +4H2O
4I2 + S2- +4H2O
8K+ + 2H+ + 4SO42- = 2H+ +8K+ + 4SO42-
8KI + 5H2SO4 = 4I2 + H2S + 4K2SO4 +4H2O
7.
Сa0 + HNO3-  Ca2+(NO3)2 + N2O0 +H2O
Ca2+(NO3)2 + N2O0 +H2O
4 Сa0 - 2 ē
Сa0 - 2 ē  Ca2+
Ca2+
1  2NO3- +10H+ + 8 ē
2NO3- +10H+ + 8 ē  N2O0 +5H2O
N2O0 +5H2O
4Сa0 + 2NO3- +10H+ 4Ca2+ + N2O +5H2O
4Ca2+ + N2O +5H2O
8NO3- = 8NO3-
4Сa + 10HNO3 = 4Ca(NO3)2 + N2O +5H2O
8.
K2Cr2O72- + KNO2- + H2SO4  Cr23+(SO4)3 +KNO3- + K2SO4 +H2O
Cr23+(SO4)3 +KNO3- + K2SO4 +H2O
1 Cr2O72- + 14H+ +6 ē
Cr2O72- + 14H+ +6 ē  2Cr3++7H2O
2Cr3++7H2O
3  NO2- + H2O -2 ē
NO2- + H2O -2 ē  NO3- + 2H+
NO3- + 2H+
Cr2O72- +14H+ + 3NO2- + 3H2O  2Cr3+ + 7H2O +3NO3- + 6H+
2Cr3+ + 7H2O +3NO3- + 6H+
Cr2O72- + 8H+ + 3NO2-  2Cr3+ +4H2O +3NO3-
2Cr3+ +4H2O +3NO3-
2K+ + 4SO42-+3K+ = 3SO42- +3K+ + 2K + +SO42-
K2Cr2O7 + 4H2SO4+ 3KNO2 = Cr2(SO4)3 +3KNO3 + K2SO4 +4H2O
9.
Pb0 + HNO3-  Pb2+(NO3)2 + NO20 +H2O
Pb2+(NO3)2 + NO20 +H2O
1  Pb0 -2 ē
Pb0 -2 ē  Pb2+
Pb2+
2 NO3- + 2H+ +1 ē
NO3- + 2H+ +1 ē  NO20 +H2O
NO20 +H2O
Pb + 2NO3- + 4H+  Pb2++ 2NO2 +2H2O
Pb2++ 2NO2 +2H2O
2NO3- = 2NO3-
Pb0 + 4HNO3 = Pb(NO3)2 + 2NO2 + 2H2O
10.
NaBr - + NaBrO3- +H2SO4  Br20 + Na2SO4 +H2O
Br20 + Na2SO4 +H2O
5  Br - -1 ē
Br - -1 ē  Br0
Br0
1  BrO3- +6H+ +5 ē
BrO3- +6H+ +5 ē  Br0 + 3H2O
Br0 + 3H2O
5Br - +BrO3- +6H+  5Br0 + Br0 +3H2O
5Br0 + Br0 +3H2O
5Na+ + Na+ +3SO42- = 6Na+ + 3SO42-
5NaBr + NaBrO3- + 3H2SO4 = 3Br20 + 3Na2SO4 +3H2O
2) ОВР, протекающие в щелочной среде
6. Mn2+SO4 + Br20 +NaOH  Na2MnO42- +NaBr - + Na2SO4 +H2O
Na2MnO42- +NaBr - + Na2SO4 +H2O
1 Mn2+ + 8OH- - 4ē
Mn2+ + 8OH- - 4ē  MnO42- + 4H2O0
MnO42- + 4H2O0
2 Br20 + 2ē
Br20 + 2ē  2Br -
2Br -
Mn2+ + 2Br2 + 8OH-  MnO42- +4Br - + 4H2O
MnO42- +4Br - + 4H2O
SO42- + 8Na+ = 2Na+ + 4Nа+ + SO42- + 2Na+
MnSO4 + 8NaOH + 2Br2 = Na2MnO4 + 4H2O +4NaBr + Na2SO4
7.
SO20 + KMnO4- + KOH  K2SO42- +MnO20 +H2O
K2SO42- +MnO20 +H2O
3  SO20 + 4OH- - 2ē
SO20 + 4OH- - 2ē  SO42- + 2H2O0
SO42- + 2H2O0
2  MnO4- +2H2O + 3ē
MnO4- +2H2O + 3ē MnO2 +4OH-
MnO2 +4OH-
3SO2 + 12OH- + 2MnO4- +4H2O 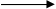 3SO42- +6H2O +2MnO2 +8OH-
3SO42- +6H2O +2MnO2 +8OH-
3SO2 +4OH-+ 2MnO4-  3SO42- +2H2O +2MnO2
3SO42- +2H2O +2MnO2
4K+ +2K+ = 6K+
3SO2 + 4KOH + 2KMnO4 = 3K2SO4 + 2H2O + 2MnO2
8.
Cr3+(NO3)3 + H2O20 + NaOH  Na2CrO42- + NaNO3 + H2O
Na2CrO42- + NaNO3 + H2O
2  Cr3 + 8OH- - 3ē
Cr3 + 8OH- - 3ē  CrO42- + 4H2O0
CrO42- + 4H2O0
3  H2O20 + 2ē
H2O20 + 2ē  2OH-
2OH-

2Cr3+ + 3H2O2 + 16OH-  2CrO42- + 8H2O + 6OH-
2CrO42- + 8H2O + 6OH-
2Cr3+ + 10OH-+ 3H2O2  2CrO42- +8H2O
2CrO42- +8H2O
6NO3- + 10Na+ = 4Na+ + 6Na+ +6NO3-
2Cr(NO3)3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 8H2O + 6NaNO3
9.
Cr(OH)30 + Cl20 + NaOH  Na2CrO42- + NaCl- +H2O
Na2CrO42- + NaCl- +H2O
2 Cr(OH)30 + 3H+ + 8OH- -3ē
Cr(OH)30 + 3H+ + 8OH- -3ē  CrO42- + 4H2O
CrO42- + 4H2O
3  Cl20 + 2ē
Cl20 + 2ē 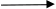 2Cl-
2Cl-
2Cr(OH)3 + 6H+ + 16OH- + 3Cl2  2CrO42- +8H2O + 6Cl-
2CrO42- +8H2O + 6Cl-
2Cr(OH)3 + 10OH- + 3Cl2  2CrO42- +2H2O + 6Cl-
2CrO42- +2H2O + 6Cl-
10 Na+ = 4Na+ + 6Na+
2Cr(OH)3 + 10NaOH + 3Cl2 = 2Na2CrO4 + 2H2O + 6NaCl
10.
Na2SO32- + Ag+NO3 + NaOH 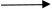 Na2SO42- + Ag0
Na2SO42- + Ag0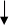 + H2O + NaNO3
+ H2O + NaNO3
1 SO32- +2OH- - 2ē
SO32- +2OH- - 2ē 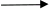 SO42- + H2O
SO42- + H2O
2 Ag+ + 1ē
Ag+ + 1ē 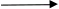 Ag0
Ag0
SO32- + 2OH- + 2Ag+  SO42- + H2O + 2Ag0
SO42- + H2O + 2Ag0
2Na+ + 2NO3- + 2Na+ = 2Na+ + 2Na+ + 2NO3-
Na2SO3 + 2NaOH + 2AgNO3 = Na2SO4 + H2O + 2Ag + 2NaNO3
3) ОВР, протекающие в нейтральной среде
6. SO20 + HBrO3- + H2O 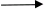 H2SO42- + Br20
H2SO42- + Br20
5 SO20 + 2H2O0 - 2ē
SO20 + 2H2O0 - 2ē  SO42- + 4H+
SO42- + 4H+
1  2BrO3- + 6H2O +10ē
2BrO3- + 6H2O +10ē Br20 + 12OH-
Br20 + 12OH-
5SO2 + 10H2O +6H2O + 2BrO3-  5SO42- + Br2 +20 H+ +12OH-
5SO42- + Br2 +20 H+ +12OH-
16H2O =12H2O + 8H+
5SO2 + 2BrO3- + 4H2O  5SO42- + Br2 +8H+
5SO42- + Br2 +8H+
2H+ = 2H+
5SO2 + 4H2O + 2HBrO3 = 5H2SO4 + Br2
7.
Au3+Cl3 + Se0 + H2O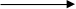 H2SeO32- + HCl + Au0
H2SeO32- + HCl + Au0
4 Au3+ + 3ē
Au3+ + 3ē Au0
Au0
3  Se0 + 3H2O - 4ē
Se0 + 3H2O - 4ē SeO32- + 6H+
SeO32- + 6H+
4Au3+ + 3Se0 + 9H2O  4Au0 + 3SeO32- + 18H+
4Au0 + 3SeO32- + 18H+
6H+ + 12H+ = 18H+
12Cl- = 12Cl-
4AuCl3 + 3Se + 9H2O = 4Au + 3H2SeO3 + 12HCl
8.
P2O30 + Ag+NO3 +H2O  H3PO43- + HNO3 +Ag0
H3PO43- + HNO3 +Ag0
1 P2O30 + 5H2O - 4ē
P2O30 + 5H2O - 4ē  2PO43- + 10H+
2PO43- + 10H+
4 Ag+ + 1ē
Ag+ + 1ē Ag0
Ag0
P2O3 + 4Ag+ +5H2O 2PO43- +4Ag0 + 10H+
2PO43- +4Ag0 + 10H+
4NO3- = 4NO3-
P2O3 + 4AgNO3 + 5H2O = 2H3PO4 + 4HNO3 +4Ag0
9.
H2S0 + K2Cr2O72- + H2O  S0 + KOH + Cr(OH)30
S0 + KOH + Cr(OH)30
3  H2S0 - 2ē
H2S0 - 2ē  S0 + 2H+
S0 + 2H+
1  Cr2O72- + 7H2O + 6ē
Cr2O72- + 7H2O + 6ē  2Cr(OH)3 + 8OH-
2Cr(OH)3 + 8OH-
3H2S + 7H2O + Cr2O72-  3S + 6H+ +8OH- + 2Cr(OH)3
3S + 6H+ +8OH- + 2Cr(OH)3
3H2S + Cr2O72- + H2O  3S + 2Cr(OH)3 + 2OH-
3S + 2Cr(OH)3 + 2OH-
2K+ = 2K+
3H2S + K2Cr2O7 + H2O = 3S + 2Cr(OH)3 + 2KOH
10.
K2S2- + KMnO4- + H2O  S0 + MnO20 + KOH
S0 + MnO20 + KOH
3  S2- - 2ē
S2- - 2ē  S0
S0
2  MnO4- + 2H2O0 + 3ē
MnO4- + 2H2O0 + 3ē  MnO20 + 4OH-
MnO20 + 4OH-
3S2- + 2MnO4- + 4H2O  3S0 + 2MnO2 + 8OH-
3S0 + 2MnO2 + 8OH-
6K+ + 2K+ = 8K+
3K2S + 2KMnO4 + 4H2O = 3S + 2MnO2 + 8KOH




























