Демонстрационный вариант № 1
Инструкция по выполнению работы
Экзаменационная работа состоит из двух частей, включающих в себя
22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 2 часа
(120 минут).
Ответы к заданиям 1–15 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
Ответы к заданиям 16–19 записываются в виде последовательности
цифр. Эту последовательность цифр запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
К заданиям 20–22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Задания выполняются на бланке ответов № 2.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
При выполнении заданий можно пользоваться черновиком. Записи
в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
Баллы, полученные Вами за выполненные задания, суммируются.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее
количество баллов.
Желаем успеха!__
Часть 1
Ответом к заданиям 1–15 является одна цифра, которая соответствует
номеру правильного ответа. Запишите эту цифру в поле ответа
в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от
номера соответствующего задания, начиная с первой клеточки.
Заряд ядра и число валентных электронов в атоме алюминия равны соответственно |
| | 1) | +13 и 3 | | | 2) | +27 и 3 | | | 3) | +13 и 27 | | | 4) | +3 и 13 |
|
Ответ:
Радиус атома фосфора больше, чем радиус атома |
| | 1) | мышьяка | | | 2) | алюминия | | | 3) | кремния | | | 4) | азота |
|
Ответ
| Начало формы Ковалентная неполярная связь характерна для | | | 1) | HBr | | | 2) | KBr | | | 3) | Br2 | | | 4) | CaBr2 |
| Конец формы
|
|
Ответ
Степень окисления хлора в Са(СlО)2 равна |
|
|
Ответ
| Начало формы Вещества, формулы которых Ca3(PO4)2 и Na2O, являются соответственно | | | 1) | основанием и кислотным оксидом | | | 2) | солью и основанием | | | 3) | солью и оснóвным оксидом | | | 4) | кислотой и амфотерным оксидом |
| Конец формы
|
|
Ответ
Уравнению окислительно-восстановительной экзотермической реакции соответствует запись |
| | 1) | CO2 + Na2O2 → Na2CO3 + O2 + Q | | | 2) | Al(OН)3 → Al2O3 + H2O – Q | | | 3) | 2NH3 → N2 + 3H2 – Q | | | 4) | Na2O + P2O5 → Na3PO4 + Q |
|
Ответ
Признаком протекания химической реакции между сульфидом натрия
и раствором фосфорной кислоты является |
| | 1) | изменение цвета | | | 2) | образование осадка | | | 3) | появление запаха | | | 4) | растворение осадка |
|
Ответ
Катионы водорода и анионы кислотного остатка образуются в растворе при электролитической диссоциации |
| | 1) | сероводорода | | | 2) | фосфата аммония | | | 3) | гидроксида кальция | | | 4) | cульфата меди(II) |
|
Ответ
Не реагируют друг с другом |
| | 1) | хлор и водород | | | 2) | кислород и кальций | | | 3) | азот и вода | | | 4) | железо и сера |
|
Ответ
Химическая реакция возможна между |
| | 1) | оксидом бария и водой | | | 2) | оксидом железа(III) и кислородом | | | 3) | оксидом серы(VI) и оксидом кремния | | | 4) | оксидом углерода(IV) и оксидом фосфора(V) |
|
Ответ
Сероводородная кислота реагирует с
| | 1) | медью |
| | 2) | оксидом кремния |
| | 3) | гидроксидом кальция |
| | 4) | фосфатом кальция |
Ответ
Между какими веществами возможно взаимодействие?
| | 1) | NH4NO3 и Al2(SO4)3 |
| | 2) | BaCl2 и KOH |
| | 3) | Ba(NO3)2 и NaCl |
| | 4) | NH4Cl и Ba(OH)2 |
Ответ
| 13. Верны ли суждения о способах разделения смесей? А. Очистить морскую воду от растворённых в ней солей можно с помощью фильтрования. Б. Перегонка является химическим способом разделения смесей. |
| | 1) | верно только А | | | 2) | верно только Б | | | 3) | верны оба суждения | | | 4) | оба суждения неверны |
|
Ответ
| Начало формы В реакции Br2 + 2NaOH = NaBrO + NaBr + H2O изменение степени окисления восстановителя соответствует схеме | | | 1) | 0 → +1 | | | 2) | -2 → 0 | | | 3) | 0 → -1 | | | 4) | -2 → +2 |
| Конец формы
|
Ответ
На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата лития? |
|
|
Ответ
Ответом к заданиям 16–19 является последовательность цифр, которые
следует записать в БЛАНК ОТВЕТОВ № 1 справа от номера
соответствующего задания, начиная с первой клеточки. Ответ
записывайте без пробелов, запятых и других дополнительных символов.
Каждую цифру пишите в отдельной клеточке в соответствии с
приведёнными в бланке образцами.
При выполнении заданий 16, 17 из предложенного перечня ответов
выберите два правильных и запишите в таблицу цифры, под которыми
они указаны.
Как фосфор, так и сера |
| | 1) | имеют в атомах одинаковое число электронных слоёв | | | 2) | проявляют устойчивую степень окисления +2 | | | 3) | являются неметаллами | | | 4) | в соединениях проявляют только положительные степени окисления | | | 5) | образуют высшие оксиды, относящиеся к оснóвным оксидам |
|
Ответ
Укажите утверждения, верные для уксусной кислоты |
| | 1) | при комнатной температуре является твердым веществом | | | 2) | неограниченно смешивается с водой | | | 3) | является сильной кислотой | | | 4) | реагирует с карбонатом калия | | | 5) | обесцвечивает бромную воду |
|
Ответ
При выполнении заданий 18, 19 к каждому элементу первого столбца
подберите соответствующий элемент из второго столбца. Запишите
в таблицу выбранные цифры под соответствующими буквами. Цифры
в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. |
| | | ВЕЩЕСТВА | | РЕАКТИВ | | А) | LiNO3 и LiCl | | Б) | NH4Cl и KCl | | В) | Na2CO3 и K3PO4 |
| | | 1) | AgNO3 | | 2) | NaOH | | 3) | HCl | | 4) | Ba(NO3)2 |
|
|
Ответ
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. |
| | | ФОРМУЛА ВЕЩЕСТВА | | РЕАГЕНТЫ | |
| | | 1) | HNO3, O2 | | 2) | Zn, BaCl2 | | 3) | CuO, NaNO3 | | 4) | СаO, Ва(ОН)2 |
|
|
Ответ
Не забудьте перенести все ответы в бланк ответов № 1
в соответствии с инструкцией по выполнению работы.
Часть 2
Для ответов на задания 20–22 используйте БЛАНК ОТВЕТОВ № 2.
Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый
ответ к нему. Ответы записывайте чётко и разборчиво
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
NaOH + Cl2 → NaClO3 + NaCl + H2O
Определите окислитель и восстановитель.
К раствору с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). При этом образовался осадок массой 4,9г. Определите массу исходного раствора щелочи.
Дана схема превращений:
 Al → AlCl3 → X t Al2O3
Al → AlCl3 → X t Al2O3
Напишите уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение.






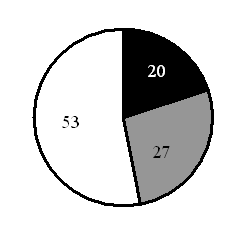



 Al → AlCl3 → X t Al2O3
Al → AlCl3 → X t Al2O3

















