Демонстрационный вариант № 1
Инструкция по выполнению работы
Экзаменационная работа состоит из двух частей, включающих в себя
22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 2 часа
(120 минут).
Ответы к заданиям 1–15 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
Ответы к заданиям 16–19 записываются в виде последовательности
цифр. Эту последовательность цифр запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
К заданиям 20–22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Задания выполняются на бланке ответов № 2.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
При выполнении заданий можно пользоваться черновиком. Записи
в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
Баллы, полученные Вами за выполненные задания, суммируются.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее
количество баллов.
Желаем успеха!__
Часть 1
Ответом к заданиям 1–15 является одна цифра, которая соответствует
номеру правильного ответа. Запишите эту цифру в поле ответа
в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от
номера соответствующего задания, начиная с первой клеточки.
На приведённом рисунке 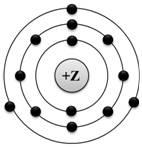
изображена модель атома химического элемента |
| | 1) | 3-го периода IIIA группы | | | 2) | 3-го периода VA группы | | | 3) | 2-го периода IIIA группы | | | 4) | 2-го периода VIIIA группы |
|
|
Ответ:
Атомный радиус химических элементов увеличивается в ряду |
| | 1) | фосфор → сера → хлор | | | 2) | мышьяк → фосфор → азот | | | 3) | кислород → сера → селен | | | 4) | кремний → фосфор → сера |
|
|
Ответ:
Веществами с ковалентной неполярной и металлической связью являются соответственно |
| | 1) | H2 и S | | | 2) | SO2 и Na | | | 3) | CaCl2 и CO | | | 4) | N2 и Pb |
|
Ответ:
Степень окисления –1 кислород проявляет в соединении |
| | 1) | SiO2 | | | 2) | Na2O2 | | | 3) | SO2 | | | 4) | Li2O |
|
Ответ:
Фтор и бром являются соответственно |
| | 1) | простыми веществами | | | 2) | сложными веществами | | | 3) | простым и сложным веществами | | | 4) | сложным и простым веществами |
|
Ответ:
| Начало формы Реакции соединения соответствует уравнение | | | 1) | FeO + H2 = Fe + H2O | | | 2) | H2O + Cl2 = HClO + HCl | | | 3) | P2O5 + 3H2O = 2H3PO4 | | | 4) | CaO + 2HCl = CaCl2 + H2O |
| Конец формы
|
Ответ:
Взаимодействию серной кислоты и гидроксида меди(II) соответствует сокращённое ионное уравнение |
| | 1) | SO2−4 + Cu(OH)2 = CuSO4 + Н2О | | | 2) | 2Н+ + Cu(OH)2 = Cu2+ + 2Н2О | | | 3) | Н2SO4 + Cu2+ = CuSO4 + 2Н+ | | | 4) | 2Н+ + SO2−4 + Cu2+ = Cu2+ + Н2О + S2– |
|
Ответ:
Наибольшее число ионов образуется при электролитической диссоциации в растворе 1 моль |
| | 1) | Ca(NO3)2 | | | 2) | (NH4)2S | | | 3) | K2SO3 | | | 4) | K3PO4 |
|
Ответ:
Сера реагирует с каждым из двух веществ: |
| | 1) | азот и цинк | | | 2) | кислород и оксид магния | | | 3) | гидроксид натрия и аммиак | | | 4) | водород и ртуть |
|
Ответ:
Химическая реакция возможна между
1)
оксидом кальция и соляной кислотой
2)
оксидом железа(III) и водой
3)
оксидом серы(VI) и кислородом
4)
оксидом углерода(IV) и медью
Ответ:
Кремниевая кислота реагирует с
| | 1) | оксидом серы(IV) |
| | 2) | нитратом калия |
| | 3) | гидроксидом натрия |
| | 4) | фосфатом магния |
Начало формы
Ответ:
В реакцию с каждым из растворов CuSO4 и Na2CO3 вступает
| | 1) | соляная кислота |
| | 2) | гидроксид натрия |
| | 3) | хлорид бария |
| | 4) | нитрат алюминия |
Ответ:
| 13. Верны ли суждения о способах разделения смесей? А. Выделить цинковые опилки из их смеси с древесными опилками можно с помощью магнита. Б. Смесь воды и бензина разделяют с помощью делительной воронки. |
| | 1) | верно только А | | | 2) | верно только Б | | | 3) | верны оба суждения | | | 4) | оба суждения неверны |
|
Ответ:
Конец формы
Элемент углерод является восстановителем в реакции |
| | 1) | CO2 + 2Mg = C + 2MgO | | | 2) | C + 2S = CS2 | | | 3) | C + 2H2 = CH4 | | | 4) | CO2 + Ca(OH)2 = CaCO3 + H2O |
|
Ответ:
Массовая доля азота в сульфате аммония равна |
| | 1) | 10,1% | | | 2) | 21,2% | | | 3) | 34,5% | | | 4) | 42,4% |
|
Ответ:
Ответом к заданиям 16–19 является последовательность цифр, которые
следует записать в БЛАНК ОТВЕТОВ № 1 справа от номера
соответствующего задания, начиная с первой клеточки. Ответ
записывайте без пробелов, запятых и других дополнительных символов.
Каждую цифру пишите в отдельной клеточке в соответствии с
приведёнными в бланке образцами.
При выполнении заданий 16, 17 из предложенного перечня ответов
выберите два правильных и запишите в таблицу цифры, под которыми
они указаны.
| Начало формы В ряду химических элементов C → Si → Ge увеличивается | | | 1) | радиус атома | | | 2) | высшая степень окисления | | | 3) | валентность элемента в летучем водородном соединении | | | 4) | число заполненных электронных слоев | | | 5) | число электронов на внешнем уровне |
| Конец формы
|
Ответ
Укажите утверждения, верные для уксусной кислоты |
| | 1) | при комнатной температуре это жидкость с резким запахом | | | 2) | используется в спиртовках в качестве горючего | | | 3) | водный раствор проводит электрический ток | | | 4) | является сильной кислотой | | | 5) | в состав молекулы входит только водород и углерод |
|
Ответ
При выполнении заданий 18, 19 к каждому элементу первого столбца
подберите соответствующий элемент из второго столбца. Запишите
в таблицу выбранные цифры под соответствующими буквами. Цифры
в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. |
| | | ВЕЩЕСТВА | | РЕАКТИВ | | А) | Al2O3 и MgO | | Б) | H3PO4 и Na3PO4 | | В) | KCl и BaCl2 |
| | | 1) | NaOH | | 2) | H2SO4 | | 3) | лакмус | | 4) | Н2О |
|
|
Ответ
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. |
| | | ФОРМУЛА ВЕЩЕСТВА | | РЕАГЕНТЫ | |
| | | 1) | N2, Fe2O3 | | 2) | CaO, Ba(OH)2 | | 3) | H2O, NaNO3 | | 4) | Na2CO3, AgNO3 |
|
|
Ответ
Не забудьте перенести все ответы в бланк ответов № 1
в соответствии с инструкцией по выполнению работы.
Часть 2
Для ответов на задания 20–22 используйте БЛАНК ОТВЕТОВ № 2.
Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый
ответ к нему. Ответы записывайте чётко и разборчиво.
| Начало формы Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой HNO3 + PbS → PbSO4 + NO2 + H2O Определите окислитель и восстановитель. | Конец формы
|
|
К раствору серной кислоты с массовой долей 5% добавили избыток раствора нитрата бария. При этом выпал осадок массой 11,65г. Определите массу исходного раствора серной кислоты.
Даны вещества: Cu, CuO, NaCl, AgNO3, HCl (р-р), Ba(NO3)2. Используя воду
и необходимые вещества только из этого списка, получите в две стадии нитрат меди(II). Запишите уравнения проведённых химических реакций. Опишите признаки этих реакций. Для второй реакции напишите сокращенное ионное уравнение реакции.

















