Методическая разработка открытого урока
Преподаватель: Белинская Н.В.
Учебная дисциплина: ПД.01 Химия
Учебная группа: ТАК-1, специальность 18.02.12 Технология аналитического контроля химических соединений
Тема урока: Изучение окислительных свойств перманганата калия в различных средах.
Тип урока: Урок применения и совершенствования знаний
Вид урока: Лабораторная работа
Образовательные технологии: Развивающие, практико-ориентированные
Методы обучения: Словесно-наглядный, исследовательский
Цель урока: Создание условий для активного, сознательного, творческого применения на практике полученных знаний и умений.
Задачи:
Образовательные:
-
Закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса;
-
Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере перманганата калия;
-
Показать разнообразие и значение ОВР в повседневной жизни.
Развивающие:
-
Обеспечить условия для развития умений и навыков работы с лабораторным оборудованием и реактивами;
-
Способствовать развитию у студентов умений сравнивать, анализировать и применять информацию из других областей знаний.
Воспитательные:
-
Создать условия, обеспечивающие воспитание интереса к будущей специальности;
-
Обеспечить;
-
Способствовать овладению необходимыми навыками самостоятельной практической деятельности.
Формы: фронтальная, работа в парах, индивидуальная
Оборудование и реактивы: мультимедийный проектор, инструктивные карты (листы контроля работы), штатив с пробирками, растворы: перманганата калия КМnO4, серной кислоты Н2SO4, гидроксида натрия NaOH; гидроксида калия КОН, перекись водорода Н2О2.
Планируемые результаты обучения:
Личностные УУД: установление связи между целью учебной деятельности и её мотивом.
Регулятивные УУД: целеполагание, прогнозирование, контроль, оценка.
Познавательные УУД:
Общеучебные: самостоятельное формулирование цели, умение структурировать знания, умение строить речевое высказывание в устной форме, контроль и оценка процесса и результатов деятельности.
Логические: анализ объектов с целью выделения признаков, установление причинно-следственных связей, выдвижение гипотезы, обоснование.
Коммуникативные: учебное сотрудничество с преподавателем и обучающимися в поисках ответов на поставленные вопросы, умение выражать свои мысли в соответствии с задачами.
Основные химические понятия: реакция среды раствора, окислительно-восстановительные реакции, восстановитель, окислитель, процессы окисления и восстановления, метод электронного баланса.
Межпредметные связи: с биологией
План урока:
I. Организационный момент.
Мотивация деятельности. Постановка целей и задач урока (совместно с обучающимися).
II. Актуализация опорных знаний.
III. Применение и совершенствование знаний и умений.
IV . Формулировка выводов.
V. Подведение итогов урока. Рефлексия.
Ход урока
1. Организационный момент. Приветствие.
Проверка отсутствующих, проверка готовности группы к занятию и обеспечение благоприятного настроя.
Преподаватель: Добрый день, добрый час! Как я рада видеть вас! Посмотрели на гостей, друг на друга посмотрели, и тихонечко все сели.
Мотивация деятельности, постановка цели занятия
На этой лабораторной работе мы продолжим изучение окислительно-восстановительных реакций. Нам предстоит вспомнить основные положения теории окисления - восстановления, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
Но прежде посмотрим небольшой видеоролик (1 мин.). Знаете, как называется это животное? Правильно, это – хамелеон. А почему его так назвали? За способность преображаться - менять окраску кожи в зависимости от условий окружающей среды. Спросите, причём тут хамелеон? Дело в том, что в химии, для химического анализа различных веществ, применяется «раствор хамелеона». Как вы думаете, за что этот раствор так назвали? (Обучающиеся высказывают предположение – за способность вещества, подобно ящерице, менять окраску в зависимости от среды). Правильно, в исходном состоянии раствор этого вещества имеет розовый цвет, или фиолетовый, если раствор насыщенный. При реакции с восстановителем в кислой среде - он обесцвечивается, в избытке щёлочи – раствор становится зелёного цвета, а в нейтральной среде раствор будет буро-коричневым. Как вы думаете, о каком веществе идёт речь? Это раствор перманганата калия.
Сообщение о применении раствора перманганата калия (2 мин).
Задачи урока:
1) углубить, расширить и закрепить знания об окислительно-восстановительных реакциях в процессе выполнения лабораторной работы;
2) выработать умения по составлению уравнений химических реакций с раствором перманганата калия, протекающих в различных средах, методом электронного баланса.
2. Актуализация опорных знаний
Преподаватель: Предлагаю вам повторить некоторые важные понятия и умения по данной теме.
Задание 1. Найти соответствие.
| Реакция среды кислая | рН меньше 7 |
| Реакция среды щелочная | рН больше 7 |
| Реакция среды нейтральная | рН = 7 |
| Реакция окислительно-восстановительная | Реакция, протекающая с изменением степеней окисления атомов, образующих вещества, участвующие в реакции. |
| Восстановитель | Атом (или вещество), отдающий электроны. Сам он при этом окисляется. |
| Окислитель | Атом (или вещество), принимающий электроны. Сам он при этом восстанавливается. |
| Окисление | Процесс отдачи электронов атомом, при этом степень окисления повышается. |
| Восстановление | Процесс, при котором атомы принимают электроны, степень окисления понижается. |
| Степень окисления | Условный заряд атома, который образуется на нём вследствие отдачи или принятия электронов. |
| Степень окисления простого вещества | Равна 0. |
Проверка выполнения задания (по цепочке).
Задание 2. Рассчитайте степени окисления элементов в соединениях:
MnO2, H2SO4, K2SO3, H2S, K2MnO4, KMnO4, FeCl3, H2O2, H2SO3, Zn, KI, NaNO2, Al2(SO4)3
Проверка выполнения задания.
Mn+4O2-2, H+12S+6O-24, K+12S+4O-23, H+12S-2, K+12Mn+6O-24, K+1Mn+7O-24, Fe+3Cl-13,
H+1 2O -12, H +12S+4O-23, Zn0, K+1 I-1 , Na+1N +3O-22, Аl+3 2 (S +6O-24)3
Теперь, когда мы вспомнили основные понятия темы «Окислительно-восстановительные реакции», перейдём к изучению нового материала. Сейчас мы будем исследовать поведение перманганата калия в разных средах. Работать будем в парах. Работа каждой пары направлена на самостоятельное получение знаний путём проведения лабораторных опытов. При выполнении опытов не забывайте соблюдать правила техники безопасности. Повторяем основные правила техники безопасности при работе с реактивами.
3. Применение и совершенствование знаний и умений
Выполнение лабораторной работы
Опыт 1. Взаимодействие перманганата калия с сульфитом натрия в различных средах.
1. Восстановление иона Mn+7 (MnO4-) в кислой среде до Mn+2
В пробирку налейте 1мл раствора перманганата калия, подкислите его серной кислотой (4-5 капель), прибавьте одну ложку сульфита натрия. Что наблюдаете? Наблюдения: раствор обесцветился.
Задание. Составьте уравнение, если известно, что в результате этой реакции образуются сульфат марганца (II), сульфат натрия, сульфат калия и вода. Расставьте коэффициенты методом электронного баланса.
К МnO4 + H2SO4 + Na2SO3 МnSO4 + Na2SO4 + К2SO4 + Н2О
МnO4 + H2SO4 + Na2SO3 МnSO4 + Na2SO4 + К2SO4 + Н2О
2КМn+7O4 + 3H2SO4 + 5Na2S+4O3 = 2Мn+2SO4 + 5Na2S+6O4 + К2SO4 + 3Н2О
Мn+7+5е = Мn+2 2 окислитель (восстановление)
S+4 – 2e = S+6 5 восстановитель (окисление)
2. Восстановление иона Mn+7 (MnO4-) в нейтральной среде до Mn+4 (MnO2)
В пробирку налейте 1мл раствора перманганата калия, добавьте 2-3 капли воды, прибавьте одну ложку сульфита натрия. Что наблюдаете? Наблюдения: Выпал осадок бурого цвета оксид марганца (IV).
Задание. Составьте уравнение, если известно, что в результате этой реакции образуются диоксид марганца, сульфат натрия и гидроксид калия. Расставьте коэффициенты методом электронного баланса.
К МnO4 + H2O + Na2SO3 МnO2 + Na2SO4 + КOH
МnO4 + H2O + Na2SO3 МnO2 + Na2SO4 + КOH
2КМn+7O4 + H2O + 3Na2S+4O3 = 2Мn+4O2 + 3Na2S+6O4 + 2КOH
Мn+7+3е = Мn+4 2 окислитель (восстановление)
S+4 – 2e = S+6 3 восстановитель (окисление)
3. Восстановление иона Mn+7 (MnO4-) в щелочной среде до Mn+6 (MnO4-2)
В пробирку налейте 1мл раствора перманганата калия, добавьте 6-7 капель щелочи, прибавьте одну ложку сульфита натрия. Что наблюдаете? Наблюдения: Образовался раствор зелёного цвета.
Задание. Составьте уравнение, если известно, что в результате этой реакции образуются манганат калия, сульфат натрия и вода.
Расставьте коэффициенты методом электронного баланса.
К МnO4 + КOН + Na2SO3 К2МnO4 + Na2SO4 + H2О
МnO4 + КOН + Na2SO3 К2МnO4 + Na2SO4 + H2О
2КМn+7O4 + 2КOН + Na2S+4O3 = 2К2Мn+6O4 + Na2S+6O4 + H2O
Мn+7+1е = Мn+6 2 окислитель (восстановление)
S+4 – 2e = S+6 3 восстановитель (окисление)
Задание разноуровневое: если обучающиеся затрудняются написать уравнение реакции, то им можно предложить готовую схему реакции, в которой они расставляют коэффициенты.
Обсуждение результатов работы и запись уравнений реакций на доске.
Опыт 2. Взаимодействие перманганата калия с пероксидом водорода в различных средах. (Задания выполняются в микрогруппах по 2-3 человека).
В три пробирки налить 1-2 мл раствора перманганата калия.
Для создания среды раствора в первую пробирку добавить 1-2 капли раствора H2SO4. Во вторую пробирку ничего не добавлять. В третью – добавить 1-2 капли раствора щёлочи NaOH. Последовательно во все 3 пробирки добавить перекись водорода. Что происходит в каждой пробирке? Отметить наблюдения. Расставить коэффициенты в уравнениях реакций методом электронного баланса, найти восстановитель и окислитель, процессы окисления и восстановления.
1 пробирка: Среда – кислая
р-р КМnO4 + р-р H2SO4 + Н2О2
Наблюдения: раствор обесцветился.
К МnO4 + H2SO4 + Н2О2 МnSO4 + К2SO4 + Н2О + О2
МnO4 + H2SO4 + Н2О2 МnSO4 + К2SO4 + Н2О + О2
2КМn+7O4 + 3H2SO4 + 5Н2О2-1 = 2Мn+2SO4 + К2SO4 + 8Н2О + 5О20
Мn+7+5е = Мn+2 2 окислитель (восстановление)
2О-1 – 2е = О02 5 восстановитель (окисление)
2 пробирка: Среда нейтральная
р-р КМnO4 + Н2О2
Наблюдения: Выпал осадок бурого цвета оксид марганца (IV), выделение кислорода.
К МnO4 + Н2О2 О2 + МnО2 + КОН + Н2О
МnO4 + Н2О2 О2 + МnО2 + КОН + Н2О
2КМn+7O4 + 3Н2О2-1 = 3О20 + 2Мn+4О2 + 2КОН + 2Н2О
Мn+7+3е = Мn+4 2 окислитель (восстановление)
2О-1 – 2е = О02 3 восстановитель (окисление)
3 пробирка: Среда щелочная
р-р КМnO4 + р-р NaOH + Н2О2
Наблюдения: Цвет раствора изменился, образовался манганат калия, выделение кислорода.
К МnO4 + NaOH + Н2О2 К2МnO4 + Н2О + О2 + Na2МnO4
МnO4 + NaOH + Н2О2 К2МnO4 + Н2О + О2 + Na2МnO4
2КМn+7O4 + 2NaOH + Н2О2-1 = К2Мn+6O4 + 2Н2О + О20 + Na2МnO4
Мn+7+1е = Мn+6 2 окислитель (восстановление)
2О-1 – 2е = О02 1 восстановитель (окисление)
Создание проблемной ситуации:
А ещё мне нужна ваша помощь, я готовила к уроку раствор перманганата калия («марганцовка»), пролила стакан с раствором на полотенце. Вы проделали лабораторный опыты, а теперь предложите вещество, с помощью которого в домашних условиях можно очистить полотенце.
Демонстрационный опыт:
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH = 2Mn (CH3COO)2 +2CH3COOK+7O2 + 12H2O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO2 + 3H2O2 + 2CH3COOH = Mn(CH3COO)2 + 2O2 + 4H2O
После выведения пятен кусок ткани необходимо промыть водой.
Итак, от чего же зависит поведение перманганата калия в окислительно-восстановительных реакциях? Ответ: От реакции среды раствора.
Составьте схему «Влияние среды на изменение степеней окисления атомов, на примере иона MnO4- »
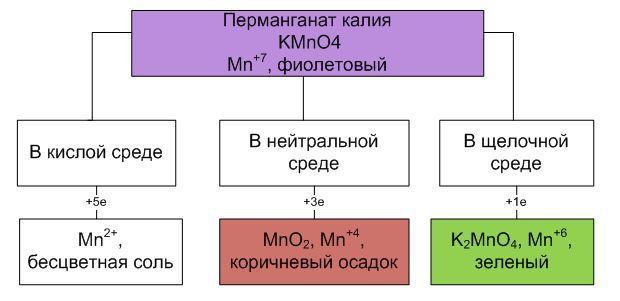
4. Подведение итогов урока. Формулировка выводов
Мы убедились в том, что реакция среды очень важна для протекания химических реакций. В разных средах продукты реакции могут быть различными.
Продукты окислительно- восстановительных реакций с раствором перманганата калия зависят от среды раствора. Для того, чтобы окислительно- восстановительные реакции протекали в нужном нам направлении, необходимо создавать соответствующую среду раствора.
Так, в нашем организме протекает множество окислительно-восстановительных реакций. Все биологические катализаторы – ферменты, работают при определенных рН. У здорового человека кровь имеет нейтральную среду рН = 7,36, желудочный сок – сильнокислую - рН = 1,7; кишечный сок – щелочную рН = 8. Если значение рН в крови – 7,2 – значит, в организме произошли серьезные нарушения. Для нормального протекания химических реакций где-то необходима кислая среда, где-то - щелочная, а где-то – нейтральная.
5. Рефлексия
По желанию выбрать себе фразу (несколько фраз), закончить ее (их) самостоятельно.
Сегодня я узнал(а)…_________________________________________________
Было интересно…___________________________________________________
Было трудно…_____________________________________________________
Я понял(а), что…___________________________________________________
Теперь я могу…_____________________________________________________
Я научилась ________________________________________________________
Литература
1. Всероссийский научно-методический журнал «Химия. Всё для учителя»,
№ 11- 12 (71 -72) ноябрь-декабрь, 2016, с.30-37.
2. Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля: учебник для студ. Учреждений сред. Проф. образования.- 3-е изд., перераб. И доп. – М.: Издательский центр «Академия», 2016.-272 с.
8






 МnO4 + H2SO4 + Na2SO3 МnSO4 + Na2SO4 + К2SO4 + Н2О
МnO4 + H2SO4 + Na2SO3 МnSO4 + Na2SO4 + К2SO4 + Н2О МnO4 + H2O + Na2SO3 МnO2 + Na2SO4 + КOH
МnO4 + H2O + Na2SO3 МnO2 + Na2SO4 + КOH МnO4 + H2SO4 + Н2О2 МnSO4 + К2SO4 + Н2О + О2
МnO4 + H2SO4 + Н2О2 МnSO4 + К2SO4 + Н2О + О2 МnO4 + Н2О2 О2 + МnО2 + КОН + Н2О
МnO4 + Н2О2 О2 + МnО2 + КОН + Н2О



















