Карбоновые кислоты
Многие из вас не избежали искушения воткнуть в муравейник прутик, посмотреть на панику муравьев, а потом лизнуть палочку. Насекомые «прогоняли» ее, выстреливая из специальных желез жидкость, содержащую кислоту. Благодаря работам выдающегося шведского химика Карла Вильгельма Шееле к концу 18 века стало известно около десяти различных органических кислот. Он выделил и описал лимонную, молочную, щавелевую и другие кислоты.
Что же объединяет такие разные по происхождению и нахождению в природе органические вещества?
В составе карбоновых кислот имеется карбоксильная группа.
Задание 1: Запишите определение карбоновых кислот.
R – COOH общая формула карбоновых кислот.
CnH2n+1 – COOH общая формула предельных одноосновных карбоновых кислот, где n может быть равно нулю.
По каким признакам можно классифицировать карбоновые кислоты?
Классификация карбоновых кислот:
1. по количеству карбоксильных групп:
а) одноосновные R – COOH (метановая, этановая кислоты); б) многоосновные HOOC – R – COOH (щавелевая, янтарная кислоты).
2. по природе углеводородного радикала: а) предельные (метановая, этановая кислоты);
б) ароматические (бензойная кислота); в) непредельные (олеиновая, линолевая, линоленовая кислоты).
Задание 2: Представьте классификацию карбоновых кислот в виде схемы.
Классификация по природе радикала типична для органических соединений. Она встречалась и для спиртов, и для альдегидов. Понятие «основность» типично для органических и для неорганических кислот. Что понималось под основностью неорганических кислот? Число атомов водорода, способных замещаться на металл. То же самое справедливо и для кислот органических, здесь легче считать число карбоксильных групп, каждая из которых содержит один подвижный атом водорода.
Номенклатура карбоновых кислот.Наиболее важными для изучения в школьном курсе являются предельные одноосновные карбоновые кислоты.
Задание 3: Записать названия кислот и солей.
| Формула | Международное название | Тривиальное название | Название солей |
| HCOOH | Метановая кислота | Муравьиная кислота | Формиаты |
| CH3COOH | Этановая кислота | Уксусная кислота | Ацетаты |
| CH3CH2COOH | Пропановая кислота | Пропионовая кислота | Пропионаты |
| CH3(CH2)2COOH | Бутановая кислота | Масляная кислота | Бутираты |
| CH3(CH2)3COOH | Пентановая кислота | Валериановая кислота | Валераты |
| CH3(CH2)4COOH | Гексановая кислота | Капроновая кислота | Капраты |
| C6H5COOH | Бензойная кислота | Бензойная кислота | Бензоаты |
| С17Н35COOH | Октадекановая кислота | Стеариновая кислота | Стеараты |
| С15Н31COOH | Гексадекановая кислота | Пальмитиновая кислота | Пальмитаты |
| HOOC - COOH | Этандиовая кислота | Щавелевая кислота | Оксалаты |
Алгоритм названий карбоновых кислот
Главную цепь необходимо начинать нумеровать с карбоксильной группы.
Указывают положение и название заместителей.
После корня, указывающего число атомов в цепи, идет суффикс, показывающий наличие или отсутствие двойных, тройных связей, их положение.
После этого добавляется «-овая» кислота. Если карбоксильных групп несколько, то перед –овая ставится числительное ( ди, три-…).
Задание 4: Записать физические свойства кислот
Физические свойства предельных одноосновных карбоновых кислот в значительной степени обусловлены наличием между молекулами прочных водородных связей (более прочных, чем между молекулами спиртов). Поэтому температуры кипения и растворимость в воде у кислот больше, чем у соответствующих спиртов.
С1 – С3 Жидкости с характерным резким запахом, хорошо растворимые в воде.
С4 – С9 Вязкие маслянистые жидкости с неприятным запахом, плохо растворимые в воде.
С10 - Твёрдые вещества не имеющие запаха, не растворимые в воде.
Задание 5: Записать получение карбоновых кислот
Окисление альдегидов.
В промышленности: 2RCHO + O2 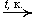 2RCOOH
2RCOOH
Лабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др.
Окисление спиртов: RCH2OH + O2 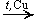 RCOOH + H2O
RCOOH + H2O
Окисление углеводородов: 2C4H10 + 5O2 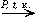 4CH3COOH + 2H2O
4CH3COOH + 2H2O
Из солей (лабораторный способ): CH3COONaкр. + H2SO4 конц. 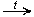 CH3COOH
CH3COOH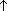 + NaHSO4
+ NaHSO4
Задание 6: Заполнить таблицу «Сравнение химических свойств неорганических и органических кислот».
| Свойство | Неорганические кислоты | Карбоновые кислоты |
|
|
|
|
-Уравнения всех реакций записать в молекулярной и ионной форме (кроме взаимодействия с индикаторами)
- Особые свойства карбоновых кислот выписать отдельно.
Задание 7. Описать представителей карбоновых кислот и их свойства:
Муравьиная кислота. НСООН Содержится в ядовитых железах муравьев, в крапиве, в еловой хвое.В 10 раз сильнее всех карбоновых кислот.Была получена в 1831 году Т. Пелузом из синильной кислоты.Используется: как протрава при крашении и дублении кожи, в медицине, при консервировании овощей, как растворитель капрона, нейлона, поливинила.Муравьиная кислота помогает пчелам. Во всех странах мира наблюдается гибель пчел от клещей Varroa. Прогрызая у пчел хитиновый покров, они высасывают гемолимфу и пчелы гибнут. Муравьиная кислота является действенным средством против этих клещей.
Свойства муравьиной кислоты. Бесцветная жидкость с резким запахом, хорошо растворимая в воде. Может проявлять свойства характерные как для кислот, так и для альдегидов.
HCOOH + Ag2O (аммиачный раствор) 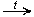 CO2 + H2O + 2Ag
CO2 + H2O + 2Ag
Уксусная кислота СН3СООН.Известна с незапамятных времен.В чистом виде выделена в 1700 г.В 1845 г. Г.Кольбе получил ее синтетическим путем.Может образовываться и синтетическим путем (скисание вина под действием бактерий.Встречается в некоторых растениях, поте, моче, желчи. За сутки человеческий организм выделяет 0,5 кг этой кислоты.
Задание 8.С какими из перечисленных соединений будет реагировать уксусная кислота?
Этан, этанол, пропан, гидроксид натрия, соляная кислота, хлор, аммиак, хлорэтан. Составить уравнения соответствующих рекаций.
Задание 9. Решить задачи.
Какая масса гидроксида натрия потребуется для полной нейтрализации 180 г 35% раствора уксусной кислоты?
Какое количество вещества и какая масса ацетата натрия образуется при взаимодействии растворов, содержащих 45 г уксусной кислоты и 45 г гидроксида натрия?
























