Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
Общая формула предельных монокарбоновых кислот CnH2n+1COOH
1. По типу углеводородного радикала, связанного с карбоксильной группой:
-
ароматические (бензойная кислота);
-
алифатические - предельные (капроновая кислота) и непредельные (акриловая кислота);
-
алициклические (хинная кислота);
-
гетероциклические (никотиновая кислота).
2. По числу карбоксильных групп:
-
одноосновные (муравьиная HCOOH, уксусная кислота CH3COOH)
-
двухосновные (щавелевая HOOC−COOH, янтарная (бутандиовая) кислота HOOC−CH2−CH2COOH)
-
многоосновные (лимонная кислота HOOC−CH2−C(OH)(COOH)−CH2−COOH).
НОМЕНКЛАТУРА И ИЗОМЕРИЯ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ
В соответствии с международной номенклатурой ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию углеводородного радикала окончание "-овая" и слово "кислота". При этом отсчет производится от первого атома углерода, входящего в состав карбоксильной группы. Это правило не распространяется на аминокислоты, для которых нумерация начинается со второго атома углерода, если считать атом карбоксильной группы.
Например: CH3−CH2−COOH - пропановая кислота, CH3−C(CH3)2−COOH - 2,2-диметилпропановая кислота.
Для названия карбоновых кислот часто используется рациональная номенклатура, в соответствии с которой к названию углеводорода (или УВ радикала) добавляют окончание "карбоновая" и слово "кислота", не включая при этом в нумерацию цепи атом углерода карбоксильной группы.
Например, C5H9COOH - циклопентанкарбоновая кислота, CH3−C(CH3)2−COOH - трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия:
| Название по ИЮПАК | Тривиальное название | Формула | Название соли |
| Метановая кислота | Муравьиная кислота | HCOOH | формиаты |
| Этановая кислота | Уксусная кислота | CH3COOH | ацетаты |
| Пропановая кислота | Пропионовая кислота | C2H5COOH | пропионаты |
| Бутановая кислота | Масляная кислота | C3H7COOH | бутираты |
| Пентановая кислота | Валериановая кислота | C4H9COOH | валераты |
| Гексановая кислота | Капроновая кислота | C5H11COOH | капронаты |
Для одноосновных карбоновых кислот характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Межклассовая изомерия со сложными эфирами
ФИЗИЧЕСКИЕ СВОЙСТВА карбоновых кислот
Карбоновые кислоты, благодаря карбоксильной группе, полярны и могут участвовать в образовании межмолекулярных водородных связей. Такими связями с молекулами воды объясняется неограниченная растворимость низших кислот (C1-C4) в воде и спирте. Высшие кислоты в воде растворяются плохо. Хорошо растворяются в этиловом спирте и диэтиловом эфире. Это связано с гидрофобными свойствами УВ-радикала в кислоте: чем больше масса радикала, тем меньше кислота растворима в воде.
Низшие кислоты – бесцветные, резко пахнущие жидкости, начиная с пентановой (валериановой) кислоты – маслянистые жидкости, высшие кислоты - твердые вещества без вкуса и запаха.
ХИМИЧЕСКИЕ СВОЙСТВА
одноосновных предельных карбоновых кислот
Карбоксильная группа полярная (см. подробно тему "Гомологические ряды карбоновых кислот"), вследствие этого карбоновые кислоты проявляют общие свойства, характерные для всех слабых неорганических кислот. Реакции протекают по так называемому кислотному центру
Реакции по кислотному центру
1. Карбоновые кислоты являются слабыми электролитами, константа диссоциации предельных монокарбоновых кислот уменьшается с увеличением числа атомов углерода в радикале:
RCOOH↔RCOO–+H+
Поэтому растворимые карбоновые кислоты изменяют окраску индикаторов (метилоранжа и лакмуса).
2. Кислоты реагируют с активными металлами:
2CH3COOH+Zn=(CH3COO)2Zn+H2
и с оксидами металлов:
MgO+CH3COOH=(CH3COO)2Mg+H2O
3. Реагируют с сильными основаниями (щелочами), с образованием соответствующих солей:
CH3COOH+NaOH⟶CH3COONa+H2O
4. Реагируют с солями слабых кислот, например, карбонатами (только те кислоты, которые сильнее угольной):
Na2CO3+2HCOOH=2HCOONa+CO2+H2O
Реакции по электрофильному центру
1. Реакция этерификации - это взаимодействие карбоновых кислот со спиртами в присутствии катализаторов - водоотнимающих средств (например, H2SO4 конц.), приводящее к образованию сложных эфиров:
RCOOH+R′OH=RCOOR′+H2O
Механизм реакции этерификации, как нуклеофильного замещения, представлен на схеме:
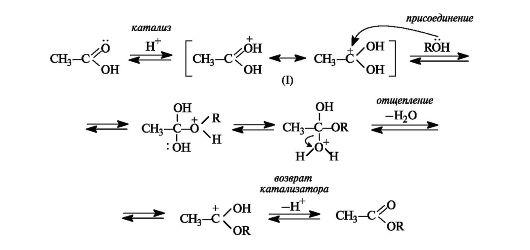
Этерификация - обратимая реакция. Смещение равновесия вправо возможно отгонкой из реакционной смеси образующегося эфира, отгонкой или связыванием воды, либо использованием избытка одного из реагентов. Реакция, обратная этерификации, приводит к гидролизу сложного эфира с образованием карбоновой кислоты и спирта.
2. С другими карбоновыми кислотами реакция также протекает в присутствии водоотнимающих средств и приводит к образованию ангидридов:
RCOOH+R′COOH→P2O5,t∘CRCOOOCR′+H2O
3. С аммиаком или аминами карбоновые кислоты реагируют с образованием амидов кислот:
CH3COOH+NH3→t∘CCH3CONH2+H2O
При действии на карбоновые кислоты аммиака (газообразного или в растворе) сначала образуется аммониевая соль, а при значительном нагревании сухие аммониевые соли теряют воду и превращаются в амиды.
4. Взаимодействие с хлорирующими агентами - хлоридами или бромидами фосфора (V), приводит к замещению гидроксильной группы на галоген и образованию хлорангидридов:
RCOOH+PCl5=RCOCl+POCl3+HCl
Окислительно-восстановительные реакции
Углерод в карбоксильной группе находится в степени окисления +2 и поэтому дальше не окисляется. Восстановление карбоксильной группы может происходить последовательно: сначала с образованием альдегидов и кетонов в присутствии восстановителей (LiAlH4, а затем до спиртов (см. подробно тему "Химические свойства альдегидов")
Реакции по углеводородному радикалу
Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала, для них возможны реакции замещения. Атомы водорода у второго (α) углеродного атома весьма подвижны. Поэтому при галогенировании в присутствии каталитических количеств красного фосфора происходит в первую очередь образование 2-галогенкарбоновой кислоты.
CH3−CH2−COOH+Br2→PCH3−CHBr−COOH+HBr
методы ПОЛУЧЕНИЯ карбоновых кислот
Лабораторными методами получения карбоновых кислот являются:
1. Окисление спиртов, альдегидов и кетонов
Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве условного окислителя [O] могут применяться KMnO4, K2Cr2O7, CuO и др.
R−CH2OH→[O]R−C(O)H→[O]R−COOH
2. Омыление (гидролиз) сложных эфиров
R−COOR1+KOH⟶R−COOK+R1OH
R−COOK+HCl⟶R−COOH+KCl
3. Жесткое окисление алкенов (перманганат калия в кислой среде):
CH2=CH2→KMnO4,H+CH3COOH
R−CH=CH−R1→KMnO4,H+R−COOH+R1−COOH
НАХОЖДЕНИЕ В ПРИРОДЕ и ПРИМЕНЕНИЕ карбоновых кислот
Соли высших предельных кислот являются мылами (подробно см. тему "Мыла"). Карбоновые кислоты являются частью природных животных жиров и растительных масел, восков, используются в пищевой, полимерной промышленности, в фармации и в органическом синтезе.
Наиболее широко используются уксусная и муравьиная кислота, являющиеся реагентами во многих процессах органического синтеза. Муравьиная кислота – широко применяется в медицине под названием "муравьиный спирт" (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя. Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Другие карбоновые кислоты также находят широкое применение.
Масляная кислота C3H7COOH – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота HOOC−COOH – в металлургической промышленности (удаление окалины), в средствах санитарной гигиены для удаления известкового налета.
Стеариновая C17H35COOH и пальмитиновая кислота CC15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
Задание для самостоятельного выполнения:
1. Запишите структурные формулы следующих соединений:
3-метилбутановая кислота,
2-пропилпентановая кислота,
3-метилгексановая кислота,
3,4- диметилоктановая кислота.




























