
Карбоновые кислоты
Выполнила
Учитель биологии и химии
Шукшина Светлана Михайловна
Бурнакский филиал МБОУ «Жердевская СОШ №2»

Тема урока: Карбоновые кислоты
Цели урока:
- рассмотреть строение молекул карбоновых кислот и карбоксильной группы;
- познакомиться с классификацией и номенклатурой карбоновых кислот;
- изучить физические свойства одноосновных карбоновых кислот;
- изучить химические свойства одноосновных карбоновых кислот.

ТЕСТ :
1. Карбонильная группа – это:
а) OH- б) –СОН в) – СООН г) – СО
2. Родовой суффикс класса альдегидов:
а) -ол б) -аль в) –он г) –ен
3. Чтобы отличить этаналь от этанола используют
а) H 2 б) Br 2 в) Ag 2 O/NH 3 г) NaOH
4. При пропускании паров пропанола-1 через трубку с нагретым оксидом меди(II) образуется
а) пропаналь б) пропанол-2 в) пропен г) пропанон
5. Определите вещество X в следующей схеме превращений:
Этанол Х уксусная кислота
а) бромэтан б) этаналь в) этен г) диэтилловый эфир

Правильные ответы:
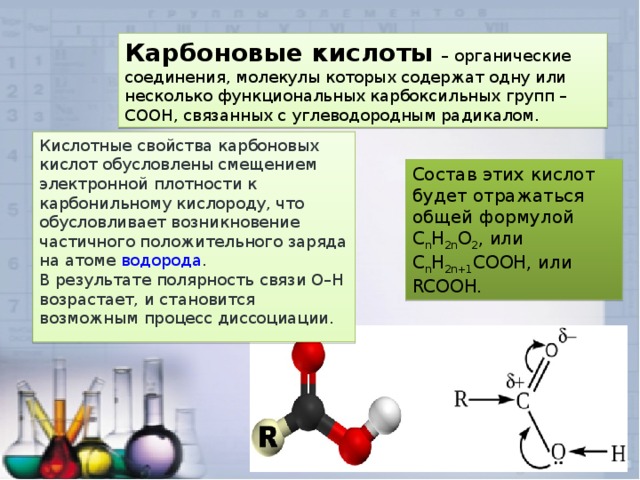
Карбоновые кислоты – органические соединения, молекулы которых содержат одну или несколько функциональных карбоксильных групп –СООН, связанных с углеводородным радикалом.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду, что обусловливает возникновение частичного положительного заряда на атоме водорода .
В результате полярность связи О–Н возрастает, и становится возможным процесс диссоциации.
Состав этих кислот будет отражаться общей формулой C n H 2n O 2 , или C n H 2n+1 COOH, или RCOOH.

Физические свойства
Низшие карбоновые кислоты , содержащие до 3 атомов углерода – бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот, содержащих 4–9 атомов углерода – маслянистые жидкости с неприятным запахом. Кислоты, содержащие больше 10 атомов водорода – твёрдые вещества, нерастворимые в воде.
Растворимость карбоновых кислот в воде и высокие температуры кипения связаны с образованием межмолекулярных водородных связей. В твердом состоянии карбоновые кислоты существуют главным образом в виде циклических димеров, а в жидком происходит и линейная ассоциация.

Классификация
Предельные одноосновные карбоновые кислоты
HCOOH
метановая
CH 3 COOH
этановая
C 2 H 5 COOH
муравьиная
уксусная
пропановая
C 3 H 7 COOH
пропионовая
бутановая
C 4 H 9 COOH
C 5 H 11 COOH
масляная
пентановая кислота
гексановая кислота
валериановая кислота
C 17 H 35 COOH
капроновая кислота
октадекановая
Непредельные одноосновные карбоновые кислоты
стеариновая
CH 2 =CH–COOH
2-пропеновая
CH 3 –CH=CH–COOH
CH 2 =CH–CH 2 –COOH
акриловая
2-бутеновая
CH 2 =C(CH 3 )COOH
кротоновая
3-бутеновая
винилуксусная
2-метил-2-пропеновая
метакриловая
редельные одноосновные карбоновые кислоты
HCOOH
CH 3 COOH
метановая
этановая
C 2 H 5 COOH
муравьиная
уксусная
пропановая
C 3 H 7 COOH
бутановая
пропионовая
C 4 H 9 COOH
масляная
пентановая кислота
C 5 H 11 COOH
гексановая кислота
C 17 H 35 COOH
валериановая кислота
октадекановая
капроновая кислота
Непредельные одноосновные карбоновые кислоты
стеариновая
CH 2 =CH–COOH
2-пропеновая
CH 3 –CH=CH–COOH
2-бутеновая
акриловая
CH 2 =CH–CH 2 –COOH
3-бутеновая
CH 2 =C(CH 3 )COOH
кротоновая
2-метил-2-пропеновая
винилуксусная
метакриловая

Изомеры и гомологи
Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров (сокращенно R'—COOR'') с тем же числом атомов углерода. Общая формула и тех, и других C n H 2 n O 2 .
г о м о л о г и
HCOOH метановая (муравьиная)
CH 3 COOH этановая (уксусная)
CH 3 CH 2 COOH пропановая (пропионовая)
CH 3 (CH 2 ) 2 COOH бутановая (масляная)
HCOOCH 3 метиловый эфир муравьиной кислоты
2-метилпропановая
и з о м е р ы
HCOOCH 2 CH 3 этиловый эфир муравьиной кислоты
HCOOCH 2 CH 2 CH 3 пропиловый эфир муравьиной кислоты
CH 3 COOCH 3 метиловый эфир уксусной кислоты
CH 3 COOCH 2 CH 3 этиловый эфир уксусной кислоты
CH 3 CH 2 COOCH 3 метиловый эфир пропионовой кислоты
г о м о л о г и
HCOOH метановая (муравьиная)
CH 3 COOH этановая (уксусная)
CH 3 CH 2 COOH пропановая (пропионовая)
HCOOCH 3 метиловый эфир муравьиной кислоты
CH 3 (CH 2 ) 2 COOH бутановая (масляная)
HCOOCH 2 CH 3 этиловый эфир муравьиной кислоты
2-метилпропановая
и з о м е р ы
HCOOCH 2 CH 2 CH 3 пропиловый эфир муравьиной кислоты
CH 3 COOCH 3 метиловый эфир уксусной кислоты
CH 3 COOCH 2 CH 3 этиловый эфир уксусной кислоты
CH 3 CH 2 COOCH 3 метиловый эфир пропионовой кислоты

Алгоритм составления названий карбоновых кислот
- Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода карбоксильной группы.
- Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода карбоксильной группы.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс "-ов", окончание "-ая" и слово "кислота".

Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот. 2СH 3 COOH + Mg = (CH3COO) 2 Mg + H 2 2СH 3 COOH + СaO = (CH3COO) 2 Ca + H 2 O H–COOH + NaOH = H–COONa + H 2 O 2СH 3 CH 2 COOH + Na 2 CO 3 = 2CH 3 CH 2 COONa + H 2 O + CO 2 СH 3 CH 2 COOH + NaHCO 3 = CH 3 CH 2 COONa + H 2 O + CO 2
Карбоновые кислоты слабее многих сильных минеральных кислот (HCl, H 2 SO 4 и т.д.) и поэтому вытесняются ими из солей: СH 3 COONa + H 2 SO 4 (конц.) ––t°® CH 3 COOH + NaHSO 4

Химические свойства карбоновых кислот
Для кислот характерны три типа реакций: замещения иона водорода карбоксильной группы (образование солей); с участием гидроксильной группы (образование сложных эфиров, галогенангидридов, ангидридов кислот); замещения водорода в радикале.
Диссоциация с образованием катионов водорода и анионов кислотного остатка:
CH 3 – COOH CH 3 – COO - + H +
Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода. Так, железо восстанавливает водород из уксусной кислоты: 2CH 3 – COOH + Fe (CH 3 COO) 2 Fe + H 2
Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
2R – COOH + Ca(OH) 2 (R - COO) 2 Ca + 2H 2 O
Взаимодействие с солями слабых кислот с образованием последних:
CH 3 COOH + C 17 H 35 COONa CH 3 COONa + C 17 H 35 COOH

Взаимодействие с основными оксидами:
2RCOOH + СаО = (RCOO)2Ca + Н 2 О
Окисление муравьиной кислоты (эта реакция свойственна только данной кислоте):
2KMnO 4 + 5HCOOH + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + +5CO 2 ↑ + 8H 2 O
Реакции замещения (с галогенами) – в нее способны вступать предельные карбоновые кислоты. Например, взаимодействие уксусной кислоты с хлором:
CH 3 – COOH + Cl 2 CH 2 Cl – COOH + HCl

Химические свойства карбоновых кислот
Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров – реакция этерификации:
CH 3 – C – OH + C 2 H 5 – OH CH 3 – C – OC 2 H 5 + H 2 O
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода. Реакция этерификации обратима.
Реакции присоединения по кратной связи – в них вступают непредельные карбоновые кислоты. Для кислоты, содержащей в радикале одну π-связь, можно записать уравнение в общем виде:
C n H 2n-1 COOH + H 2 C n H 2n+1 COOH

Химические свойства карбоновых кислот
В результате реакции взаимодействия между акриловой кислотой и бромной водой присоединение галогена по месту двойной связи в соответствии с правилом Марковникова; образуется 2,3-дибромпропановая кислота
CH 2 =CH-COOH + Br 2 → CH 2 Br-CHBr-COOH
В результате реакции взаимодействия между 2-метилбутановой кислотой и хлоридом фосфора (V) образуется соответствующий хлорангидрид
CH 3 -CH 2 -C(CH 3 )H-COOH + PCl 5 →CH 3 -CH 2 -C(CH 3 )H-COOCl + POCl 3 + HCl.

Применение
Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она также используется при
крашении тканей и бумаги

Применение
Уксусная кислота – хороший растворитель многих органических веществ. Используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества,
используемые для борьбы с
сорняками, - гербициды.
Уксусная кислота является
основным компонентом
винного уксуса.









































