3
3.2. Задачи на смеси
(МГУ, 2015) Смесь уксусной и пропионовой кислот нейтрализовали 86.15 мл 20%-го раствора гидроксида калия с плотностью 1.3 г/мл. Образовавшийся раствор выпарили и прокалили с избытком твёрдой щёлочи, при этом выделился газ с плотностью по воздуху, равной 0.914. Определите состав газа и объёмные доли соединений в нём. Рассчитайте массовые доли кислот в исходной смеси.
Смесь монооксида азота и диоксида азота общей массой 53 г содержит 9.03·1023 атомов азота. Определите количества каждого из газов. Как изменится плотность смеси газов при добавлении к ней СО2 (при неизменных температуре и давлении)?
Смесь магния и фосфора прокалили без доступа воздуха, образовавшийся продукт разделили на три равные части. Первую часть обработали водой, вторую – избытком соляной кислоты, в обоих случаях выделилось по 0.978 л газа (25 °C, давление 1 атм). Третью часть продукта нагрели с избытком концентрированной азотной кислоты, и для полного поглощения выделившегося при этом оксида азота (IV) потребовалось 136.3 мл 15%-ного раствора КОН (плотность 1.15 г/мл). Установите мольную долю магния в исходной смеси.
При сгорании смеси двух органических соединений образуются только углекислый газ и вода. Общая масса продуктов сгорания равна 32 г, а массовая доля водорода в ней – 5%. Установите качественный и количественный состав исходной смеси, если известно, что массовая доля углерода в ней составляет 40%.
(МОШ, 2012) Один литр газообразной смеси двух непредельных углеводородов при полном гидрировании может присоединить 1.8 литра водорода. При сгорании одного литра исходной смеси образуется 2.2 литра углекислого газа. Определите качественный и количественный состав смеси. Все объемы измерены при одинаковых условиях. Рассчитайте плотность исходной смеси по водороду.
(ВсОШ 2015, финальный этап) Природный газ, состоящий из четырех низших алканов, имеет плотность 0.940 г/л при нормальном атмосферном давлении и температуре 25 оС.
Какие из перечисленных ниже величин можно определить для этого газа однозначно? Рассчитайте эти величины.
а) Средняя молярная масса;
б) плотность при нормальных условиях;
в) плотность сжиженного газа;
г) мольные доли алканов;
д) массовая доля углерода в смеси;
е) объём кислорода, необходимый для полного сжигания 1 л смеси;
ж) теплоту образования 1 моль смеси из графита и водорода;
з) теплоту сгорания 1 моль смеси.
Объясните кратко, почему нельзя найти остальные величины.
Определите минимально возможное и максимально возможное содержание метана в данном природном газе (в мольных %).
Справочные данные, которые могут понадобиться.
теплота испарения графита: Qисп = –705 кДж/моль,
средние энергии связей: E(H–H) = 436 кДж/моль, E(C–C) = 334 кДж/моль, E(C–H) = 412 кДж/моль, теплоты образования: Qобр(CO2) = 394 кДж/моль, Qобр(H2O) = 242 кДж/моль.
Решение (В. В. Еремин)
Идея задачи состоит в том, что любую смесь газообразных алканов, независимо от её конкретного состава, можно рассматривать как индивидуальный алкан со средней формулой CxH2x+2 (x – среднее число атомов углерода в молекуле, рассчитанное с учётом мольных долей газов; оно может быть нецелым). Например, смесь равных объёмов CH4 и C2H6 характеризуется средней формулой C1.5H5.
Для такого «усреднённого» алкана можно рассчитать все величины, кроме (в) и (г). Первую нельзя определить, потому что неизвестны плотности жидких алканов, а вторую – потому, что для определения точного состава смеси 4 веществ не хватает данных.
1. а) 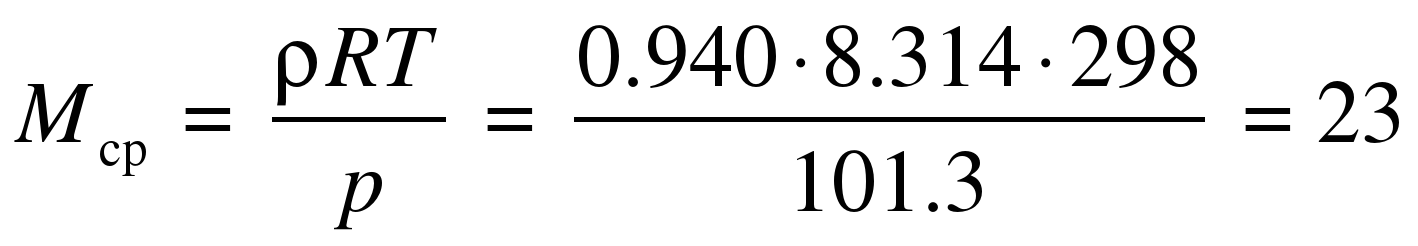 г/моль.
г/моль.
По молярной массе найдём среднюю формулу смеси CxH2x+2, это потребуется для дальнейших расчётов.
14x + 2 = 23, x = 1.5. Средняя формула смеси – C1.5H5.
б) При нормальных условиях все низшие алканы – ещё газы, поэтому
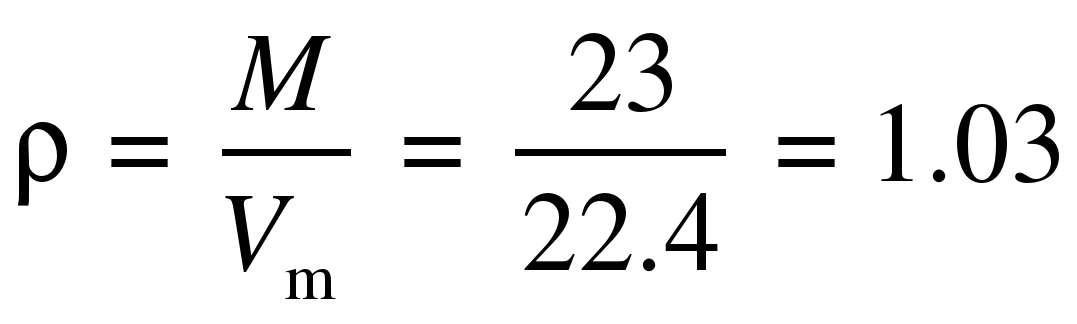 г/л.
г/л.
в) –
г) –
д) Массовую долю углерода можно найти по средней формуле:
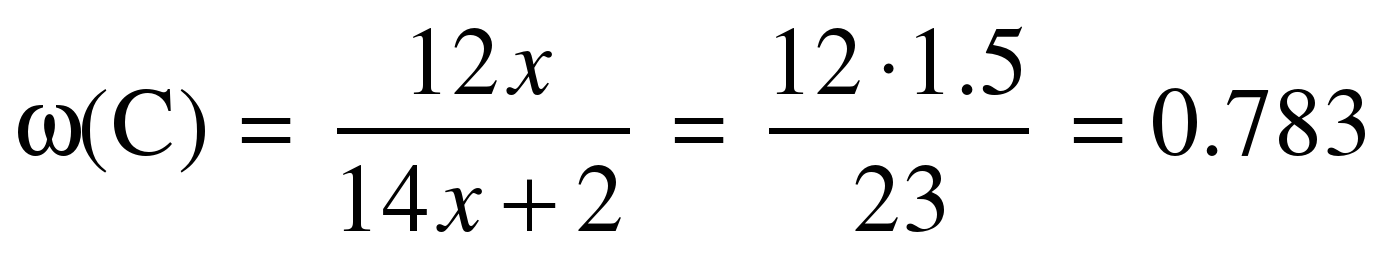 = 78.3%.
= 78.3%.
Это же значение можно определить и стандартным способом, не используя понятие средней формулы. Возьмем 1 моль смеси, пусть он содержит a моль CH4, b моль C2H6, c моль C3H8 и (1–a–b–c) моль C4H10. Запишем среднюю молярную массу смеси:
23 = 16a + 30b + 44c + 58(1–a–b–c),
откуда
3a + 2b + c = 2.5.
Массовая доля углерода в смеси:
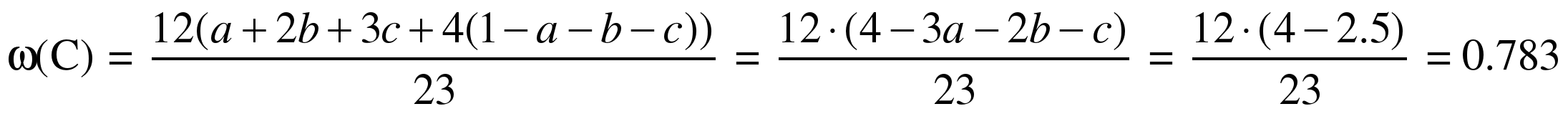 .
.
Аналогичные расчёты можно выполнить и для величин в пунктах (е)–(з), если найти соответствующие величины для каждого алкана по отдельности. Дальше мы будем пользоваться только понятием средней формулы.
е) Уравнение полного сгорания алканов:
CxH2x+2 + (3x+1)/2 O2 = xCO2 + (x+1)H2O
V(O2) = (3x+1)/2 V(CxH2x+2),
V(CxH2x+2) = 1 л, x = 1.5,
V(O2) = 2.75 л.
ж) Найдём теплоту образования индивидуального алкана, содержащего x атомов углерода, из простых веществ:
xC(гр) + (x+1)H2 = CxH2x+2 + Qобр
Для получения 1 моля алкана надо испарить x молей графита, разорвать (x+1) молей связей H–H, а затем образовать (x–1) молей связей C–C и (2x+2) молей связей C–H. По закону Гесса,
Qобр(CxH2x+2) = (–705)x – (x+1)436 + (x–1)334 + (2x+2)412 = 17x + 54 (кДж/моль)
при x = 1.5
Qобр(смеси) = 171.5 + 54 = 79.5 кДж/моль.
з) По уравнению реакции сгорания из п. (е),
Qсгор(CxH2x+2) = xQобр(CO2) + (x+1)Qобр(H2O) – Qобр(CxH2x+2) =
= 394x + 242 (x+1) – (17x+54) = 619x + 188 (кДж/моль)
при x = 1.5
Qсгор(смеси) = 6191.5 + 188 = 1116.5 кДж/моль.
2. Максимально возможное содержание метана в смеси будет в случае, когда остальная часть смеси будет представлена только самым тяжёлым газом – бутаном, а этана и пропана будет пренебрежимо мало. Обозначим мольную долю метана в такой смеси xmax и выразим через неё среднюю молярную массу:
16xmax + 58(1–xmax) = 23,
xmax = 0.833 = 83.3%
Минимальное количество метана в смеси соответствует случаю, когда остальная часть смеси содержит только самый лёгкий газ – этан.
16xmin + 30(1–xmin) = 23,
xmin = 0.5 = 50%
Ответы.
1. а) Mср = 23 г/моль.
б) = 1.03 г/л.
в) Однозначно определить нельзя.
г) Однозначно определить нельзя.
д) (C) = 78.3%.
е) V(O2) = 2.75 л.
ж) Qобр(смеси) = 79.5 кДж/моль.
з) Qсгор(смеси) = 1116.5 кДж/моль.
2. Содержание метана – от 50 до 83.3 мол.%.

















