
§ 29. Химические свойства, получение и применение простых аминов. Анилин

Химические свойства аминов во многом определяются их функциональной группой -NH 2 . Следовательно, амины сходны с аммиаком. Амины также являются производными углеводородов, следовательно, проявляют и сходные с ними свойства .

- Аминам, как и большинству органических соединений, свойственна реакция горения. Амины горят на воздухе (аммиак горит в атмосфере кислорода)
- Взаимодействие аминов с водой . Как и аммиак, амины обладают осно́вными свойствами. Растворимые амины — более сильные основания, чем аммиак.

Взаимодействие аминов с кислотами. Как и другие основания, практически все амины реагируют с кислотами. При взаимодействии метиламина с соляной кислотой образуется соль — хлоридметиламин (его образование подобно образованию NH 4 Cl): Подобным образом взаимодействуют амины и с другими кислотами (серной, уксусной, фосфорной и др.). В результате этой реакции образуются соли аминов .
![Качественная реакция на соли аминов [CH3NH3]+Cl- + Na+OH- → CH3NH2↑ + Н2O + Na+Cl- Промышленное получение алифатических аминов](https://fsd.multiurok.ru/html/2023/02/03/s_63dd00a1c3edf/img4.jpg)
Качественная реакция на соли аминов
[CH3NH3]+Cl- + Na+OH- → CH3NH2↑ + Н2O + Na+Cl-
Промышленное получение алифатических аминов
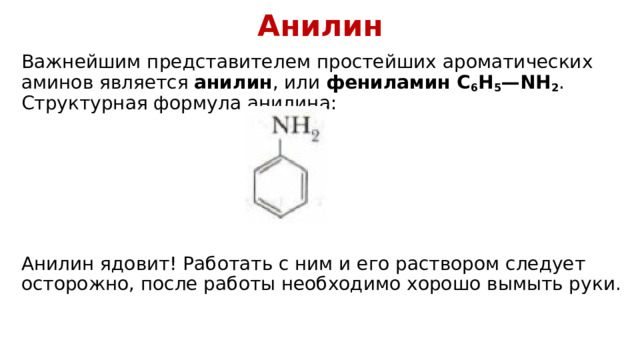
Анилин
Важнейшим представителем простейших ароматических аминов является анилин , или фениламин C 6 H 5 —NH 2 . Структурная формула анилина:
Анилин ядовит! Работать с ним и его раствором следует осторожно, после работы необходимо хорошо вымыть руки.
![Химические свойства анилина Взаимодействие с кислотами: [C 6 H 5 NH 3 ] + Cl - + NaOH → C 6 H 5 NH 2 + NaCl + H 2 O Анилин в отличие от алифатических аминов взаимодействует с бромной водой.](https://fsd.multiurok.ru/html/2023/02/03/s_63dd00a1c3edf/img6.jpg)
Химические свойства анилина
- Взаимодействие с кислотами:
[C 6 H 5 NH 3 ] + Cl - + NaOH → C 6 H 5 NH 2 + NaCl + H 2 O
Анилин в отличие от алифатических аминов взаимодействует с бромной водой.
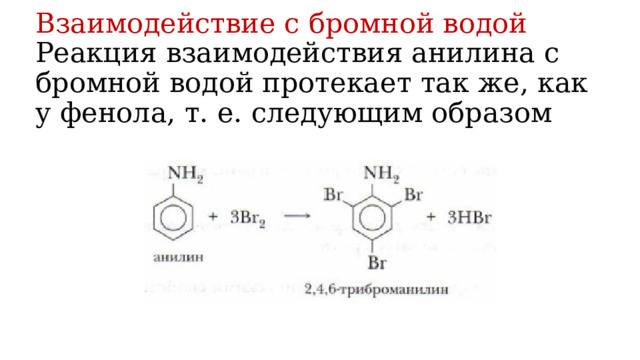
Взаимодействие с бромной водой Реакция взаимодействия анилина с бромной водой протекает так же, как у фенола, т. е. следующим образом

- Анилин легко окисляется. При действии на анилин хлорной известью (окислитель) наблюдается фиолетовое окрашивание, это качественная реакция на анилин.
- При действии на анилин хромовой смеси (К2Сr2O7 + H2SO4) вначале образуется промежуточное тёмно-зелёное соединение, которое затем переходит в чёрный анилин, используемый в качестве красителя — анилинового чёрного.











![Качественная реакция на соли аминов [CH3NH3]+Cl- + Na+OH- → CH3NH2↑ + Н2O + Na+Cl- Промышленное получение алифатических аминов](https://fsd.multiurok.ru/html/2023/02/03/s_63dd00a1c3edf/img4.jpg)

![Химические свойства анилина Взаимодействие с кислотами: [C 6 H 5 NH 3 ] + Cl - + NaOH → C 6 H 5 NH 2 + NaCl + H 2 O Анилин в отличие от алифатических аминов взаимодействует с бромной водой.](https://fsd.multiurok.ru/html/2023/02/03/s_63dd00a1c3edf/img6.jpg)























