
«Уксусная кислота»
Химические свойства и применение

Цели и задачи урока
- Познакомиться с общими свойства и областями применения карбоновых кислот на примере уксусной кислоты;
- Научиться составлять уравнения химических реакций уксусной кислоты с веществами
- Учиться обращаться с органическими веществами, лабораторной посудой и оборудованием, соблюдать правила безопасного поведения

Историческая справка :
И.Р. Глаубер
Т.Е. Ловиц
Карл Шееле

Уксусная кислота издавна использовалась не только в пищу. С ее помощью консервировали многие продукты ( овощи, мясо, рыбу), ее парами окуривали больных и их жилища при эпидемиях , добавляли в воду для омывания тела, ополаскивания волос и промывания гнойных ран.

Применение уксусной кислоты
- Значительные количества уксусной кислоты идут на производство ацетона, ацетилцеллюлозы, синтетических красителей, используются при крашении и печатании тканей и в пищевой промышленности. Основные соли уксусной кислоты Al, Fe, Cr и другие служат протравами при крашении; они обеспечивают прочную связь красителя с текстильным волокном.

- Производные уксусной кислоты широко применяют как растворители (особенно этилацетат) для нитроцеллюлозных лаков, глифталевых и полиэфирных смол, в производстве киноплёнки и целлулоида, а также в пищевой промышленности и парфюмерии. В производстве полимеров значительную роль играют искусственные волокна, лаки и клеи на основе винилацетата.

Осторожно!
- Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Хроническое действие паров ведёт к заболеваниям носоглотки и к конъюнктивитам. Предельно допустимая концентрация её паров в воздухе 0,005 мг/л. Растворы с концентрацией выше 30% вызывают ожоги.

Уксусная кислота
- Уксусная кислота (метанкарбоновая, этановая кислота) - СН 3 СООН — бесцветная жидкость с резким запахом и кислым вкусом.
- Температура плавления составляет 16,75°С, температура кипения 118,1°C
- Является хорошим растворителем для многих органических веществ

Уксусная кислота
- Уксусная кислота принадлежит к слабым кислотам.
- Она во всех отношениях смешивается с водой, спиртом, эфиром, бензолом и нерастворима в сероуглероде.
- При разбавлении уксусной кислоты водой происходит сокращение объёма раствора.
- Широко распространена в природе


в\ карбоксильная
1.Функциональная группа карбоновых кислот
называется :
в\ СН 3 СНО , г\ Н 2 СО 3 .
2. К карбоновым кислотам не относятся:
б\С 17 Н 35 СООН г\ С 15 Н 33 СООН
3. К высшим карбоновым кислотам относятся:
а\ С 17 Н 33 СООН в\ С 17 Н 31 СООН
4.Укажите ненасыщенные карбоновые кислоты:
б\ двухосновной
5. Щавелевая кислота НСОО-СООН является:
6. Сильная кислота, ядовитая, вызывает ожоги, растворима в воде, имеет резкий запах, применяется как бактерицидное средство, в медицине, производстве растворителей, ароматизаторов - это свойства:
а\ муравьиной кислоты
в\ при температуре ниже 16,5 градуса превращается в бесцветные кристаллы, г\ жидкость , растворима в воде, с характерным запахом.
7. Для этановой кислоты характерно:
8. Высшие карбоновые кислоты входят в состав
б\ жиров
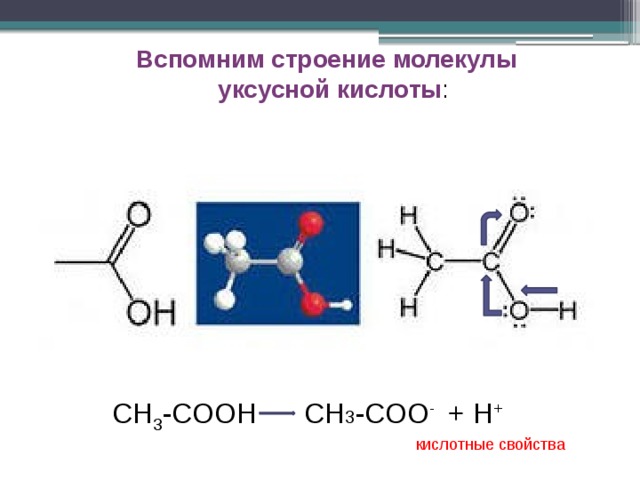
Вспомним строение молекулы
уксусной кислоты :
СН 3 -СООН СН 3 -СОО - + Н +
кислотные свойства

« Опыт – единственно верный путь спрашивать природу и слышать ее ответ в лаборатории»
Д.И.Менделеев:
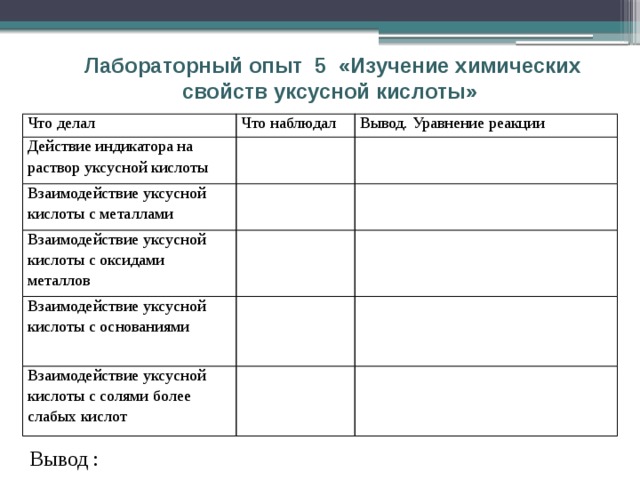
Лабораторный опыт 5 «Изучение химических свойств уксусной кислоты»
Что делал
Что наблюдал
Действие индикатора на раствор уксусной кислоты
Вывод. Уравнение реакции
Взаимодействие уксусной кислоты с металлами
Взаимодействие уксусной кислоты с оксидами металлов
Взаимодействие уксусной кислоты с основаниями
Взаимодействие уксусной кислоты с солями более слабых кислот
Вывод :

Физкультминутка

СН 3 -СООН СН 3 -СОО -- + Н +
СН 3 -СООН + Zn (СН 3_ -СОО) 2 Zn + Н 2
СН 3 -СООН +СаО (СН 3 -СОО) 2 Са+ Н 2 О
СН 3 -СООН + NaОН СН 3 -СООNa + Н 2 О
СН 3 -СООН + СаСО 3 (СН 3 -СОО) 2 Са + СО 2 + Н 2 О

Выберите формулы веществ, с которыми будет реагировать уксусная кислота, составьте уравнения соответствующих реакций:
Са, СО 2 , СuSO 4 , MgO, Cu, KOH, Na 2 CO 3 , H 2 O)
Са , MgO , KOH , Na 2 CO 3
СН 3 СООН + Са = (СН 3 СОО) 2 Са + Н 2
СН 3 СООН + MgO = (СН 3 СОО) 2 Mg + H 2 O
СН 3 СООH + KOH = СН 3 СООК + H 2 O
СН 3 СООН + Na 2 CO 3 = СН 3 СОО Na + H 2 O + СО 2
соли уксусной кислоты - ацетаты

Выбрать верные утверждения о химических свойствах уксусной кислоты
1.Уксусная кислота – слабая кислота
2. Уксусная кислота частично диссоциирует на ионы в водных растворах, слабый электролит
3. Уксусная кислота полностью диссоциирует на ионы в водных растворах
4. Уксусная кислота изменяеит окраску лакмуса с фиолетового на синий
5. При взаимодействии уксусной кислоты с активными металлами образуются соли – ацетаты и газ водород
6. Уксусная кислота взаимодействует с основными оксидами и основаниями с образованием соли и водорода
7. Уксусная кислота не взаимодействует с солями более сильных кислот
8. Уксусная кислота имеет свойства, сходные со свойствами неорганических кислот, т.к. диссоциирует на катионы водорода и анионы кислотного остатка

1. Уксусная кислота – слабая кислота
2 . Уксусная кислота частично диссоциирует на ионы в водных растворах, слабый электролит
3.Уксусная кислота полностью диссоциирует на ионы в водных растворах
4.Уксусная кислота изменяеит окраску лакмуса с фиолетового на синий
5 .При взаимодействии уксусной кислоты с активными металлами образуются соли – ацетаты и газ водород
6.Уксусная кислота взаимодействует с основными оксидами и основаниями с образованием соли и водорода
7. Уксусная кислота не взаимодействует с солями более сильных кислот
8. Уксусная кислота имеет свойства, сходные со свойствами неорганических кислот, т.к. диссоциирует на катионы водорода и анионы кислотного остатка

Цели и задачи урока
-Познакомиться с общими свойства и областями применения карбоновых кислот на примере уксусной кислоты;
-Научиться составлять уравнения химических реакций уксусной кислоты с веществами
-Учиться обращаться с органическими веществами, лабораторной посудой и оборудованием, соблюдать правила безопасного поведения
Домашнее задание: § 36, № 4, 6, домашний эксперимент












































