
Химические свойства алканов
(10 класс, профильный )

Вспомним:
- Что такое алканы? Общая формула?
- Какие типы химических реакций вам знакомы?
3.Как вы думаете, какие типы химических реакций характеры для алканов?
АЛКАНЫ (предельные, насыщенные, парафины) – это углеводороды с общей формулой CnH2n+2.
1.Реакции присоединения
2. Реакции отщепления
3.Реакции восстановления и окисления
4.Реакции замещения
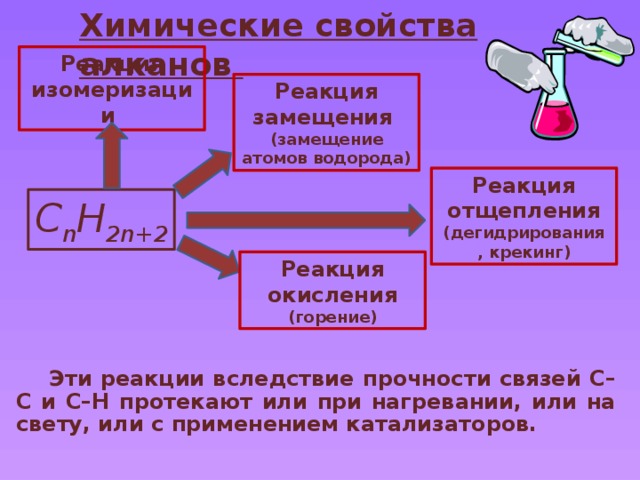
Химические свойства алканов
Реакция изомеризации
Реакция замещения
(замещение атомов водорода)
Реакция отщепления
(дегидрирования , крекинг)
C n H 2n+2
Реакция окисления
(горение)
Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.

Химические свойства алканов
В обычных условиях алканы химически инертны . Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – перманганатом калия KMnO4 и т. п.

Реакции замещения
- Реакция галогенирования (с Cl 2 – на свету, с Br 2 – при нагревании). Протекают по механизму радикального замещения.
Замещение атома водорода галогеном легче всего идет у менее гидрогенизированного третичного атома углерода, затем у вторичного и в последнюю очередь у первичного.
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия) ;
метан хлорметан
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия);
дихлорметан
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3 стадия);
трихлорметан
CHCl 3 + Cl 2 hν → CCl 4 + HCl (4 стадия).
тетрахлорметан
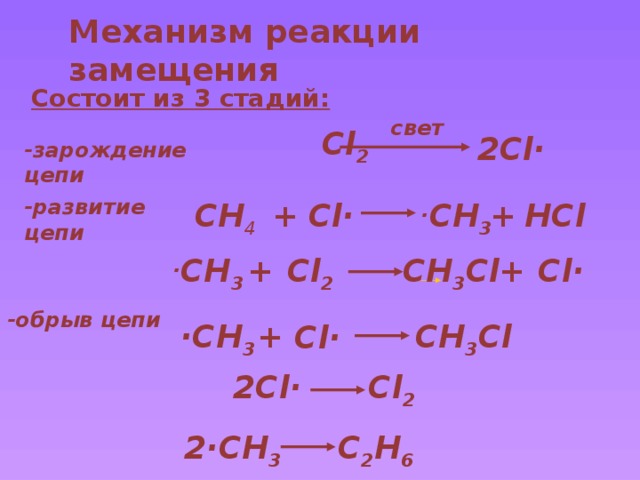
Механизм реакции замещения
Состоит из 3 стадий:
свет
Cl 2
2Cl·
-зарождение цепи
-развитие цепи
+
HCl
Cl·
· CH 3
+
CH 4
· CH 3
+
Cl 2
CH 3 Cl
+
Cl·
-обрыв цепи
+
CH 3 Cl
·CH 3
Cl·
2Cl·
Cl 2
2·CH 3
C 2 H 6
6

2) Реакция нитрования или реакция Коновалова – это замещение атома водорода нитрогруппой. Наилучшие результаты наблюдаются с алканами, содержащими третичные углеродные атомы.
t,p
CH 3 –CH(CH 3 )–CH 3 +HO-NO 2 →CH 3 -C (CH 3 )–CH 3 + H 2 O |
NO 2
3) Сульфирование – замещение атома водорода сульфогруппой. При нагревании конц. серная кислота («дымящаяся») дает с высшими парафинами сульфокислоты.
R-H + H 2 SO 4 → R-SO 3 H + H 2 O
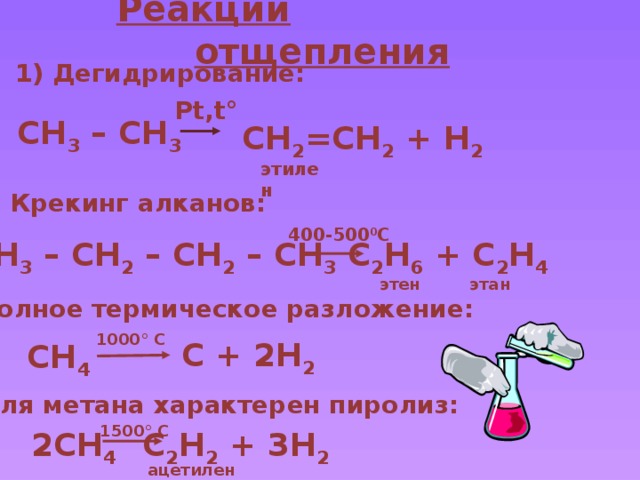
Реакции отщепления
1) Дегидрирование:
Pt,t°
CH 3 – CH 3
CH 2 =CH 2 + H 2
этилен
2) Крекинг алканов:
400-500 0 С
CH 3 – CH 2 – CH 2 – CH 3
C 2 H 6 + C 2 H 4
этен
этан
3) Полное термическое разложение:
1000° C
C + 2H 2
CH 4
4) Для метана характерен пиролиз:
1500° C
C 2 H 2 + 3H 2
2CH 4
ацетилен
8
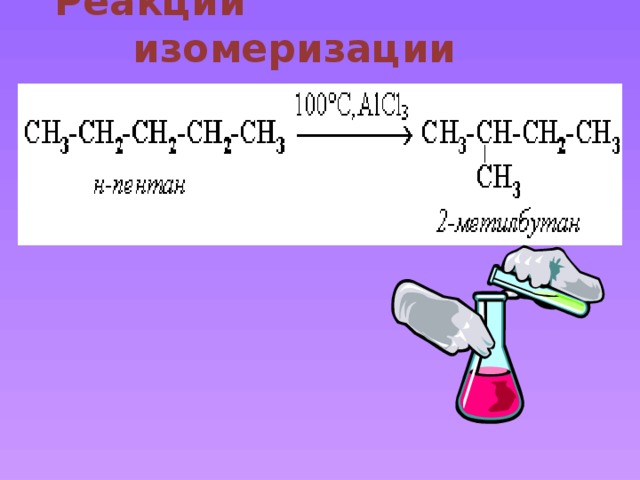
Реакции изомеризации
8

Реакции окисления
Все алканы горят с образованием углекислого газа и воды:
При недостатке кислорода алканы могут сгорать до угарного газа или с образованием сажи (коптят):
8








































