Данная презентация предназначена для проведения урока по изучению предельных углеводородов в 10 классе. По данной презентации можно объяснить гибридизацию алканов, составление названий алканов по систематической номенклатуре, разобрать гомологический ряд, физические и химические свойства алканов, а также получение и применение предельных углеводородов.
Просмотр содержимого документа
«Презентация "Предельные углеводороды"»

Урок химии в 10 классе
ПРЕДЕЛЬНЫЕ
УГЛЕВОДОРОДЫ
Автор: Асанова Н.Ю.
Учитель химии МАОУ СОШ № 38
Г. Калининград

С n H 2n+2
- Алканы (парафины) – предельные (насыщенные) углеводороды, в молекулах которых все атомы связаны одинарными сигма (σ) связями.
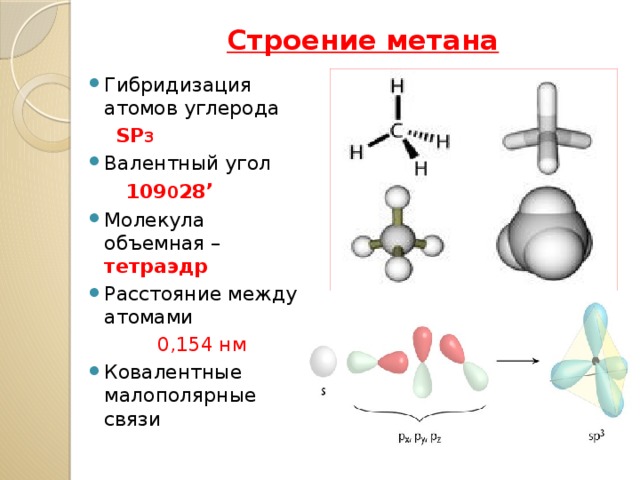
Строение метана
- Гибридизация атомов углерода
SP 3
109 0 28 ’
- Молекула объемная – тетраэдр
- Расстояние между атомами
0,154 нм
- Ковалентные малополярные связи

Формулы и названия углеводородов (С1 – С6) и соответствующих им радикалов
Алкил
Алкан
- СН3 – метил
- С2Н5 – этил
- С3Н8 – пропил
- С4Н10 – бутил
- С5Н12 – пентил
- С6Н14 – гексил
- СН4 – метан
- С2Н6 – этан
- С3Н8 – пропан
- С4Н10 – бутан
- С5Н12 – пентан
- С6Н14 – гексан
С n H 2n+2
С n H 2n+1
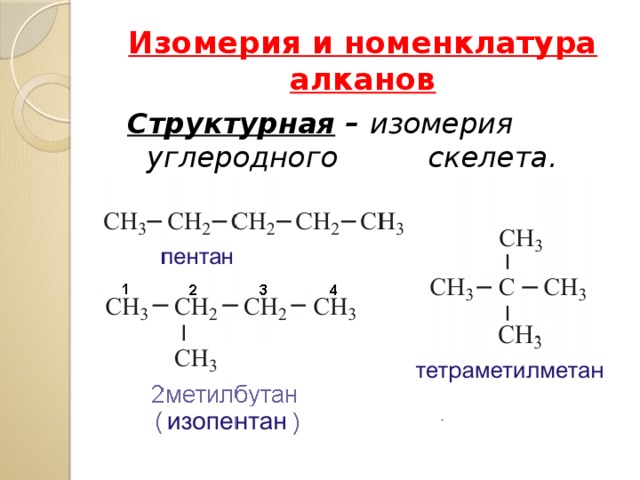
Изомерия и номенклатура алканов
Структурная – изомерия углеродного скелета.

Составление названия алканов

Получение алканов
В промышленности
источниками алканов являются нефть,
природный газ, каменный уголь.

Получение алканов
основные способы получения алканов
1) Реакция Вюрца – действие натрия на галогенпроизводные алканов
2СН3-I + 2 Na → СН3-СН3 + 2 Na I
2) Каталитическое гидрирование алкенов . (Катализаторы – Ni, Pt, Pd)
CH2=CH2 + H2 → СН3-СН3
3)Cплавление солей карбоновых кислот с гидроксидом натрия.
СН3СООNa + NaOH → CH4 ↑ + Na2CO3

Физические свойства алканов
- (С1 – С4) – газы без цвета и запаха, нерастворимые в воде,
- (С5 – С15) – жидкости (при 20 С) с запахом бензина,
- (С16 и выше) – твердые вещества белого цвета, жирные на ощупь.
- С увеличением молекулярной массы алканов увеличивается температура кипения, плавления и плотность.

Химические свойства алканов
Так как все связи насыщенные, для алканов характерны реакции:
1) Замещения: СН4 + Сl 2 → CH3Cl + HCl (на свету)
СН3-СН3 + НNO3 → СН3-СН2-NO2 + Н2О
2) Разложения (крекинг):
С10Н22 → С5Н12 + С5Н10
3) Дегидрирования (пиролиз):
2 СН4 → С2Н2 + 3 Н2 ( t = 1500 “С)
СН4 → С + 2 Н2 ( t = 1000 “С)
C2H6 → C2H4 +H2 ( t = 500 “С, p, Pt)
4) Горения:
2 C2H6 + 5О2 → 4СО2 + 6 Н2О

Химические свойства алканов
2 СН4 + О2 → 2 СН3-ОН (метанол)
СН4 + О2 → НСНО + Н2О ( метаналь)
2 СН3-СН2-СН2-СН3 + 5О2 → 4 СН3СООН + 2 Н2О
н-бутан уксусная кислота
СН3-СН2-СН2-СН3 → СН3-СН2-СН3 (кат- АlCl3)
│
СН3
2-метилпропан

Применение алканов
1 – катриджи;
2 – резина;
3 – типографская краска)
- 4-7 – производство органических веществ
4 – растворителей;
5 – хладогентов (фреонов);
6 – метанол;
7 – ацетилен.

Список используемой литературы
- О.С. Габриелян. Химия 10 класс – М.: Дрофа, 2007 г.
- Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. Органическая химия. Основной курс. – М.: Дрофа, 2003.
- Глинка Н.Л. Общая химия/ Под ред. В.А. Рабиновича.- Л.:Химия,1986.-704с.
. Химия






































