

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до 14.05.2025
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Химиядан «әртүрлі типтегі есептерді шығару жолдары» қолданбалы курс бағдарламасы
10 сынып оқушыларын қосымша дайындау үшін, есептерді шығару біліктіліктерін дамыту үшін ыңғайлы көмекші әдістемелік құрал
Просмотр содержимого документа
«Химиядан «әртүрлі типтегі есептерді шығару жолдары» қолданбалы курс бағдарламасы»
ХИМИЯДАН «ӘРТҮРЛІ ТИПТЕГІ ЕСЕПТЕРДІ ШЫҒАРУ ЖОЛДАРЫ» ҚОЛДАНБАЛЫ КУРС БАҒДАРЛАМАСЫ
ТҮСІНІК ХАТ
Химия курсының теориялық материалын сәтті игертудің тиімді жолдарының біріне химиядағы типтік есептерді шығару дағдыларын қалыптастыру мен меңгерту жатады. Болашақта химия және биология мамандықтарына даярлайтын ЖОО-на түсем деушілерге, әртүрлі типтегі химиялық есептерді шығару әдістемесін игерудің пайдасы орасан. Тиісті мамандықтар бойынша ЖОО-на түсем деуші абитуриенттерге және студенттерге типтік есептерді көптеп шығарту қолға алынуда.
Күрделі есептерді шығаруда химияның теориялық курсын жақсы білу жеткіліксіз, егер де есеп шығару дағдылары қалыптаспаса.Өкінішке орай, мектептегі химия курсын оқытуда есептер шығаруға тиісті деңгейде сағаттар бөлінбеген.Жалпы алғанда, есептерді шығарудың өзіндік реті, шығару әдістемесі болады.Сондықтан да, қиындық деңгейлері қарапайым типтік есептерді шығаруды меңгерту арқылы, қиындық деңгейлері күрделі типтік есептерді шығару дағдыларын қалыптастыру қажет.
Мақсаты:
· химиялық ғылымның саласындағы білімдерін игеру;
· оқушылардың химия пәнінен алған теориялық білімдерін бекіту;
· оқушылардың ойлау қабілеттерін дамыту;
· тәжірибелік білімнін тәсілдерін игеру;
· оқушылардың қызығушылығын, парасаттылық және шығармашылық қабілеттерін даму;
· білім алған кезінде оқушылардың шығармашылық қатынастарын тәрбиелеу
Осы мақсаттар негізінде арнаулы курс алдында мынадай міндеттер тұр:
· ғылыми деректерден, ұғымдардан, заңдармен теориядан тұратын химия ғылымының негізін меңгеру;
· химияның ғылыми маңызын ашу арқылы оқушыларға дидактикалық көзқарас қалыптастыру;
· оқушылардың логикалық ойлау қабілетін дамытуға жасампаздық іс-әрекет экологиялық мәдениет қалыптасуына жәрдемдесу.
Оқушылардан күтілетін нәтижелер
· есеп шығаратың дағдыларын бекіту;
· шығармашылық тапсырмаларды орындау;
· құрбылармен қатынасуға, өз пікірін қорғау қабілеттерге үйрену.
Оқу процесін ұйымдастыру
Курс бойынша оқу процесті ұйымдастыруда келесі негізгі принциптер енгізілді:
Курсқа қызығушылықты арттыру;
Белсенді қатысу;
Еркіндік және диалогқа дайындық;
Өз ойына сеніммен қарау.
Әдістер:
Зерттеушілік – ізденіс;
Есептер шығару, талдау
Жұмыс түрлері:
теориялық сабақтар (дәрістер), есептер шығару.
Бағалау барасы:
Материалдың дұрыстығы, әрі сапалы баяндалу;
Ұғымдар мен заңдылықтардың толық ашылуы;
Химиялық терминдердің , формулалардың дәл қолданылуы;
Дербес жауап;
Материалдық логика;
Дәлелді баяндау және өзіндік икемділік.
Бағдарламаның мазмұндық бөлігі
| № | Мазмұны | Мерзімі | Ескерту |
| 1 | Моль тақырыбына есептер шығару | | |
| 2 | Мольдік масса | | |
| 3 | Молярлық көлем | | |
| 4 | Заттың эквивалентті массасы | | |
| 5 | Химиялық теңдеулер бойынша есептеулер әдістемесі | | |
| 6 | Химиялық типтік есептер | | |
| 7-8 | Химиялық теңдеулер бойынша еасептеулер алгоритмі (бейметалдар) | | |
| 9-10 | Электролиттік ертінділер (типтік есептер) | | |
| 11-12 | Судың иондық көбейтіндісі. Сутектік көрсеткіш | | |
| 13-14 | Электролит ертінділеріндегі алмасу реакциялары. Тұздар гидролизі | | |
| 15-16 | Тотығу дәрежесі ХЕПЖ есептері (деңгейлік есептер) | | |
| 17 | Заттар массасының сақталу заңы | | |
| 18 | Комплексті қосылыстардың иондарын анықтау | | |
| 19 | Комплексті қосылыстардың номенклатурасы | | |
| 20 | Газ күйінің заңдары | | |
| 21 | Қоспадағы газдың парциалды қысымы деп барлық газ қоспасының бірдей физикалық жағдайдағы алатын көлемінің өндіретін қысымы. | | |
| 22-23 | Химиялық реакцияның жылдамдығы. Химиялық тепе-теңдік | | |
| 24-25 | Ертінділер концентрациясын көрсету жолдары | | |
| 26-27 | Электролит ертінділері | | |
| 28-29 | Күшті электролиттер. Иондар активтілігі | | |
| 30-31 | Судың иондық көбейтіндісі. Сутектік көрсеткіш | | |
| 32 | Ерігіштік көбейтіндісі | | |
| 33 | Курс материалдарын жинақтап қорытындылау | | |
| 34 | Оқушылардың алған дағдыларын қорытындылау | | |
Қолданылатын әдебиеттер тізімі
1. Беляева И.И., Сутягина Е.И., Шелепина И.А. «Задачи и упражнения по общей и неорганической химий». Москва «Просвещение» 2002 ж.
2. КузьменкоН.Е:, Еремин В.В. «2500 задач по химии с решениями». Москва «Оникс 21 век», «Мир и образование» 2002 ж.
3. Врублевский А.И. «1000 задач по химии с цепочками превращений и контрольными тестами» Минск ООО «Юнипресс» 2003 ж.
4. Момынов Ө. «Органикалық химиядан шығарылған есептер жинағы» Шымкент, 2006 ж
5. «Химия» 8-сынып оқулығы. Н.Нұрахметов, Қ.Сарманова, К.Жексембина.
6. «Химия» есептер мен жаттығулар жинағы. Ә.Е.Темірболатова.
7. Ю.М.Лабий. «Решение задач по химии с помощью уравнений и неравенств»
8. Г.И.Штремплер, А.И.Хохлова. «Методика решения расчетных задач по химии» 8-11класс.
9. Қ. Бекишев. Химия есептері.- Алматы: РБК, 2001.
10. Қ. Бекишев. Химия олимпиада есептері.- Алматы: Рауан, 2001.
7. А.С. Егоров. Все типы расчетных задач по химии для подготовки к ЕНТ.
1 – сабақ.
Сабақтың тақырыбы: Зат мольшері, Моль, Авогадро саны, Молярлық (мольдік) масса.
Сабақтың мақсаты:
Білімділік: Зат мөлшерінің өлшем бірлігі – моль туралы, Авогадро саны жөнінде ұғым қалыптастыру. Заттың берілген өлшемі бойынша құрылымдық бөлшектердің санын анықтауға үйрену.
Дамытушылық: Молярлық масса ұғымын, заттың молярлық массасын есептеп шығару білігін қалыптастыру. Масса, зат мөлшерінің өлшем бірлігі, молярлық масса деген ұғымдарды өзара байланыстыра отырып, есеп шығаруға үйрету. Молярлық және салыстырмалы молекулалық массалар сандық мәні бойынша тең болатындығын түсіндіру.
Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Сабақтың түрі: аралас сабақ. Пән/қ байланыс: физика, биология.
Құрал жабдықтар: зат мөлшері бір моль болатын металлдармен бейметаллдар үлгілері (күкірттің, темір ұнтағының, мырыштың, )
Тірек біліммен біліктер: Зат мөлшері, заттың салыстырмалы молекулалық массасы, зат мөлшерінің өлшем бірлігі, заттың салыстырмалы молекулалық массасын есептеу.
Жаңа материалды оқыту. Мұғалім өткен сабақтан байланыстыру мақсатымен оқушыларға бірнеше сұрақ қояды:
1. Заттың құрам тұрақтылығы дегеніміз не?
2. Темір сульфидінде темір мен күкірттің тұрақты масса қатынасы қанда?
Оқушыларға ұнтақтар 4 г. күкіртте күкірттің қанша атомы болса, 7 г. темірде темірдің сонша атомы болатынын түсіндіреді. Демек, әрбір темір атомы күкірттің бір атомымен қосылысады деген тағы бір тұжырымды оқушы өз бетімен жасайды.
Бұрын алған білімін еске түсіріп, талдау нәтижесінде жасаған қорытындыларына сүйене отырып, мұғалім заттардың атомдары мен молекулаларының қажетті санын алу іс жүзіне мүмкін еместігін айтады. Сондықтан химияда «зат мөлшері» деген физикалық шама қолданылады.
Ал зат мөлшері сол заттың құрылымдық бөлшектерінің санымен анықталады, яғни атом, молекула немесе басқа бөлшектер саны. Зат мөлшерінің өлшем бірлігі – моль. Моль–берілген заттың құрылымдық бөлшектері 12г көміртегіндегі атом санына сәйкес келетін зат мөлшері. ν (ню) әрпімен белгіленеді, құрылымдық бөлшектер саны Na әрпімен белгіленеді.
Заттың керекті мөлшерін қалай өлшеп алуға болады?
Осы жерде молярлық массаны пайдаланатындығын айтып, оқушыларды сабақтың мақсатымен таныстыру. Зат мөлшерін моль арқылы өрнектеген сияқты молярлық масса зат массасын грам арқылы көрсетеді. Демек, мұғалім «Заттың молярлық массасы М зат массасының зат мөлшеріне қатынасына тең шама» деген анықтаманы айтып, оқушылардың дәптеріне жазғызады.
Молярлық масса г/мольмен, яғни граммен алынған мольмен өрнектеледі: М=m / ν Мысалы:
1) M(H2)= 2 г/моль; 2) M(O2) =32 г/моль; 3) M(H2O) =18 г/моль
Оқушылардың өздігінен шығаруына берілетін есептер:
Массасы 112г темір неше моль болады?
Массаса 132г көміртегі(IV) оксиді неше моль болады?
Массасы 272г мырыш хлориді неше моль болады?
Мөлшері 0,3 моль көміртегі(IV) оксидінің массасын есептеп шығарыңдар;
Мөлшері 0,2 моль мыс (ІІ) оксидінің массасын есептеп шығарыңдар;
Мөлшері 0,5 моль судың массасын есептеп шығарыңдар;
Оқушылардың шығарған есептерін тексеріп, қателерін түзеткеннен кейін, жаңа тақырып бойынша қорытынды жасалады.
Сабақ соңында төмендегі сұрақтар көмегімен оқушыларда жаңадан қалыптастырылған ұғымдарды бекітуге болады:
1. Заттың молярлық массасы дегеніміз не?
2. Заттың молярлық массасының өлшем бірлігі не?
3. Қай формуланың көмегімен заттың молярлық массасын, массасын, мөлшерін анықтауға болады? Зат мөлшерінің өлшем бірлігі не?
4. Зат мөлшері қалай белгіленеді?
5. a) ν (C) = 4 моль деген жазу нені білдіреді?
б) ν (H2O)=2 моль деген жазу нені білдіреді?
6. Үш молекула су қанша моль болады?
2 - сабақ
Сабақтың тақырыбы: Мольдік масса. Молекулалардың өлшемі мен массасы. Молекулалар саны. Зат мөлшері.
Сабақтың әдісі: Түсіндірмелі баяндау, сұрақ-жауап.
Сабақтың көрнекілігі: интерактивті тақта, проектор, слайд
Пәнаралық, пәнішілік байланыс: физика
Сабақ барысы.
І. Ұйымдастыру кезеңі
ІІ. Жаңа сабақты түсіндіру
IІІ. Жаңа сабақты бекіту
ІV. Қорытындылау
І Ұйымдастыру кезеңі.
а) оқушыларды түгендеу
Жаңа сабақ түсіндіру.
Молекулалардың негізгі сипаттамаларының бірі олардың өлшемі мен массасы болып табылады.
Молекулалар мен атомдардың өлшемдері өте кіші болғандыөтан оларды тек салыстыру жолымен ғана көрсетуге болады.
Молекулалар өлшемін бағалау үшін неміс физигі В Рентген мен ағылшын физигі Д Релей тәжірибе жүргізді.
Молекулалардың өлшемі өте кіші болғандықтан, олардың саны кез келген денеде өте көп болады. Мысалы 1см3 ауада қалыпты атмосфералық қысым мен 00 С температура кезінде 2,7 *1019 молекулалар болады. Массасы 1г су тамшысындағы молекулалардың жуық саны – 3,7*1022 . сонда судың бір молекуласының массасы: ![]() .
.
Макраскопиялық денелердегі молекулалар саны сияқты үлкен сандарды немесе молекула массасы сияқты өте аз сандарды тәжірибеде пайдалану ыңғайсыз. Сондықтан қолайлы болу үшін атомдардың саны мен массаларын көрсеткенде олардың салыстырмалы мәнін пайдадану қабылданған.
Халықаралық келісімге сай барлық молекулалардың массаларын көміртек атомы массасының 1/12 бөлігімен салыстырады.
Заттардың Мr салыстырмалы массасы деп берілген заттың молекуласының m0 массасының көміртек атомының m0 C массасының 1/12 бөлігіне қатынасын айтады.
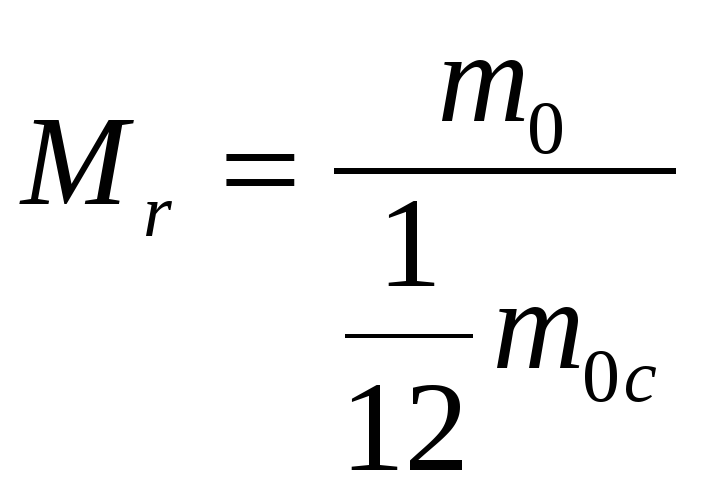
Барлық химиялық элементтердің атомдарының салыстырмалы массалары Д.И Менделеевтің периодтық кестесінде көрсетілген.
Егер зат атомдардан есем молекулалардан тұрса онда оның салыстырмалы молекулалық массасы молекуланы түзуші элементтердің салыстырмалы атомдық массаларының қосындысына тең. Мысалы, Н2 О судың салыстырмалы молекулалық массасы мынаған тең: (1*2+16=18).
Кейбір есептерді шешу үшін берілген денедегі барлық молекулалар мен атомдардың санын білу маңызды. Берілген денедегі барлық атомдар мен молекулалардың салыстырмалы саны зат мөлшері деп ататын физикалық шамамен сипатталады.
Заттың мөлшері деп берілген денедегі N молекулалар санының 12г көміртектегі NA атомдар санына қатынасын айтады:
=![]()
NA – Авагадро тұрақтысы. Оны 1811 жылы итальян физигі әрі химигі А. Авагадро анықтаған соның құрметіне осылай аталған.
NA = 6,02*1023 моль -1
Зат мөлшерінің бірлігіне 1 моль алынған.
Моль - 12г көміртекте қанша атом болса, сонша бөлшектері бар заттың мөлшері.
Салыстырмалы молекулалық массамен қатар физика мен химияда М молярлық масса ұғымы кеңінен пайдаданылады.
Молярлық масса деп 1 моль мөлшерінде алынған заттардың массасын айтады. Өлшем бірлігі 1 кг/моль.
M=m0 NA
Заттардың молярлық массасы мен оның салыстырмалы молекулалық массасы өзара байланысты. Заттардың молярлық массасының граммен өрнектелген сандық мәні осы заттардың салыстырмалы молекулалық массасына тең.
Молекуланың массасын табу үшін m0 =![]()
Зат мөлшері, зат массасы және молярлық масса арасында мынадай байланыс бар:
m=m0 N= m0 NA =M
денедегі молекула санын зат массасы мен молярлық масса арқылы табуға болады:
N=NA ![]()
Жаңа сабақты бекіту
Химиялық диктант
____________________________________ деп берілген заттың молекуласының m0 массасының көміртек атомының m0 C массасының 1/12 бөлігіне қатынасын айтады.
Берілген денедегі N молекулалар санының 12г көміртектегі NA атомдар санына қатынасын__________________________________ айтады.
_____________________________деп 1 моль мөлшерінде алынған заттардың массасын айтады.
Авагадро тұрақтысы мынаған тең: ______________________________________________
Зат мөлшері, зат массасы және молярлық масса арасындағы байланыс_______________________________________________________________________
1 моль _______________________________________________ өлшем бірлігі.
3 – сабақ.
Тақырыбы: Молярлық көлем. Авагадро заңы. Газдардың салыстырмалы тығыздығы.
Сабақтың мақсаты:
Білімділігі:Оқушыларға интерактивті тақтаны пайдалана отырып химияның негізгі заңдарының бірі Авогадро заңы, сонымен қатар газдардың молярлық көлемі және газдардың салыстырмалы тығыздығы жайлы білім беру
Дамытушылығы:Қатысушылардың формулаларды пайдаланып есеп шығару арқылы ойлау жылдамдығын және ой өрісін дамыту
Тәрбиелілігі:Берілген жаңа тақырыпты түсіндіре отырып оқушыларды қоршаған ортаға деген көзқарасын дамытып,ұжымшылдыққа тәрбиелеу
Сабақтың түрі: жаңа сабақ
Көрнекіліктер: слайд,кесте, т.б
Сабақтың барысы:
І.Ұйымдастыру кезеңі
Заттың молярлық массасы және молярлық көлемі.
Молярлық масса – заттың формулалық бірлігі молінің массасы. Ол заттың массасы мен мөлшері арқылы есептеледі: М = m / n
Молярлық масса г/мольмен өлшенеді. Кез – келген заттың бір молінде құрылымдық бірлігі бірдей саны болса, онда молярлық масса заттың салыстырмалы молекулалық (немесе атомдық) массасына пропорционал:
М = К . Мr
Мұндағы К – 1 г/ мольге тең пропорционалдық коэффициент. 126С көміртегі изотопының Аr = 12, ал атомның молярлық массасы 12 г/ мольге тең.
Демек, екі массаның сан мәні сәйкес келеді де, К=1 тең болады. Олай болса, г/мольмен берілген заттың молярлық массасы сан мәні жағынан салыстырмалы молекулалық( атомдық) массаға тең. Атомарлық сутектің молярлық массасы — 1,008 г / моль, молекулалық сутектікі – 2,016 г/ моль, оттектікі – 31,999 г /мольге тең.
Авогадро заңы бойынша қалыпты жағдайда кез – келген газдың молекулалар саны бірдей болса, олар бірдей көлем алады. Кез – келген заттың 1 молінде бөлшектер саны бірдей. Осыдан, белгілі температура мен қысымда кез – келген газ күйіндегі заттың 1 моль бірдей көлем алады. Қалыпты жағдайда, яғни 101,325 кПа атмосфералық қысымда және 273 К температурада 1 моль газ қандай көлем алатынын есептеуге болады. Мысалы, қалыпты жағдайда 1 л оттегінің массасы 1,43 г тең. Бір моль оттегінің көлемі 32 /1,43 = 22,4 л тең болады.
Демек, молярлық көлем дегеніміз заттың алатын көлемінің зат мөлшеріне қатынасын айтады. Қалыпты жағдайда кез – келген газдың молярлық көлемі 22,4 л/ мольге ( Vn = 22,414 л/мольге) тең.
ІІІ.Жаңа сабақ
Жаңа сабақты түсіндірмес бұрын сендерге бірнеше сұрақ қойғым келеді.
Ауаның құрамына қандай газдар кіреді?
Авагадро санын еске түсіре отырып,ол нещеге тең екенін айталық?
Молекула дегеніміз не?
Көптеген газдар қалыпты жағдайда газ күйінде болады.Олар ауа құрамына кіретін азот,оттек, т.б газдар.Одан басқа метан.этан сияқты көміртек пен сутектен құралған газдар да бар.Газдардың белгілі бір заңға бағынатынын физикадан білесіңдер.
Қатты заттардан газ тектес заттардың айырмашылығы – оларды сипаттау кезінде массадан гөрі көлем ұғымы жиірек пайдаланылады.Итальяндық ғалым А.Авагадро газдар құрамына кіретін жай заттардың молекуласы екі атомнан тұратынын айтты.Мысалы жай заттар сутек Н2, оттек О2 және т.б.
Қалыпты жағдайда (қ.ж.),яғни 00С температурада, 1 атмосфералық қысымда (101,325 кПа) кез келген газдың бір молі 22,4л көлем алады.Оны молярлық көлем деп атайды.
![]()
![]()
![]()
![]() л/моль
л/моль
Осы есептеулерден көрініп тұрғандай 1 моль газдың көлемі шамамен бірдей екен, оның сандық мәні 22,4 л. Мольдік көлем (Vm) t0С = 00С, р = 1 атм = 101,3 кПа жағдайында анықталған, бұл қалыпты жағдай (қ.ж.) деп аталады.
![]()
![]()
Бірдей жағдайда алынған газдардың тең көлемдерінде молекула сандары бірдей болады. Бұл - Авогадро заңы. Ол 1811 жылы ашылған.
Химияда тығыздықтан басқа салыстырмалы тығыздық деген түсінік те пайдаланылады.
Бірдей жағдайда тең көлемде алынған ғаздардың массаларының қатынасын салыстырмалы тығыздық деп атайды.
![]()
Бір газдың екінші газбен салыстырғандағы тығыздығы олардың молярлық массаларының қатынасындай болады. Салыстырмалы тығыздық сутегі мен ауа бойынша беріледі.
Сонда
![]()
![]()
М(Н2) = 2 г/моль;
М(ауа) = 29 г/моль
М{х) = 2D(H2); М(х) = 29D(aya), мұндағы х - белгісіз газдың мольдік массасы.
Қалыпты жағдайдағы газдың тығыздығы мына формуламен анықталады:
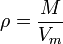
Есеп: Сутегі,оттек,ауаның қ.ж-да тығыздығын есептеңдер
IV.Сабақты бекіту
Химиялық есептеулерде масса, көлеммен қатар зат мөлшері қолданылады. Заттар молекулалардан, атомдардан немесе иондардан тұрады. Заттағы құрылымдық бөлшектердің мөлшерін моль арқылы анықтайды. Зат мөлшерінің өлшем бірлігі – моль болып табылады. Моль дегеніміз массасы 12-ге тең көміртегі атомының 0,012 кг қанша атомдар болса, құрамында сонша құрылымдық бөлшектер – молекулалар, атомдар немесе иондар болатын зат мөлшері.
Моль дегеніміз құрамындағы құрылымдық бірліктердің саны үлкен нақтылықпен анықталған: Практикалық есептеулерде оны 6,02 ∙ 1023 Авагадро саны деп атайды.
Зат мөлшерінің 1 молінің массасы граммен өрнектеледі. Зат массасының зат мөлшеріне қатынасына тең шаманы молярлық масса деп аталады. Бос күйіндегі хлордың СІ2 салыстырмалы молекулалық масса 70,90 тең. Демек, молекулалы хлордың мольдік массасы 70,90 г/моль құрайды. Бірақ, хлор атомының мольдік массасы 2 есе кіші (34,45 г/моль), себебі хлор СІ2 молекуласының 1 молі хлор атомының 2 молін құрайды.
1-мысал. СО2 бір молекуласының массасын граммен өрнектеу.
Шешуі. СО2 молекулалық массасы 44,0 тењ. Демек, СО2 мольдiк массасы 44,0 г/моль. 1 моль СО2 6,02 ∙ 1023 молекуладан құралады. Бұдан бір молекуланың массасын табамыз:
m = 44,0 / (6,02 ∙ 1023) = 7,31 / 1023 г.
Авагадро заңы: бірдей жағдайда (бірдей температура мен қысымда) әр түрлі газдардың бірдей көлемдеріндегі молекулалар саны бірдей болады.
Басқаша айтқанда, кез келген газдың 1 молі бірдей молекула санынан тұрады. Демек, бірдей жағдайда кез келген газдыњ 1 молі қалыпты жағдайда 22,4 л көлем алады. 22,4 л газдардың қалыпты жағдайдағы (0º қысым 101,325 кПа) мольдік көлем деп аталады.
2-мысал. 100ºС температурадан жоғары жабық ыдыстың ішінде сутек пен оттектің эквиваленттік қоспа мөлшерлері бар. Егер қоспа жарылып, содан кейін ыдыстың ішіндегі құрамдарды бастапқы температураға әкелсе, ыдыстың ішіндегі қысым қалай өзгереді?
Шешуі. Сутегі мен оттегін әрекеттестіргенде єр екі Н2 молекуласынан және бір О2 молекуласынан 2 молекула Н2О пайда болады. Реакция нәтижесінде молекуланың жалпы саны 1,5 есе кемиді. Реакция тұрақты көлемде жүреді, ал реакция аяқталғаннан соң ыдыстың ішіндегі заттарды бастапқы температураға алып келеді. Молекула саны 1,5 есе кемиді, сондықтан қысымның да сонша есе азаюына әкеліп соғады.
3-мысал. 5,25 г азот 26ºС мен 98,9 кПа (742 мм. сын. бағ) қысымда қанша көлем алады?
Шешуі. Азоттың мольдік көлемімен мольдік массасын (28,0 г/моль) біле тұра, 5,25 г азоттың қалыпты жағдайда алатын көлемін анықтаймыз:
28,0 г Ν2 — 22,4 л
5,25 г Ν2 — V0
бұдан
V0 = 5,25 г ∙ 22,4 л / 28,0 г = 4,20 л.
Анықталған көлемді есептің шарты бойынша табамыз:
V = P0V0T / (РТ0) = 101,3 ∙ 4,20 ∙ 299 / (98,9 ∙ 273) = 4,71 л.
4-мысал. Көлемдік құрамы (қ.ж.) 21% болатын 1 л ауада неше моль О2 бар?
Шешуі. 1 л ауада О2 қалыпты жағдайда 0,21 л көлем алады. О2 мольдік көлемін біле тұра, 0,21 л О2 оның моль санын анықтаймыз.
22,4 л. 1 моль О2 — 22,4 л
0,21 л. х моль О2 — 0,21л
х = 0,21 / 22,4 = 0,093 моль О2
Бекіту сұрақтары:
Авогадро заңы қалай тұжырымдалады?
Газдардың мольдік көлемі қалай өрнектеледі?
Салыстырмалы тығыздық деген не?
Ауаның молярлық массасы нешеге тең?
4 – сабақ
Сабақтың тақырыбы: Заттың эквивалентті массасы
Элементтің эквиваленті дегеніміз сутегі атомдарының 1 молімен әрекеттесетін немесе сондай мольді қосылыстан ығыстырып шығаратын мөлшерін айтады.
Элементтің 1 эквивалентінің массасын оның эквиваленттік массасы дейді, ал ол г/моль арқылы көрсетіледі.
1-мысал. Мына қосылыстардағы HBr, H2O және NH3 элементтерінің эквиваленттік массасын және эквивалентін анықта.
Шешуі. Берілген қосылыстардағы сутегі атомының 1 молі, бром атомының 1 молімен, оттегі атомының ½ молі, азот атомының 1/3молімен қосылады. Яғни, соған сәйкес бромның, оттегінің, азоттың эквиваленті 1 мольге, ½ және 1/3 мольге тең. Бұл берілген элемент атомдарының мольдік массасы нәтижесінде бром, оттегі, азот —эквиваленттік массалары — 79,9 г/моль, 16 ∙ ½ = 8 г/моль, 14 ∙ 3/1 = 4,67 г/мольге тең екені анықталды.
Элементтің эквивалентін немесе эквиваленттік массасын анықтағанда, оның сутегімен қосылыс түзуі міндетті емес. Қосылыстағы элементтерді талдау арқылы анықталған массалық мөлшерлері және біреуінің эквиваленті белгілі болса, екінші элементтің эквивалентін табуға болады.
2-мысал. 5,6 г темір күкіртпен қосылғанда 8,8 г темір сульфидін түзеді. Күкірттің эквиваленттік массасы 16 г/мольге тең екені белгілі болса, темірдің эквиваленттік массасын ЭFe және оның эквивалентін есепте.
Шешуі. Берілген есептің шарты бойынша, темір сульфидіндегі 5,6 г темірге 8,8 - 5,6 = 3,2 г күкірт келеді. Эквивалент заңына сәйкес, әрекеттесетін заттардың массалары олардың эквиваленттік массаларына пропорционал болады. Демек,
5,6 г Ғе эквиваленті 3,2 г S
ЭҒе г/моль — 16 г/моль
Бұдан, ЭҒе = 5,6 ∙ 16/3,2 = 28 г/моль
Темір атомының мольдік массасы, санды түрде оның салыстырмалы молекулалық массасы (28 г/моль), оның атомының мольдік массасынан 2 есе кем болғандықтан, 1 моль темірде 2 эквивалент бар. Демек, темірдің эквиваленті ½ мольге тең (1:2).
Эквиваленттер заңы негізінде күделі заттардың эквиваленттік массаларын мына формулалармен өрнектеуге болады:
Эоксид = Моксид / элемент атомының саны ∙ элемент валенттігі;
Эқышқыл = Мқышқыл / қышқыл негізділігі;
Энегіз = Мнегіз / негіз қышқылдығы;
Этұз = Мтұз / металл атомының саны ∙ металл валенттілігі;
мұндағы, М – қосылыстардың мольдік массасы.
3-мысал. Құрамында 8г NaOH бар ертіндімен күкірт қышқылын бейтараптағанда түзілген натрий гидросульфатының массасын анықта.
Шешуі. Натрий гидроксидінің эквиваленттік массасын табамыз:
ЭNaOH = MNaOH/1 = 40 г/моль. Демек, 8г NaOH 8/40 = 0,2 г/моль NaOH эквиваленттік массасын құрайды. Эквиваленттер заңына сәйкес, түзілген тұз массасы да 0,2 тең. Кейін тұздың эквиваленттік массасын анықтаймыз:
ЭNаНSО4 = MNаНSО4 / 1 = 120 г/моль. Натрий гидросульфатын түзген масса 120 ∙ 0,2 = 24 г тең.
Кейбір есептерді шығарғанда, мысалы, газ күйіндегі заттардың реакцияға түсуі, көлемді анықтау және оған есептерде міндетті түрде “эквиваленттік көлемді„ қолданған жөн.
Эквиваленттік көлем деп осы жағдайда заттың 1 эквивалентіне сәйкес келетін көлемді айтады. Мысалы, қалыпты жағдайда сутегінің 1 эквиваленті 22,4/2 = 11,2 л тең, оттегінің 1 эквиваленті 5,6 л көлем алады.
4-мысал. Эквиваленттік массасы 28 г/мольге тең, металдың біршама мөлшері қалыпты жағдайда қышқылдан 0,7 л сутегіні ығыстырып шығарады. Металдың массасын анықта.
Шешуі. Сутектің эквиваленттік көлемі 11,2 г/мольге тең екенін біле тұра, пропорция құраймыз:
28 г металл эквиваленті —11,2 л сутегі
хг — 0,7 л
х = 0,7 ∙ 28/11,2 = 1,75 г.
5 – сабақ
Тақырыбы: Химиялық теңдеулер бойынша есептеулер әдістемесі
Сабақтардың тақырыбы: Химиялық реакция теңдеулері бойынша есептеулер.
Сабақтың мақсаты:
Білімділік: Химиялық реакция типтері мен реакция теңдеулерін теңестіру ұғымдарын қалыптастыруды одан әрі жалғастыру.
Дамытушылық: Реакция теңдеулері бойынша сандық есептер шығаруды үйрену.
Тәрбиелік: ұқыптылыққа, өз еркімен жұмыс жасауға тәрбиелеу.
Тірек білім мен біліктер: Зат мөлшері, заттың салыстырмалы молекулалық массасы, зат мөлшерінің өлшем бірлігі, заттың салыстырмалы молекулалық массасын есептеу.
Сабақ барысы: Өзіндік жұмыс орындау арқылы реакция теңдеулерін теңестіруді еске түсіру, оны орындатуғатүрлі тәсілдерді ұсыну:
1-тапсырма: Төмендегі реакция теңдеулерін теңестіріңдер.
Ca + CI2 =
Na + O2 =
P + O2 =
AI + CI2 =
K + S =
Zn + O2 =
Ca + S =
AI + S =
H2 + O2 =
Жаңа сабақ: Зат массасының сақталу заңын қайталай отырып, реакция теңдеулеріне сүйеніп сан есептерін орындау заңды іске асырудың бір жолы екеніноқушылар есіне салу.
Оның практикалық мәні зор. Ең алдымен оңайырақ теңдеулерді пайдаланып, есеп шығаруды дағдыландырады. Одан әрі күрделірек есептерді беруге болады.
Оқушыларға теңдеуге сүйеніп зат мөлшерін, содан соң массасын табуға арналған есепті талдап, кітаппен жұмыс жасауды ұсынуға болады.
Есеп: 1 моль магний реакцияға түсу үшін қанша моль оттек қажет және қанша магний оксидінің зат мөлшері түзілетінін есептеңдер.
Берілгені:
Мұндағы басты мақсат реакция теңдеуіне сүйеніп, есептеулер жасау.
ν(Mg)=1моль
Т/к: ν(О2)-? 1 моль х моль у моль
ν(MgO)-? 2Mg + O2 = 2MgO
2 моль 1 моль 2 моль
Енді есепті ауызша шығаруға болады. Жауап: 1 моль магний жану үшін 0,5 моль оттек қажет болса, 1 моль MgO түзіледі. Енді оның массасын табу үшін m=Mν формуласын пайдаланып, m(O2)= 32г/моль • 0,5 моль=16г; m(MgO)= 40г/моль • 1моль = 40 г.
Есептерді екінші сабақта жалғастыру.
Химиялық реакция теңдеулерін жаза білу және ол бойынша есептер шығаруды қорытын- дылап жүйеге келтіру.
Сабақты бекіту мақсатында шығарылатын есептер:
1) 8г мыс(ІІ) оксидін алу үшін қанша грамм мыс реакцияға түседі?
2) Нәтижесінде 4 моль сутек алу үшін қанша грам суды айыруға болады?
3) Массасы 6,5г цинк оттекпен әрекеттессе цинк оксидінің қанша зат мөлшерін алуға болады?
4) 1 моль алюминий күкіртпен реакцияға түсу үшін қанша күкірт қажет және түзілген алюминий сульфидінің массасын есептеңдер?
5) Оттегінде 54г алюминий жанған кезде, алынған алюминий оксидінің массасы қандай?
6) Массасы 360г алюминий сульфидін алу үшін, оған жұмсалған алюминий мен күкірттің массасын есептеп шығар.
7) 8г мыс(ІІ) оксидінен мысты жеке бөліп алу үшін, қанша грамм сутегі жұмсалады?
8) 8г сутегі жанғанда түзілетін судың массасы және зат мөлшері қанша?
9) Реакцияға 16г оттегі түскенде судың қандай зат мөлшері шығады?
10) Реакциядан 9г су түзіледі. Реакцияға түскен оттегінің массасын және зат мөлшерін табыңдар.
6 – сабақ
Сабақтың тақырыбы: Химиялық типтік есептер
Сабақтың мақсаты:
А) Химиялық реакция типтерін түсіндіру, химиялық реакция типтерін айыра білу икемділіктерін арттыру.
Ә)Зат мөлшері, молекула саны ұғымдары туралы білімімен біліктерін дамыту.
Б)Ұқыптылыққа, шапшаңдыққа баулу.
Электрондық оқулықтан.№3,№4,№5
Тест(Электрондық оқулықтан) №1, 2,3, 4, 5 ,6, 7, 11, 12, 14, 15, 16, 17.
Эстафеталық есептер.
№1
28г көміртегі(II) оксидінде қанша зат мөлшері бар.(1 моль)
№2.
1 молькөміртегі(ІІ) оксиді мен оттегі реакцияға түсетін болса, жұмсалатын оттегінің зат мөлшерін есептеңіздер.
2СО+О2=2СО2
(0,5 моль)
№3
0,5 моль оттегідегі молекула санын анықта(3,01*1023)
Графикалық диктант
Na2SO4 заты берілген.Сұрақтарға иә жауабын белгімен,жоқ жауабын белгілейміз.
1. Бұл қоспа.
2. 3 заттан тұрады.
3. 3 элемент атомдарынан тұрады.
4. Заттың құрамына оттегінің 4 молекуласы кіреді.
5. Бұл күрделі зат.
6. Берілген затты жай заттарға тек физикалық әдіспен бөліп алуға болады.
7. Берілген затты жай заттарға тек химиялық әдіспен бөліп алуға болады.
8. Қандай әдіспен алынғанына қарамастан заттың құрамы бірдей болады.
9. Заттың құрамында 2 атом О бар.
10. Заттың құрамында 4 атом О бар.
Семантикалық карта
№ Зат М v N m
1 SO2 0,2 моль
2 H2S 3,4г
3 H2 5 моль
4 O2 3,01*1023
5
H2O 27г
6 NaCL 0.25моль
Химиялық диктант.
1.Жай заттар….. …… ….тұрады.
2.Реакцияға кіріскен зат …………..деп аталады.
3.Мольдік массаның өлшем бірлігі- …………..
4.Химиялық реакция-……….
Қазанның 16-ы
Химиялық реакция типтері.
Электрондық оқулықтан.
Тест(Электрондық оқулықтан)
Электрондық оқулықтан(Тапсырма№6, №16 зертханалық №2)
Оқулықпен жұмыс.№5,№7,№8,№9.
Жұмыс дәптері.№75,№76,№77,№78.
Қосылу реакциясы нәтижесінде бірнеше (жай немесе күрделі) заттардан бір күрделі зат түзіледі.
А+В-С
A+B+C-D
Мысалы:
Ғе + S= FeS
жай + жай = күрделі зат
СаО + Н20 = Са(ОН)2
күрделі + күрделі = күрделі зат
СаС03+С02+Н20=Са(НС03)2
күрделі заттар = күрделі зат
2SOa + 02 = 2S03
күрделі + жай = күрделі
Айырылу реакциясы нәтижесінде бір заттан екі немесе одан да көп заттар түзіледі (күрделі немесе жай).
АВ---А+В
АВС--- А+В+С
Мысалы: СаСО3^СаО + С02
бір зат = екі зат
4HN03 = 4N02+2H20+02
күрделі зат = бірнеше зат
Орын басу реакциясы жай және күрделі зат арасында жүреді, жай зат күрделі заттың құрамындағы бір элемент атомының орнын басады.
А+ВС - АС+В
Мысалы: Н2+СuО - Н20+Сu
жай зат + күрделі зат - күрделі зат + жай зат
Fe+CuS04 = FeS04+Cu
жай зат + күрделі зат = күрделі зат + жай зат
Алмасу реакциясы кезінде екі күрделі заттың кұрам бөліктері орын алмастырады:
AB+CD = AD+BC
Мысалы: CuO+2HCl = CuCl2+Н20
күрделі заттар = күрделі заттар
AgN03+NaCl = AgCl+NaNO3
күрделі заттар = күрделі заттар
7 – 8 сабақ
Сабақтардың тақырыбы: Химиялық реакция теңдеулері бойынша есептеулер.
Сабақтың мақсаты:
Білімділік: Химиялық реакция типтері мен реакция теңдеулерін теңестіру ұғымдарын қалыптастыруды одан әрі жалғастыру.
Дамытушылық: Реакция теңдеулері бойынша сандық есептер шығаруды үйрену.
Тәрбиелік: ұқыптылыққа, өз еркімен жұмыс жасауға тәрбиелеу.
Сабақтың көрнекілігі: АКТ, Д.И.Менделеев кестесі, үлестірме материалдар;
Тірек білім мен біліктер: Зат мөлшері, заттың салыстырмалы молекулалық массасы, зат мөлшерінің өлшем бірлігі, заттың салыстырмалы молекулалық массасын есептеу.
Сабақтың мазмұны.
І. Ұйымдастыру кезеңі.
ІІ. Ой шақыру.(Үй тапсырмасын тест арқылы тексеру)
Мини тест
Химиялық реакция типтері нешеге жіктеледі:
А) 2
Ә) 3
Б) 4
Бір заттың бірнеше затқа айналып ыдырауын ............ реакциясы деп атайды?
А) Қосылу Ә) Айырылыу Б) Орынбасу
CuO + 2HCI = CuCI2 + H2O берілген химиялық реакция қай типке жатады?
А) Алмасу
Ә) Айырылу
Б) Қосылу
4. СuCI2 + Zn = ZnCI2 + Cu берілген химиялық реакция қай типке жатады?
А) Қосылу Ә) Орынбасу Б) Айырылу
Атом – молекулалық ілімінің неше қағидалары бар?
А) 7 Ә) 8 Б)9
6. Екі немесе бірнеше заттың бірігіп, бір күрделі затқа айналуын ....... реакциясы деп атайд?
А) Айырылу
Ә) Қосылу
Б) Орынбасу
Химияда зат мөлшерінің (ν) өлшем бірлігі ретінде ........қабылданған?
А) грамм
Ә) килограмм
Б) моль
Атом-молекулалық ілімнің қағидасы?
А) Барлық заттар атомдар мен молекулалардан құралады
Ә) Атомдар мен молекулалар үздіксіз қозғалыста болады
Б) Барлық жауап дұрыс.
Дұрыс жауабтары.1. Б, 2. Ә, 3. А, 4. Ә, 5. А, 6. Ә, 7.Б, 8. Б;
ІІ. Өзіндік жұмыс.
Өзіндік жұмыс орындау арқылы реакция теңдеулерін теңестіруді еске түсіру, оны орындатуға түрлі тәсілдерді ұсыну:
1-тапсырма: Төмендегі реакция теңдеулерін теңестіріңдер, қай реакция типіне кіретінін анықтаңыздар?
|
|
|
| Ca + CI2 = Ca CI2 ( ) Na2 O = Na + O2 ( ) Ғе + СuCl2 = Ғе Cl2 + Cu( ) | AI + CI2 = AI CI3 ( ) K 2 S + Na = Na 2 S + K ( ) Zn O + HCl = ZnCl2 + H2 O( ) |
Дұрыс жауабы.
| Ca + CI2 = Ca CI2 (қосылу) 2Na2 O = 4Na + O2 (айырылу) Ғе + СuCl2 = Ғе Cl2 + Cu(орынбасу) | 2AI + 3 CI2 = 2 AI CI3 ( қосылу ) K 2 S + 2Na = Na 2 S + 2K ( орынбасу ) Zn O +2 HCl = ZnCl2 + H2 O( алмасу) |
ІІІ. Жаңа сабақ:
Зат массасының сақталу заңын қайталай отырып, реакция теңдеулеріне сүйеніп сан есептерін орындау заңды іске асырудың бір жолы екенін оқушылар есіне салу.
Оның практикалық мәні зор. Ең алдымен оңайырақ теңдеулерді пайдаланып, есеп шығаруды дағдыландырады. Одан әрі күрделірек есептерді беруге болады.
Оқушыларға теңдеуге сүйеніп зат мөлшерін, содан соң массасын табуға арналған есепті талдап, кітаппен жұмыс жасауды ұсынуға болады.
Химиялық реакция теңдеуі бойынша есеп шығару реті
1. Есептің шартымен мұқият танысу
2. Есеп шартын таңбалармен жазып жобасын құру ( есептің берілгенің жазу)
3. Реакция теңдеуін жазу
4. Реакцияны теңестіру
5. Есеп шартында айтылған заттардың астын сызу
6. Теңдеу бойынша есеп шығаруға қажет мәліметтерді анықтау ( есеп шартынабайланысты молекулалық масса, зат мөлшері, көлем,атом саны)
7. Теңдеудегі формула үстіне есеп шартында берілгенін, ал астына теңдеуден табылған шамаларды жазамыз
8. Пропорция құрып теңдеуді есептейміз
Есеп. № 1.
20 г кальций ауада жанғанда түзілетін кальций оксидінің СаО массасы қанша?
Берілгені: m (Са)=20 гр
Табу керек: m (СаО)-- ?
Шешуі: 1) Кальций металының ауада жанғандағы реакция теңдеуін жазып теңестіреді?
2 Ca + О2 =2 CaО
2) реакцияға қатысатын қажетті заттардың формулалары бойынша массаларын есептейді:
Мr (Са) =40 2М (Са)= 40 г*2= 80 г
Мr (СаО) =40+16=56 2М (СаО)= 56г * 2= 112 г
3) тиісті формулалардың астына берілген және іздейтін шамалар жазылады.:
2 Ca + О2 =2 CaО
80г 112г
20г х г
4) теңдеу бойынша:
80г Са оттекпен әрекеттескенде 112г СаО түзілді,
Ал 20 г Са оттекпен әрекеттескенде х г СаО түзіледі. Бұдан мынадай пропорция құруға болады.
80г :20г =112г : х г, х=20 г* 112г / 80г = 28 г CаО түзіледі. Жауабы m (СаО)=28г
Есеп. № 2.
Кальций мен оттек әрекеттескенде 56 г СаО түзіледі. Реакцияға қатынасқан оттектің массасы мен зат мөлшері қанша?
Берілгені: m (СаО)=56 гр
Табу керек: m (О2)-- ?
ν (О2) ---?
Шешуі:
2 Ca + О2 =2 CaО
32г 112г немесе 1 моль ----112г
х г 56 г 2 моль ----56г
Бұдан х=32г* 56г / 112г = 16 г (О2 ) түзіледі, және ν= m / М
ν= m / М =16 г/ 32г / моль = 0,5 моль (О2) табылады:
Жауабы: m (О2)—16г
ν (О2) ---0,5 моль
Химиялық реакция теңдеулерін жаза білу және ол бойынша есептер шығаруды қорытындылап жүйеге келтіру.
ІҮ. Тақтамен жұмыс. (10 минут)
Есептер жинағынан есеп шығару. № 1-157есеп. Бертолле тұзының 2,45 грамы айырылғанда 1,49 грамм калий хлориді түзілді: Осы кезде оттектің қанша массасы бөлінгенін табыңдар?
№ 1-157есеп. Берілгені: m (КСІО3)=2,45г
m (КСІ)=1,49 г
Табу керек: m (3О2)-- ?
Шешуі
2КСІО3 ----- 2КСІ + 3О2
2,45г 1,49г х г
245г 149г 96г
Х= 2,45*96/245=0,96 г: х = 1,49*96/ 149= 0,96 г
Ү. Деңгейлік тапсырмалар.(7 минут)
«Өзіңді бағала» (Деңгейлік тапсырмалар үш деңгейде беріледі, әр оқушы өз деңгейінің шамасына қарай тапсырма алады. І деңгей көк түсті үлестірме қағаз, ІІ деңгей жасыл түсті үлестірме қағаз, ІІІ қызыл түсті үлестірме қағаз. І деңгейге толық жауап берілсе «3» деген баға, ІІ деңгейге толық жауап берілсе «4» деген баға, ІІІ деңгейге толық жауап берілсе «5» деген баға алады.
1. деңгей. 1 Химиялық элементтердің олардың таңбаларын оларға сәйкес келетін қазақша және латынша атауларымен сәйкестілігін табу
1. Сu темір cupprum
Fe сынап ferrum
H сутек hudrogenuim
Деңгей. Мына заттардың салыстырмалы молекулалық массасын есепте?
Мr (СО)= Мr (BaО)= Мr (Al 2О 3)=
Дұрыс жауабтары: Мr (СО)=28г Мr (BaО)=153г Мr (Al 2О 3)= 102 г
3. Деңгей. Есеп. № 1.
30 г Барий ауада жанғанда түзілетін барий оксидінің ВаО массасы қанша?
Берілгені: m (Ва)=30 гр
Табу керек: m (ВаО)-- ?
Шешуі:
2 Вa + О2 = 2 ВаО
30г х гр
274г 306 г
Бұдан х=30г* 306г / 274 г = 33,50 г (ВаО) түзіледі
ҮІ. Білімді бекіту.(2 минут)
Химиялық реакция теңдеуі бойынша есеп шығару ретінің неше шарты бар?
Бірінші шартты ата?
Екінші шартты ата?
Үшінші шартты ата?
Төртінші шартты ата?
Химиялық реакция теңдеулері бойынша есептеулер.
Есептер жинағынан есеп шығару. № 1-158есеп.
Жұмыс дәптерінен № 82 есеп (1 минут)
9 - 10 сабақ
Электролит ертінділері
7.1. Әлсіз электролиттер. Диссоциациялану константасы және дәрежесі
Электролиттердің иондарға ыдырау қабілетін сандық
жағынан диссоциациялану дәрежесін анықтайды. Электролиттік диссоциациялану дәрежесі α дегеніміз иондарға ыдыраған молекулалар санының жалпы ерітілген молекулалар санына қатысы.
Ал еріткенде иондарға толық ыдырамайтын заттарды әлсіз электролиттер деп атайды. Оның ертінділерінде диссоциацияланбаған молекулалар мен оның өнімі – диссоциациялану ионы арасында тепе-теңдік орнайды. Мысалы, сірке қышқылының ертіндісіде мына тепе-теңдік орнайды:
СН3СООН ↔ Н+ + СН3СОО-
Мұның константасы сәйкес бөлшектердің концентрацияларының қатынасымен байланысты:
К = [Н+][СН3СОО-] / [СН3СООН]
АХ электролиті А+ және Х- иондарына диссоциацияланғандықтан, диссоциациалану дәрежесі мен константасы мына қатынаспен байланысты (Оствальдытың сұйылту заңы):
К = α2См / (1- α)
Мұндағы См – электролттік мольдік концентрациясы, моль/л.
Әлсіз электролиттедің диссоциациялану дәрежесі өте аз болғандықтан, 1– α ≈ 1. Сондықтан диссоциациялану константасы мынадай болады:
К = α2См, бұдан α=√К / См.
Бұл теңдеу электролит ертіндісінің концентрациясының азаюына, яғни сұйылуына байланысты оның диссоциациялану дәрежесінің артатынын көрсетеді.
Егер ертіндідегі АХ электролитінің диссоциациясы α тең болса, онда ертіндідегі А+ және Х- иондарының концентрациясы бірдей:
[А+] = [Х-] = αСм
мұнда жоғарыдағы қатынасқа α мәнін қойып, анықтаймыз:
[А+] = [Х-] = См√К/См =√КСм
Қышқылдың дисоциациясы мен байланысыт есептеулерде көбінесе К константасынын емес константасының диссоциациялану көрсеткішін қолданған қолайлы, олл мына қатынаспен анықталады:
рК = lgК
1-мысал. 0,1 М ертіндідегі сірке қышқылының диссоциациялану константасы 1,32 · 10-2 тең. Қышқылдың диссоциациялану константасы мен рК мәнін анықта.
Шешуі. Берілген есепті, сұйылту заңының теңдеуіне қойып:
К = α2См / (1 – α) = (1,32 · 10-2)2 · 0,1 / (1 – 0,0132) = 1,77 · 10-5
Бұдан рК =lg(1,77 · 10-5) = 5 lg1,77 = 5 – 0,25 = 4,75
К = α2См теңдеуіне жақын есептеу К мәніне әкеледі:
К = (1,32 · 10-2)2 · 0,1 = 1,74 · 10-5
Бұдан рК = 4,76.
2-мысал. Цианосутектің (синиль қышқылы) диссоциациялану константасы 7,9 · 10-10 тең. 0,001 М ертіндідегі НСN диссоциациялану константасын анақта.
Шешуі. НСN диссоциациялану константасы өте аз болғандықтан, есептеу үшін мына теңдеуді қолдануға болады:
α =√К/См = √7,9 ∙ 10-10 / 10-3 = 8,9 · 10-4
3-мысал. 0,1 М НОСІ хлордау қышқылы ертіндісіндегі сутек ионының концентрациясын есепте (К = 5 · 10-8).
Шешуі. НОСІ диссоциациялану дәрежесін анықтаймыз:
α = √ К/См = √ 5 ∙ 10-5 / 0,1 = 7 · 10-4
бұдан: [Н+] = α См = 7,4 ∙ 10-4 · 0,1 = 7 · 10-5
[Н+] = √ КС қатынасын пайдалана отырып, есепті басқа әдіспен де шешуге болады. Онда [Н+]= √ 5 ∙ 10-8 · 0,1 = 7 · 10-5 моль/л.
Күшті электролиттер. Иондар активтілігі
Сулы ертінділерінде толық диссоциацияға түсетін электролиттер күшті электролиттер деп аталады, оларға көптеген тұздар, сілтілік және сілтілік жер металдар гидрооксидтер, кейбір қышқылдар HCl,HBr, HІ, HСlO4, HNO3, H2SО4.
Күшті электролиттерде иондар концентрациясы көп болғандықтан, ионаралық тартылыс күші өте аз концентрацияда да байқалады. Нәтижесінде иондар еркін қозғала алмайды да толық диссоциацияға сәйкес қассиетті көрсете алмайды. Сондықтан ионның ертіндідегі жағдайын көрсету үшін, иондар концентрациясымен қатар, активтілікті, яғни шартты концентрацияны қолданады.
Ион активтілігі а (моль/л) ертіндінің молярлық концентрациясымен См байланысы келесі өрнекпен беріледі:
а = f · Cм,
а – ион активтілігі
f - активтілік коэффициенті
Активтілік коэффициенті ертінді құрамы мен концентрацияға, ионның заряды мен табиғатына тығыз байланысты.
Бірақ сұйытылған ертінділерде ион табиғаты оның активтілік коэффициентіне әлсіз әсер етеді.
Иондық күш -
ал, активтілік коэффициенті сұйытылған ертінділерде келесі формуламен есептеледі:
1-мысал. Құрамында 0,01 моль/л және 0,01 моль/л MgCl2 бар ерітіндідегі иондық күшін және активтілігін есепте.
Шешуі.
f = - 0,30
f = - 0,74
ал, активтіліктері а= f · С бойынша табылады:
11-12 сабақтар
Судың иондық көбейтіндісі. Сутектік көрсеткіш
Судың электролит ерітінділердің айырмасы, ол электр тогын өткізбейді. Дегенмен таза су аз мөлшерде өзін құрайтын иондарға диссоциацаяланадың:
Н2О Н+ + ОН- (1)
Бұл диссоциация процесіне әрекеттесуші массалар заңын қолдануға болады;
(2)
мұндағы К-судың диссоцациация тұрақтысы, оның 220 С – дағы мәні 1,8 · 10-16 шамасына тең, яғни
К = 1,8 · 10-16
Судың аз мөлшері ғана иондарға ыдырайтындықтан, теңдеудегі (2) судың концентрациясын тұрақты шама деп есептеуге болады, ол 1 л массасын судың молярлық массасына бөлгенге тең:
[H2O] = 1000/18 = 55,56 моль
Енді жоғарыдағы теңдеуді (2) былай жазуға болады:
[H+] [OH-] = K*[H2O] = KW (3)
KW –судың иондық көбейтіндісі деп аталатын тұрақты шама. Судың диссоциация тұрақтысы (К) мен оның концентрациясын Н2О мәні теңдеуге (3) қою арқылы судың иондық көбейтіндісінің сандық мәнін табамыз:
KW = [H+] [OH-] = 1,8 *10-16 * 55,56 = 10-14 яғни
KW = [H+] [OH-] =10-14
Судың иондық көбейтіндісінің мәні тұрақты температурада ғана тұрақты болады, ал температура өзгерсе оның мәніде өзгереді.
Ертіндінің қышқылдығын немесе сілтілігін анықтау үшін сутегі иондардың концентрациясы қолданылады. Бұл жағдайда нейтрал орта үшін [H+]=10-7, сілтілік орта [H+]10-7, қышқыл ортада [H+]-7 болады.
Осындай дәреже көрсеткіші теріс болып келетін сандарды қолданып есептер шығару қолайсыз болғандықтан, сутегі иондарының концентрациясын сутектік көрсеткіш (рН) арқылы белгілеу қабылданған.
Сутектік көрсеткіш деп сутек иондары концентрациясының теріс таңбамен алынған ондық логарифмін айтады:
рН = - lg[H+]
Мысалы, ерітіндідегі сутегі иондарының концентрациясы [H+]=10-6 болса, сутектік көрсеткіш 6-ға тең болады:
рН = - lg10-6 = 6
Сутектік көрсеткіштің мәніне сәйкес бұл ерітінді әлсіз қышқылдық қасиет көрсетеді. Сонымен бейтарап ортада рН=7, қышқылдық ортада рН 7 болады.
Ертіндісінің ортасын индикаторлар деп аталатын заттардың көмегімен анықтайды. Индикаторлар ерітіндіге тамызғанда немесе батырғанда сутегі немесе гидроксид иондарының әсерімен түсетін өзгерістін органикалық заттар. Мысалы, лакмус рН 5-тен төмен қарай қызыл түске, рН 8-ден жоғары қарай көк түске боялады, ал рН 5-8 аралығында оның түсі қызылдан көкке қарай өзгереді. Фенолфталеин түсін тек сілтілік ортада (рН=8,2-10), ал метилоранж түсін тек қышқылдық ортада (рН=3,1· 4,4) өзгертеді. Сілтілік ортада фенолфталеин қызыл күлгін түске, қышқылдық ортада метилоранж қызыл түске боялады.
Ерігіштік көбейтіндісі
Барий сульфатының қанық ертіндідегі қатты зат пен иондардың арасында мынадай тепе-теңдік орнайды:
ВаSО4 ↔ Ва2+ + SО42-
тұнбада ертіндіде
Электролит ертіндідегі ион күйі олардың активтілігімен анықталғандықтан, соңғы процестің тепе-теңдік константасы келесі теңдеумен өрнектеледі:
К = αВа2+ + αSО42- / αВаSО4
Келтірілген теңдеу нашар еритін электролиттің қанық ертіндісіндегі оның иондарының көбейтіндісі осы температура үшін тұрақты шама болады.
Бұл шама ерігштік көбейтінді деп аталады және оны ЕК әріптерімен белгілейді.
Бұдан Ва2+ мен SО42- иондарының активтілік көбейтіндісі мынадай:
αВа2+ + αSО42- = ЕКВаSО4
Егер электролит нашар еритін болса, онда оның қанық ертіндісінің иондық күші нөлге жақын, ал ионның активтілік коэффициенті бірден айырмашылығы аз (шамалы). Осындай жағдайларда ЕК көбейтіндідегі ион активтілік көбейтіндісін олардың концентрациясының көбейтіндісіне алмастыруға болады. ВаSО4 қанық ертіндісінің иондық күші 10-5 тең ретке ие және ВаSО4 ерігіштік көбейтіндісі келесі түрде жазылады:
ЕКВаSО4 =[Ва2+][SО42-]
Егер нашар еритін электролит ертіндісіндегі иондардың көбейтіндісі ерігіштік көбейтіндісінен артық болса, онда бұл аса қаныққан ертіндідегі иондар әрекеттесіп нашар еритін электролиттің тұнбасын түзеді. Мысалы, егер барий сульфаты ертіндіснідегі иондардың көбейтіндісі [Ва2+][SО42-] ерігштік көбейтіндісінен көп болса, онда ертіндіден белгілі мөлшерде ВаSО4 тұнбаға түседі.
1-мысал. Магний гидоксиді Мg(ОН)2 ерігіштігі 18ºС температурада 1,7 · 10-4 моль/л болса, Мg(ОН)2 магний гидроксиді ертіндісіндегі осы температурадағы ерігіштік көбейтіндісін анықта.
Шешуі. Мg(ОН)2 иондарының әр молі ерігенде Мg2+ ионының 1 молі мен екі есе көп ОН- иондарына ыдырайды. Демек, Мg(ОН)2 қанық ертіндісінде [Мg2+] = 1,7 · 10-4 моль/л; [ОН-] = 3,4 · 10-4 моль/л бұдан ЕКМg(ОН)2 = [Мg2+][ОН-]2 = 1,7 · 10-4 (3,4 · 10-4)2 = 1,96 · 10-11
2-мысал. Қорғасын иодидінің 20ºС температурадағы ерігіштік көбейтіндісі 8 · 10-9 тең. Көрсетілген температурадағы тұздың ерігіштігін (моль/л мен г/л) есепте.
Шешуі. Ізделініп отырған ерігіштікті s арқылы белгілейміз (моль/л). РbІ2 қанық ертіндісінің құрамында s моль/л Рb2+ ионы мен І- ионының 2s моль/л бар. Бұдан: ЕКРbІ2 =[Рb2+][І-]2 = s(2s)2 = 4s3
s =3√ ЕКРbІ2 / 4= 3√ 8 ∙ 10-9 /4 = 1,3 · 10-3 моль/л.
РbІ2 мольдік массасы 461 г/моль тең болғандықтан, РbІ2 ерігіштігі 1,3 · 10-3· 461 = 0,6 г/л құрайды.
13-14 сабақтар
Электролит ертінділеріндегі алмасу реакциялары. Тұздар
гидролизі
Тұздар гидролизі деп тұз иондары мен әлсіз электролит түзілуі нәтижеснде ертіндідегі сутегі және гидроксид иондары өзгеру арқылы жүретін рекцияны айтады. Тұздар гиролизінің 4 түрлі жағдайы бар, оның жағдайында олар гидролизденеді, ал төртінші жағдайда гидролизденбейді.
Күшті негіз бен күшті қышқылдан түзілген тұз:
НСІО4 + NаОН = NаСІО4 + Н2О
2НNО3 + (ОН)2 = Са(NО3)2 + 2Н2О
ионды –молекулалық теңдеумен өрнектеледі:
Н+ + ОН-= Н2О
Сонымен күшті негіз бен күшті қышқылдан түзілген тұз гидролиденбейді.
Ұқсас реакция теңдеуі:
ВаСІ2 + Н2SО4 = ВаSО4 + 2НСІ
Ва(NО3)2 + Nа2SО4 + 2NаNО3
1-мысал. Келесі заттар арасындағы теңдеуді ионды-молекулалық түрде жаз: СН3СООNа мен Н2SО4; Nа2СО3 мен НNО3; НСN мен Са(ОН)2; Рb(NО3)2 мен К2СrО4.
Шешуі. СН3СООН, НСN мен Н2О - әлсіз электролиттер, ал СО2 мен РbСrО4- суда аз еритін болғандықтантізделінген теңдеулер келесідей түрге ие болады:
СН3СОО- + Н+ = СН3СООН
СО32- + 2Н+ = СО2↑+ Н2О
НСN + ОН - = СN+ + Н2О
Рb2+ + СrО42- = РbСrО4↓
Күшті негіз бен әлсіз қышқылдан түзілген тұз:
СН3СООН + КОН = СН3СООК + Н2О
немесе
СН3СООН + ОН- = СН3СОО- + Н2О
реакцияда екі әлсіз электролит - әлсіз қышқыл (СН3СООН) мен су қатысады. Реакция аяғына дейін жүрмейді.
Әлсіз негіз бен күшті қышқылдан түзілген тұз:
Zn(ОН)2 + 2НNО3 = Zn(NО3)2 + Н2О немесе
Zn(ОН)2 + 2Н+ = Zn2+ + 2Н2О
Тұздың гидролизі: Кr=[Н+][МОН] / [М+] = КН2О / Кнегіз
тепе-теңдік әлсіз электролит, яғни су жағына қарай ығысады. әлсіз негіз бен күшті қышқылдан түзілген тұз гидролизденгенде әлсіз электролит негіздік тұз немесе әлсіз негіз түзіледі де сутегі иондарының көбеюі салдарынан ертінді қышқылдық орта (рН
Әлсіз қышқыл мен күшті негізден түзілген тұз:
КСN + Н2О ↔НСN + КОН
СN- + Н2О ↔НСN + ОН-
Тұздың гидролизі гидролиз константасымен Кr сипатталады:
Кr =[ОН-][НА] / [А-] = КН2О / Кқышқыл
Мұндағы КН2О – судың иондық көбейтіндісі.
Мұндай жағдайда тұздың анионы гидролизденеді.
Тұздар гидролизі сан жағынн оның константасы және дәрежесі арқылы сипатталады.
15-16 сабақтар
Сабақтың тақырыбы: Тотығу дәрежесі
Қосылыстағы элементтің тотығу дәрежесі деп молекула құрамындағы атомдарды шартты түрде электртерістігіне сай оң және теріс ионға айналады деп есептегендегі атомның зарядын айтады.
Элементтің қосылыстағы тотығу дәрежесін анықтау үшін мынадай жағдайларды есепке алу керек:
жай заттағы элементтің тотығу дәрежесі нөлге тең болады;
молекула құрамына кіретін барлық атомдардың тотығу дәрежелерінің алгебралық қосындысы нөлге тең;
қосылыстағы сілтілік металдардың тотығу дәрежелері (+1), негізгі топшадағы ІІ топтың металдары: мырыш пен кадмийдің тотығу дәрежелері (+2);
сутегінің бейметалдармен қосылыстарындағы тотығу дәрежесі (+1), металдармен қосылыстарында, яғни гидридтерінде (NаН, СаН2 және т.б.) (-1) тең;
оттегінің көпшілік қосылыстарындағы тотығу дәрежесі (-2), пероксидтерде (мысалы Nа2О2-) (-1) және оттегі фторидіндегі ОҒ2 тотығу дәрежесі (+2) тең.
Жоғарыда айтылғаннан, мысалы үшін мына қосылыстардағы: NН3, N2Н4, NН2ОН, N2О, NО, НNО2, NО2 және НNО3 азоттың тотығу дәрежесі, соған сәйкес –3, -2, -1, +1, +2, +3, +4, +5 екенін анықтау оңай.
Атомдардың немесе иондардың тотығу дәрежелері өзгеру арқылы жүретін реакцияларды тотығу-тотықсыздану реакциялары деп атайды.
Электрондарды беріп жіберу нәтижесінде атомның немесе ионның тотығу дәрежесін арттыру процесі – тотығу, ал электрондар қосып алу нәтижесінде атомның немесе ионның тотығу дәрежесінің төмендеу процесі - тотықсыдану деп аталады.
Атомдары немесе иондары электрондар беретін заттарды тотықсыздандырғыштар деп, ал атомдары немесе иондары электрондар қосып алатын заттарды тотықтырғыштар деп атайды. Мына реакцияда
2АІ + 3О2 = 2АІ2О3
алюминий тотығу дәрежесін 0-ден +3-ке дейін жоғарылатып, тотықсыздандырғыш қызметін атқарады. Бұл реакциядағы оттегі тотығу дәрежесін 0-ден -2-ге дейін төмендетіп тотықтырғыш қызметін атқарады. Қарастрылған реакцияда екі зат әрекеттеседі; оның біреуі – тотықтырғыш (оттегі), ал екіншісі – тотықсыздандарғыш (алюминий) қызметін атқарады. Бұл реакция молекулааралық тотығу-тотықсыздану реакцияларына жатады.
4Н3РО3 = 3Н3РО4 + РН3
реакциясы диспропорциялық тотығу-тотықсыздану реакциялары мысалына жатады. Бұнда тотығу дәрежелері бірдей бір элементтің атомдары әрі тотықсыздандырғыш, әрі тотықтырғыш рөлін атқарады. Соңғы реакциядағы фосфорлы қышқыл Н3РО3 (фосфордфң тотығу дәрежесі +3) тотықтырғыштың да рөлін, -3 тотығу дәрежесіне дейін тотықсызданып (РН3), тотықсыздандырғыштың да рөлін атқарады. Сонымен қатар фосфор +5 (Н3РО4) тотығу дәрежесіне шейін тотығады. Диспропорциялық тотығу-тотықсыздану реакциялары бір элементтің тотығу дәрежесі әрі жоғарылау, әрі төмендеу арқылы жүреді.
(NН4)2Сr2О7 = N2 + Сr2О3 + 4Н2О
реакциясында хром тотығу дәрежесін +6-дан +3 шейін төмендетіп, тотықсызданады, ал азот тотығу дәрежесін –3-тен 0 шейін жоғарылатып тотығады.
Бұл екі элемент те бастапқы қосылыстың құрамына кіреді. Мұндай реакция типін молекулаішілік тотығу-тотықсыздану реакциялары деп атайды. Бұл реакцияларға көбінесе, бір қосылыстағы тотығу дәрежелері әр түрлі бір элементтің атомдарының арасында электрон беру-алу арқылы жүретін реакциялар жатады.
17 – сабақ
Сабақтың тақырыбы: Зат массасының сақталу заңы.
Сабақтың мақсаты: Білімділік: Оқушыларды зат массасының сақталу заңының мәнін ұғып, қарапайым мысалдар арқылы ойларын дамыту. Тәрбиелік: Өз еркімен жұмыс жасауға, ойын жеткізе білуге тәрбиелеу.
Құрал – жабдықтар. Темір, күкірт, мыс ұнтақтары, спиртшам, сынауықтар, тұрғы, зертханалық таразы.
Тірек, білім мен біліктер: Құрам тұрақтылық заңы, зат массасы, қоспалар, химиялық қосылыстар, химиялық реакция заттың салыстырмалы молекулалық массасын, зат массасын есептеу, химиялық қосылыстардың формуласын құрастыра білу.
Сабақ барысы: Зат массасының сақталу заңын дұрыс түсініп, игеруін қамтамасыз ету мақсатымен оқушыларды жаңа ұғымды қабылдауға дайындау. Ол үшін оқушыларға көп сұрақтар қойылады.
Қоспа мен химиялық қосылыстың айырмашылығы неде?
Заттың химиялық формуласының маңызы мен қажеттігі неде?
Сұрақтарға жауап беру барысында оқушылардың өзара пікір алысуына көмектесе отырып, жаңа материалды қабылдауға қажетті ұғымдарды естеріне түсіру.
а) Алыну әдісіне қарамастан химиялық қосылыстардың құрамы тұрақты;
ә) Химиялық реакция кезінде атомдар сақталады.
б) Реакция нәтижесінде түзілетін өнімдер бастапқы алынған зат құрамындағы атомдардан құралады деген қорытындыға келу.
Осы қорытындыларға сүйене отырып, химияның негізгі заңдарының бірі – зат массасының сақталу заңын түсіндіремін. Сабақ мақсатымен таныстырамын.
1.Реакция кезінде атомдар сақталса, реакцияға түскен барлық атомдардың массасы сақтала ма?
Осы тұста оқушыларға белгілі темір сульфидін алу реакциясын көрсетуге болады. Заттардың құрам тұрақтылық қағидасына сай 7 г темір, 4 г күкірт өлшеп алу керек. Бастапқы заттарды өлшеймін, реакция аяқталғаннан кейін түзілген өнімді өлшеймін. Сонда түзілген өнімнің массасы 11 г, ал бастапқы алған заттардың жалпы массасы да 11 г-ға тең болады. (КК) Тәжірибені талдау нәтижесінде оқушылар химиялық реакцияда түзілген өнімдердің массасы бастапқы заттардың жалпы массасына тең болады деген қорытындыға келеді.
Іс жүзінде көпшілік жағдайда бұл ой дұрыс емес сияқты болып көрінеді. Неге?
Алдын ала өлшеніп алынған темір ұнтағы не мыс ұнтағы қыздырылады. Бастапқы заттың түсінің өзгергеніне оқушылар назарын аудара отырып, химиялық реакцияның жүріп жатқанын айтамын.Түзілген өнім өлшенеді. Бастапқы және реакция нәтижесінде түзілген өнімнің массалары тең емес екеніне оқушылардың көзі жетеді. Оқушылар үшін туған бұл қарама- қайшылықты М.В.Ломоносовтың жүргізген тәжірибесін айтып, түсіндіремін. Осыдан кейін оқушыларды зат массасының сақталу заңының қазіргі анықтамасымен таныстырып, дәптерлеріне жазғызамын.
Енді зат массасының сақталу заңының маңызына тоқталайық .
Біріншіден, бұл заң табиғатта заттардың жоқтан пайда болмайтынын немесе мүлдем жойылмайтындығын, яғни материяның мәңгі екендігін дәлелдейді. Осы арқылы оқушыларда материалистік көзқарас қалыптасады, дүние танымдары кеңейеді.
Екіншіден, бұл заң химиялық реакцияның мәнін ашады, яғни бастапқы заттардың құрамындағы атомдар реакция нәтижесінде түзілетін заттардың құрамына кіреді. Бастапқы заттардың атомдары өзара қайта топтасып, жаңадан байланысуының нәтижесінде жаңа заттар түзіледі.
Үшіншіден, бұл заң химиялық реакция теңдеуін жазуға, сол теңдеу көмегімен есептеу лер жүргізуге мүмкіндік туғызды. Демек ,бастапқы заттардың біреуінің массасы белгілі болса реакцияға түскен басқа заттардың не түзілген заттардың массасын есептеп шығаруға болады.
Мысалы: 12г күкіртті темір ұнтағымен қыздыру нәтижесінде 33г темір сульфиді түзілді.Қанша грамм темір реакцияға қатысты?
Берілгені: m(FeS) = 33г Шешуі: 33г – 12г = 21г Жауабы: m(Fe) = 21г
m(S) = 12г
Т/к: m(Fe) = ?
Массасы 24г мыс сульфиді түзілу үшін 16г мыс алынған. Ал күкірттің неше грамы керек?
Массасы 56г магний сульфидін алу үшін 32г күкірт жұмсалды. Ал магнийдің қанша грамы жұмсалады?
Сабақ соңында оқушыларға қойылатын бекіту сұрақтары:
Зат массасының сақталу заңын ашқан кім?
Зат массасының сақталу заңының анықтамасын айт.
Реакция нәтижесінде зат массасының сақталатынынқалай дәлелдеуге болады?
18 – сабақ
Комплексті қосылыстардың иондарын анықтау
Комплесксті қосылыстар дегеніміз құрамында бір немесе бірнеше донорлы-акцепторлы байланыс болатын жоғары ретті қосылыстар.
Комплексті қосылыстардың құрылысы мен қасиеттерін Швейцария ғалымы Альфред Вернер ұсынған (1893) координациялық теория жақсы түсіндіреді. Бұл теорияның негізгі қағидалары мынадай:
Компекс қосылыстардағы басты орын кешен түзушінің үлесіне тиеді. Комлекс түзуші көбінесе оң зарядталған металл аниондары болады.
Комлекс түзушінің маңайына теріс зарядталған аниондар немесе электронейтрал молекулалар – лигандалар орналасқан.
Комплекс түзушінің маңайына орналасқан немесе координацияланған лигандалардың жалпы саны комплекс түзушінің координациялық саны деп аталады.
Комлекс түзуші мен лигандалар комлекс қосылысының ішкі сферасын түзеді.
Ішкі сфераға сыймай қалған иондар комплекс қосылысысның сыртқы сферасын түзеді.
Комплекс қосылыстарының формулаларын жазғанда ішкі сфера квадрот
жақшаға алынып, сыртқы сферадан бөлінеді.
Негізгі комплекс түзушілерге Д.И. Менделеев периодтық жүйеснің қосымша топшаларында орналасқан d- элементтері жатады.
Комплекс қосылыстар толықтай комплекс иондарынан және сыртқы сфераның иондарына ыдырайтындықтан, тиісті реактивтердің жәрдемімен ол иондарды оңай анықтауға болады, ал комплекс ионының құрамына кіретін иондар мен молекулаларды химиялық жолмен анықтауға болмайды, өйткені ішкі сфера ол бөлшектерге іс жүзінде ыдырамайды. Мысалы, К3[Fe(СN)6]-ге КСNS ертіндісін қосқанда қызыл түсті Ғе(СNS)3 түзілмейді, өйткені бұл ертіндіде бос Ғе3+ иондары жоқ.
1-мысал. СоСІ3 · 5NН3 комплекс тұзы ертіндісіндегі күміс нитраты оның құрамындағы хлордың 2/3 бөлігін ғана тұнбаға түсіреді. Тұз ертіндісінде бос аммиак пен кобальт иондары анықталмаған. Ертіндінің электр өткізгіштігін өлшегенде тұз үш ионға айыралытыны дәлелденді. Бұл қосылсытың координациялық құрылымы қандай? Комлекс тұзының диссоциациялану теңдеуін жаз.
Шешуі. Берілген тұз ертіндісіндегі Со3+ ионы мен бос аммиактың болмауы – бұл компенеттердің кешен (комлекс) қосылыстың ішк сферасына кіретінін білдіреді. Бұдан басқа ішкі сфераға АgNО3 күміс нитратымен тұнбаға түсірілмейтін бір хлорид –ионы кіреді. Демек, ішкі сфераның құрамы мына формулаға сәйкес келеді: [Со(NН3)5СІ]2+. Комплекстің ішкі сферасының зарядының комлексінің орнын толтыратын сыртқы сферада екі хлорид-ионы бар: [Со(NН3)5СІ]СІ2. Ертіндідегі комлексті тұздың диссоциациясы мына сызбанұсқа арқылы жүреді:
[Со(NН3)5СІ]СІ2 =[Со(NН3)5СІ]2+ + 2СІ- және ол берілген электр өткізгіштігіне сәйкес келеді.
Кешен қосылыстың сыртқы сферасында аниондар немесе катиондар болуы кешен ионының зарядына байланысты. Егер қосылыстағы кешен ионының заряды оң болса, сыртқы сферада аниондар орналасады, ал кешен ионының заряды теріс болса, сыртқы сферада катиондар орналасады.
Кешен қосылысының формуласын құрастыру үшін кешен түзушінің координациялық санын, оның зарядын, лигандалар зарядтарын, кешен ионының зарядын, сыртқысферасының зарядтарын анықтау керек.
2-мысал. Кешен түзуші хромның (ІІІ) келесі кешен иондарының зарядын есепте: а) [Сr(Н2О)5СІ]; ә) [Сr(Н2О)4СІ2] [Сr(Н2О2)(С2О4)2].
Шешуі. Хром (ІІІ) ионының заряды +3 тең, ал су молекуласының заряды нөлге, хлорид- пен оксалат иондарының зарядтары сәйкес –1 мен –2 тең болады. Берілген қосылыстардың әрқайсысына зарядтарының алгебралық қосындысы есептелінеді:
а) +3 + (-1) = +2
ә) +3 +2(-1) = +1
б) +3 +2(-2) = -1
19 - сабақ
Комплексті қосылыстардың номенклатурасы
Құрамында кешен катионы бар қосылыстың жүйелілік аттары былай: Ішкі сферада лигандалар түрінде электронейтрал молекулалар болса, олардың аттарын өзгеріссіз атайды, мысалы С6Н6 – бензол, С2Н4 – этилен, N2Н4 – гидразин. Кейбір электронейтрал молекулалардың – лигандалардың дәстүрі қалыптасқан аты бойынша атайды, мысалы Н2О – аква, NН3 – аммин, NО – нитрозил, СО – карбонил, СS – тиокарбонил. Егер лигандалардың саны бірнешеу болса, олардың саны грек тілінде көрсетеді: 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса, 7-гепта, 8-окта. Ішкі сфераға кіретін анион – лигандалардың аттарын атау үшін олардың әрқайсысының аттарына “О” жұрнағын қосып айтады, мысалы: Вr – бромо, О2—оксо, N3 – нитрито, ОН- - гидроксо, S2О3 – тиосульфато, С2О42- - оксалато т.б. Осыдан кейін кешен түзушінің атын ілік септігінде атап, түзушінің зарядын көрсетеді. Ең слоңында сыртқы сфераның анионының атына “ы” деген жалғау қосып айтады.
1-мысал. [Рt(NН3)3СІ]СІ, [Со(NН3)5Вr]SО4- тұздарын ата.
Шешуі. [Рt(NН3)3СІ]СІ – хлортриамминоплатина (ІІ) хлориді.
[Со(NН3)5Вr]SО4- - пентаамминбромокобальт (ІІІ) сульфаты.
2-мысал. Ва[Сr(NН3)2(SСN)4]2, (NН4)2[Рt(ОН)2СІ4] тұздарын ата
Шешуі. Ва[Сr(NН3)2(SСN)4]2 – барийдің диамминтетрароданхроматы (ІІІ).
(NН4)2[Рt(ОН)2СІ4] – аммонийдің дигидроксотетрахлорплатинаты (ІV)
Эквивалент. Эквивалент заңдары
Элементтің эквиваленті дегеніміз сутегі атомдарының 1 молімен әрекеттесетін немесе сондай мольді қосылыстан ығыстырып шығаратын мөлшерін айтады.
Элементтің 1 эквивалентінің массасын оның эквиваленттік массасы дейді, ал ол г/моль арқылы көрсетіледі.
1-мысал. Мына қосылыстардағы HBr, H2O және NH3 элементтерінің эквиваленттік массасын және эквивалентін анықта.
Шешуі. Берілген қосылыстардағы сутегі атомының 1 молі, бром атомының 1 молімен, оттегі атомының ½ молі, азот атомының 1/3 молімен қосылады. Яғни, соған сәйкес бромның, оттегінің, азоттың эквиваленті 1 мольге, ½ және 1/3 мольге тең. Бұл берілген элемент атомдарының мольдік массасы нәтижесінде бром, оттегі, азот —эквиваленттік массалары — 79,9 г/моль, 16 ∙ ½ = 8 г/моль, 14 ∙ 3/1 = 4,67 г/мольге тең екені анықталды.
Элементтің эквивалентін немесе эквиваленттік массасын анықтағанда, оның сутегімен қосылыс түзуі міндетті емес. Қосылыстағы элементтерді талдау арқылы анықталған массалық мөлшерлері және біреуінің эквиваленті белгілі болса, екінші элементтің эквивалентін табуға болады.
2-мысал. 5,6 г темір күкіртпен қосылғанда 8,8 г темір сульфидін түзеді. Күкірттің эквиваленттік массасы 16 г/мольге тең екені белгілі болса, темірдің эквиваленттік массасын ЭFe және оның эквивалентін есепте.
Шешуі. Берілген есептің шарты бойынша, темір сульфидіндегі 5,6 г темірге 8,8 - 5,6 = 3,2 г күкірт келеді. Эквивалент заңына сәйкес, әрекеттесетін заттардың массалары олардың эквиваленттік массаларына пропорционал болады. Демек,
5,6 г Ғе эквиваленті 3,2 г S
ЭҒе г/моль — 16 г/моль
Бұдан, ЭҒе = 5,6 ∙ 16/3,2 = 28 г/моль
Темір атомының мольдік массасы, санды түрде оның салыстырмалы молекулалық массасы (28 г/моль), оның атомының мольдік массасынан 2 есе кем болғандықтан, 1 моль темірде 2 эквивалент бар. Демек, темірдің эквиваленті ½ мольге тең (1:2).
Эквиваленттер заңы негізінде күделі заттардың эквиваленттік массаларын мына формулалармен өрнектеуге болады:
Эоксид = Моксид / элемент атомының саны ∙ элемент валенттігі;
Эқышқыл = Мқышқыл / қышқыл негізділігі;
Энегіз = Мнегіз / негіз қышқылдығы;
Этұз = Мтұз / металл атомының саны ∙ металл валенттілігі;
мұндағы, М – қосылыстардың мольдік массасы.
3-мысал. Құрамында 8г NaOH бар ертіндімен күкірт қышқылын бейтараптағанда түзілген натрий гидросульфатының массасын анықта.
Шешуі. Натрий гидроксидінің эквиваленттік массасын табамыз:
ЭNaOH = MNaOH/1 = 40 г/моль. Демек, 8г NaOH 8/40 = 0,2 г/моль NaOH эквиваленттік массасын құрайды. Эквиваленттер заңына сәйкес, түзілген тұз массасы да 0,2 тең. Кейін тұздың эквиваленттік массасын анықтаймыз:
ЭNаНSО4 = MNаНSО4 / 1 = 120 г/моль. Натрий гидросульфатын түзген масса 120 ∙ 0,2 = 24 г тең.
Кейбір есептерді шығарғанда, мысалы, газ күйіндегі заттардың реакцияға түсуі, көлемді анықтау және оған есептерде міндетті түрде “эквиваленттік көлемді„ қолданған жөн.
Эквиваленттік көлем деп осы жағдайда заттың 1 эквивалентіне сәйкес келетін көлемді айтады. Мысалы, қалыпты жағдайда сутегінің 1 эквиваленті 22,4/2 = 11,2 л тең, оттегінің 1 эквиваленті 5,6 л көлем алады.
4-мысал. Эквиваленттік массасы 28 г/мольге тең, металдың біршама мөлшері қалыпты жағдайда қышқылдан 0,7 л сутегіні ығыстырып шығарады. Металдың массасын анықта.
Шешуі. Сутектің эквиваленттік көлемі 11,2 г/мольге тең екенін біле тұра, пропорция құраймыз:
28 г металл эквиваленті —11,2 л сутегі
хг — 0,7 л
х = 0,7 ∙ 28/11,2 = 1,75 г.
20 - сабақ
Газ күйінің заңдары
Газ күйі оның температурасы, көлемі және қысымымен сипатталады. Егер газдың температурасы 0ºС, ал қалыпты жағдайдағы қысымы(101,325 кПа немесе 760 мм.сын.бағ.) тең болса, онда бұл жағдайдағы газ нормаль газ деп аталады. Осы айтылған жағдайда болатын газдың көлемін V0, ал қысымды Р0 деп белгілейді.
Бойль-Мариотт заңы бойынша тұрақты температурада газдың массасындағы көлемі оның қысымына кері пропорционал тәуелділікте болады:
Р2/Р1 = V1/V2 немесе Р/V = const.
1-мысал. 3 л көлем алатын біршама температурадағы газдың қысымы 93,3 кПа (700 мм.сын. бағ.) тең. Егер де температураны өзгертпей газдың көлемін 2,8 литрге дейін азайтса, оның қысымы қандай болады?
Шешуі. Егер қысымды Р2 деп белгілесек, онда Р2 = 93,3 = 3/2,8.
Бұдан:
Р2 = 93,3 ∙ 3/2,8 = 100 кПа (750 мм. сын. бағ.)
Гей-Люссак заңы бойынша: тұрақты қысымда осы газдың массадағы көлемі, оның абсолюттік температурасына тура пропорционал тәуелділікте болады:
V1/T1 = V2 / T2 немесе V/T = const.
2-мысал. 27ºС температурадағы газдың көлемі 600 мл. Егерде қысым тұрақты болса, онда 57ºС-де газ қандай көлем алады?
Шешуі. Ізделініп отырған көлемді V2, ал соған сәйкес температураны Т2 деп белгілейміз. Есептің шарты бойынша V1 = 600 мл, Т1 = 273 + 27 = 300К және Т2 = 273 + 57 = 330 К. Мына мәндерді Гей – Люссак заңына сәйкес қойсақ аламыз:
600/300 = V2/330, бұдан V2 = 600 ∙ 330/300 = 660 мл.
Көлемі тұрақты газдың қысымы оның абсолюттік температурасына тура пропорционал тәуелділікте: Р1/Т1 = Р2/Т2.
3-мысал. 15ºС-да баллондағы оттегінің қысымы 91,2 ∙ 102 кПа тең. Қандай температурада ол 101,33 ∙ 102 кПа жетеді?
Шешуі. Ізделініп отырған температураны Т2 деп белгілейік. Есептің шарты бойынша
Т1 = 273 + 25 = 288 К, Р1 = 91,2 ∙ 102 кПа, Р2 = 101,33 ∙ 102 кПа
Бұл мәндерді теңдеуге қойып, табамыз:
Т2 = 101,33 ∙ 102 ∙ 288/(91,2 ∙ 102) = 320 К немесе 47ºС.
Бойль – Мариотт пен Гей – Люссак заңдарын біріктіру арқылы газ көлемі, қысымы және температурасы арасындағы байланысты өрнектейтін газ күйінің теңдеуі шығады:
РV/Т = Р0V0/Т0
Мұндағы, Р менV - берілген температурадағы қысым мен көлем, Р0 мен V0 – қалыпты жағдайдағы қысым мен көлем.
4-мысал. 25ºС температурада, қысымы 99,3 кПа (745 мм. сын. бағ.), газдың біршама мөлшері 152 мл көлем алады. 0ºС мен 101,33 кПа қысымда жоғарыда берілген газдың мөлшері қанша көлем алады?
Шешуі. Соңғы көрсетілген теңдеуге мына мәндерді қойып, табамыз:
V0 = РVТ0/Р0Т = 99,3 ∙ 152 ∙ 273/(101,33 ∙ 298) = 136,5 мл.
21 – сабақ
Қоспадағы газдың парциалды қысымы деп барлық газ қоспасының бірдей физикалық жағдайдағы алатын көлемінің өндіретін қысымы.
1-мысал. 100 кПа (750 мм сын. бағ.) тең бірдей қысымда 2 л О2 мен 4 SO2 араластырылады. Араласқан қоспаның көлемі 6 л. Алынған қоспадағы газдың парциалды қысымын анықта.
Шешуі. Есептің шарты бойынша оттегінің көлемі араласқаннан кейін 6/2 = 3 есе, ал күкірт (ІV) оксидінің көлемі 6/4 = 1,5 есе артты. Газдың парциалды қысымы да сонша есе кеміді. Демек,
РО2 = 100/3 = 33,3 кПа, РSO2 = 100/1,5 = 66,7 кПа.
Пациалды қысым заңы: газ қоспасының қысымы оны құрайтын және бір-бірімен әрекеттеспейтін газдар қысымдарының қосындысына тең.
2-мысал. 3 л СО2 4 л О2 және 6 л N2 араластырылды. Соған сәйкес СО2, О2 және N2 араластырғанға дейін олардың қысымдары 96,108 және 90,6 кПа болды. Қоспаның жалпы көлемі 10 л. Қоспаның қысымын анықта.
Шешуі. Жоғарыда шығарған есепке ұқсас әр газдың үлестік қысымын анықтаймыз:
РСО2 = 96 ∙ 3/10 = 28,8 кПа
РN2 = 90,6 ∙ 6/10 = 54,4 кПа
РО2 = 108 ∙ 4/10 = 43,2 кПа
Қоспадағы жалпы газдардың қысымының қосындысы парциалды қысымға тең.
Р = 28,88 + 43,2 + 54,4 = 126,4 кПа
Егер де газ сұйықтықтың бетіне жиналса, онда есептеу алдында келесі жағдайды ескеру қажет: оның қысымы парциалды болып табылады және әр түрлі газдар қоспасының жалпы қысымына тең.
3-мысал. 20ºС температура мен 100 кПа (750 мм сын. бағ.) қысымда су бетінен жиналған 120 мл азот қалыпты жағдайда қанша көлем алады? 20ºС су буының қаныққан қысымы 2,3 кПа тең.
Шешуі. Азоттың парциалды қысымы: жалпы қысым мен су буының парциалды қысымына тең.
РN2 = Р – рН2О = 100 – 2,3 = 97,7 кПа
Ізделініп отырған көлемді V0 деп белгілеп, Бойль – Мариотт пен Гей – Люссактың біріктірілген заңын қолданып, анықтаймыз:
V0 = РVТ0/ТР0 = 97,7 ∙ 120 ∙ 273/(293 ∙ 101,3) = 108 мл.
22-23 сабақ
Химиялық реакцияның жылдамдығы. Химиялық тепе-теңдік
Химиялық реакцияның жылдамдығына әрекеттесуші заттар концентрациясы, температурасы, катализатор әсер етеді.
Тұрақты көлемде жүретін гомогенді процесте белгілі бір уақытта реакция жүретін көлемде әрекеттесетін заттардың мөлшерінің өзгеруін гомогендік реакция жылдамдығы деп атайды.
Бұл анықтаманы мына теңдеумен өрнектеуге болады: v=+∆С/ ∆t, мұндағы"оң" мәні зат концентрациясының (∆С 0) өзгеруіне жатады, ал "теріс" таңбасы (∆С
Реакцияның жылдамдығы әрекетесетін заттардың табиғатына , олардың концентрациясына, температурасына және жүйеге қатысатын катализаторға тәуелді. Химиялық реакцияның жылдамдығына әрекеттесуші заттардың концентрациясының әсері, әрекеттесуші массалар заңымен анықталады:
Тұрақты температурадағы химиялық реакцияның жылдамдығы әрекетттесуші заттардың концентрацияларының көбейтіндісіне тура пропорционал болады.
А + В2 АВ2 реакция типі үшін әрекетесуші массалар заңы келесі түрде сипатталады:
v=k[A][B2]
Бұл теңдеудегі [A] мен [B2] – реакцияға түскен заттардың концентрациялары, k – реакция жылдамдығының константасы, яғни әрекеттесетін заттардың табиғатына тәуелді болатын пропорционалдық коэффициенті.
А + 2В → АВ2 реакция типі үшін соқтығысу механизмі бойынша жүре алады:
А + В + В → АВ2
Бұл жағдайда, әрекеттесуші массалар заңына сәйкес былай жазуға болады:
v=k[A][B][B], яғни v=k[A][B]2
Бір мезгілден үш бөлшектен астам соқтығысуы екіталай. Сондықтан, реакция теңдеуіне кіретін үлкен санды бөлшектері (мысалы, 4НСІ + О2 → 2СІ2 + 2Н2О) бірнеше сатыда жүреді. Оның әрқайсысы екі бөлшектің нәтижесінде жүзеге асырылады. Мұндай жағдайда әрекеттсуші массалар заңын жеке процесс сатыларына қолданады.
Гетерогендік реакцияларда әрекеттесуші заттар әр түрлі агрегаттық күйде болғандықтан, химиялық процесс көбінесе қатты заттың бетінде жүреді.
мысал. Әрекеттесуші массалар заңының мәнін мына реакциялар үшін жаз: а) 2NO(г) + Cl2(г) à 2NOCl(г)
б) СаСО3 (қ) à СаО(қ) + СО 2 (г)
Шешуі: а) v=k [NO]2[Cl2].
б) v=k, себебі СаСО3 қатты зат, реакция нәтижесінде концентрациясы өзгермейді, яғни белгілі температурада реакция жылдамдығы тұрақты.
2-мысал. 2NO(г) + О2(г) = 2NO(г) реакциясы бойынша реакциялық ыдыстық көлемін үш есе кеміткенде, реакция жылдамдығы қалай өзгереді.
Шешуі: Көлемді өзгерткенге дейін реакция жылдамдығы v=k[NO]2[О2] тең. Ал көлемді үш есе кеміткенде әрекеттесу заттар концентрациясы үш есе өседі. Сондықтан, v/ = k (3[NO]2 ∙[3О2]) = 27 k [NO]2[О2]
Реакция жылдамдығы 27 есе өседі.
Реакция жылдамдығының температураға байланыстылығы келесі теңдеумен беріледі:
Мұндағы, vt және kt – t0C – дағы реакция жылдамдығының жылдамдығы және константасы; vt+10 және vt+10 - (t+10) 0C – дағы өлшемдер.
g - реакция жылдамдығының температуралық коэффициенті, оның мәні көптеген реакциялар үшін 2- 4 аралықта жатады ( Вант – Гофф ережесі).
3-мысал. Реакция жылдамдығының температуралық коэффициенті 2,8 тең. Температураны 200 С – дан 750 С –ға дейін жоғарлатқанда реакция жылдамдығы неше есе артады:
Шешуі. t = t1 – t2 = 75 - 20 = 55 0 С Реакция жылдамдығы 287 есе өседі.
Температураны арттырғанда химиялық реакцияның жылдамдығы артады. Реакция жылдамдығына бөлшектердің соқтығысуларының жалпы саны, әсіресе, активтену энергиясы әсер етеді. Сондықтан реакцияға қатысатын заттардың табиғаты олардың активтену энергиясы мен активтену энтропиясына байланысты болады. Температураның жоғарылауынан активті молекулалар саны тез артады, ол өз тарапынан реакция жылдамдығын жоғарылатады.
Химиялық реакция жүргенде бастапқы заттардың концентрациясы азаяды, әрекетесуші массалар заңына сәйкес бұл реакция жылдамдығын төмендетеді. Қайтымды реакцияда тура реакция мен кері реакцияның жылдамдықтары теңескен күйді химиялық тепе-теңдік дейді.
Қайтымды химиялық реакция жағдайында
А + В → С + Д
әрекеттесетін заттардың концентрациясының тура (υ→) және кері (υ←) реакция жылдамдығына тәуелділігі мына қатынаспен өрнектеледі:
υ→ k→ [А][В];
υ← k← [А][В];
химиялық тепе-теңдік күйінде
υ→ = υ← ,
яғни k→ [А][В] = k← [С]. Бұдан k→/ k← = [С][Д] / [А][В] = К
Мұндағы К – реакцияның тепе –теңдік константасы.
Тепе-теңдік константасына кіретін концентрацияны тепе-теңдік концентрациясы деп атайды. Тепе-теңдік константасы – тұрақты температурадағы реакция өніміндегі теңдік концентрацияларымен бастапқы заттар (бөлімі) арасындағы қатынасты өрнектейтін шама. Тепе-теңдік константасы ұлғайған сайын реакция “терең” жүреді, яғни өнім шығымы артады.
Химиялық реакцияның жалпы жағдайлары химиялық термодинамикада дәлелденеді:
аА + вВ + … → сС + dД + …
Реакцияның тепе-теңдік константасы келесі түрде өрнектеледі:
К =[С]с[Д]d / [А]а[В]в
Гетерогендік реакциялар үшін тепе-теңдік константасы өрнектелуі: қатты заттың бетіндегі негізгі химиялық реакцияның жылдамдығы әрекеттесетін заттардың табиғатына, қатты заттың бетінің көлеміне, температураға, газ және сұйық заттардың коцентрацияларына байланысты болады да, қатты заттың концентрациясына байланысты емес.
Тепе-теңдік константасының мәнін катализатор әсер етпейді, өйткені ол тура және кері реакциялардың активтену энергиясын бірдей төмендетеді, сондықтан тура және кері реакциялар жылдамдығын бірдей өзгертеді. Катализатор реакция жылдамдығын өзгертеді, бірақ реакция нәтижесінде түзілген заттардың құрамына кірмейді.
4-мысал. А (г) + 2В(г) = С(г) жүйесіндегі тепе-теңдік концентрация мәні [А]= 0,06 моль/л , [В] = 0,12 моль/л , [С] = 0,216 моль/л тең. Реакцияның тепе-теңдік константасы және А мен В заттарының алғашқы концентрациясын есепте. Шешуі. Берілген реакция теңдеуі бойынша тепе-теңдік константасы: тең.
Берілген мәндерді орнына қойғанда келесі мән алынады:
К = 0, 216 / 0, 06· (0, 12)2 = 2, 5
А мен В бастапқы заттардың концентрациясын анықтағанда мынаны ескеру қажет: реакция теңдеуіне сәйкес 1моль А мен 2 моль В әрекеттескенде С заты түзіледі. Есептің шарты бойынша жүйедегі әрбір литрде 0,216 моль С заты түзілген сонымен бірге 0,216 моль А мен 0,216 · 2 =0,432 моль В шығымдалған. Сонымен ізделініп отырған бастапқы концентрациялар:
[А]0 = 0,06 + 0,216 = 0,276 моль/л
[В]0 = 0,12 + 0,432 = 0,552 моль/л тең.
Реакцияның жүру бағыты өзгерген жағдайда (температура, қысым, концентрация) тура және кері реакцияның жылдамдығы бірдей өзгермейді және химиялық тепе-теңдік бұзылады. Сыртқы жағдайдың өзгеруіне байланысты химиялық тепе-теңдік бір бағытқа ығысады. Бұл бағыттың ығысуы Ле-Шателье принципіне бағынады:
Тепе-теңдік күйде тұрған жүйенің сыртқы жағдайларының бірі өзгерсе, тепе-теңдік сол өзгеріске қарсы әсер ететін процестің бағытына қарай ығысады.
Жүйенің температурасын жоғарылатса, Ле-Шателье принципі бойынша химиялық тепе-теңдік бұл өзгеріске қарсы әсер ететін бағытта, яғни температураны төмендетіп, эндотермиялық реакцияның бағытына қарай ығысады. Жүйенің қысымын төмендетсе, химиялық тепе-теңдік осы қысмды азайтатын, яғни газдардың көлемдері немесе моль сандары аз заттар түзілетін реакцияның бағытына қарай ығысады. Ле-Шателье принципі бойынша бір заттың концентрациясының көбеюі химиялық тепе-теңдікті сол заттың концентрациясын азайтатын реакцияның бағытына қарай ығысады.
5-мысал. Берілген жүйелерде тепе-теңдік қай бағытта ығысады:
а) СO(г) + Cl2(г) СOCl2(г)
б) Н2(г) + J2(г) 2HJ(г) егер тұрақты температурада газ қоспасының көлемін төмендету арқылы қысымды жоғарылатса, жүйедегі тепе-теңдік қай бағытқа ығысады?
Шешуі. а) Реакцияның тура бағытта жүруі газдардың жалпы моль санын азайтады, яғни жүйеде қысым кемиді. Демек, Ле-Шателье принципі бойынша қысымды жоғарлату тепе-теңдіктің тура реакция бағытына ығысуына әкеледі.
б) Жүйедегі реакцияға қатысқан заттардың көлемдері мен реакция нәтижесінде түзілген көлемдері өзара тең болса, қысымның өзгеруі реакцияның тепе-теңдігіне әсер етпейді. Бұл жағдайда қысымды қалай өзгертсе де химиялық тепе-теңдік бұзылмайды.
24 – 25 сабақ
Ертінділер концентрациясын көрсету жолдары
Ертінділердің маңызды сипаттамаларының біріне концентрация жатады.
Концентрация – ертіндінің немесе еріткіштің белгілі мөлшеріндегі еріген заттың мөлшері. Ертіндінің концентрациясын шамамен анықтау үшін концентрациялы және сұйылтылған деген түсініктер қолданылады. Концен-трациялы ерітіндіде еріген заттың мөлшері көп болады, ал сұйытылған ертіндіде еріген заттың мөлшері аз болады.
Ертіндінің массасы тұрақты болғанда оның концентрациясы үлеспен немесе процентпен көрсетіледі.
Массалық үлес –еріген зат массасы ертінді массасының неше үлесі екенін көрсететін сан.
Массалық процент – ертіндінің 100 массалық бірлігінде еріген заттың неше массалық бірлігі бар екенін көрсететін сан.
Массалық процент массалық үлестен 100 есе көп болады, яғни массалық үлестен массалық процентке көшу үшін массалық үлесті 100-ге көбейту керек.
Көлемі тұрақты ертіндінің концентрациясы еріген заттардың молі, эквивалент санымен көрсетіледі.
Молярлық концентрация – бір литр ертіндіде еріген заттың моль саны.
Нормальдық концентрация – бір литр ертіндіде еріген заттың эквивалент санымен өлшенеді.
Мольдік концентрация – 1 кг еріткіште еріген заттың моль саны.
1-мысал. 250г суда 50г FeSO4 · 7H2O кристалогидраты ерітілді.Ерітіндідегі кристалогидраттың және сусыз темір (II) сульфатының массалық үлесін есепте.
Шешуі. Алынған ерітінді массасы – 300 г, яғни
mерт= mН2О+ mзат
mерт= 250г + 50г = 300г
Кристалогидраттың массасы пропорция арқылы есептейеді:
300г ерітінді - 100%
50г кристалогидрат - х%
х=50г · 100% / 300г=16,7%
М(FeSO4)=152г/моль
М(FeSO4·7H2O)=278г/моль
Темір (II) сульфаты массасын келесі пропорция арқылы есептеледі:
278г / 152=5/х
х=152 · 50 / 278=27,4г
Сусыз тұздың 300г ерітіндідегі массалық үлесі келесі жолмен анықталады:
300г ерт – 100%
27,4г – х%
х=27,4г·100% / 300г=9, 1%
2-мысал. Құрамында 8% (массасы бойынша) сусыз тұзы бар ерітінді дайындау үшін қанша грамм су және мыс купоросы CuSO4·5H2O қажет. 8% мыс сульфатының тығыздығы 1,084 г/моль.
Шешуі. 1 литр ертіндінің массасы келесі формуламен анықталады:
mерт=1.084г/мл ·1000мл=1084г
Сусыз тұздың массасы келесі пропорция арқылы есептеледі:
1084г ерт – 100%
х – 8%
х = 1084г · 8% / 100%=86,7г
М(CuSO4·5H2O) = 250г/моль
М(CuSO4) = 160г/моль
250г – х
160г – 86,7г
х = 250г · 86,7г / 160г = 135,6г
Ерітінді дайындауға қажет су массасы :
mH2O =mерт – mCuSO4=1084г- 135,6г=948,4 г
3-мысал. Көлемі 100мл 15%-тік (массасы бойынша) күкірт қышқылының
(тығыздығы 1,10 г/мл) ертіндісін дайындау үшін 96%-тік (массасы бойын
ша) күкірт қышқылының (тығыздығы 1,84г/мл) қандай көлемі және судың
қанша массасы қажет.
Шешуі. 15%- тік 100 мл күкірт қышқылының ерітіндісінің массасы
mерт=ρ·v=1,10г/мл · 100мл=110г
110г ерітіндідегі күкірт қышқылының массасы:
110г – 100%
х - 15%
х=110г·15%/100%=16,5г(H2SO4)
Енді құрамында 16,5г күкірт қышқылы бар 96 %-тік ерітіндінің көлемін
анықтаймыз.Көлемі 1мл , массасы 1,84г ерітінді құрамындағы күкірт
қышқылының массасын табамыз.
1,84г ерт - 100%
х – 96%
х=1,84г·100%/96%= 1,77г(H2SO4)
1 мл ерт – 1,77г
хг ерт – 16,5г
х=9,32 мл
Ерітінді дайындауға қажетті су массасы :
MН2О=mерт- mН2SО4=110г – 16,5г =93,5г( су)
4 –мысал. 10%-тік сілті ерітіндісін дайындау үшін көлемі 200мл 30%-тік
(массасы бойынша) NaOH (ρ=1,33г/мл) ертіндісіне қанша көлем су қосу
қажет.
mерт= ρ ∙ v = 1,33г/мл ∙ 200мл = 266г
30%-тік NaOH ерітіндісіндегі еріген зат массасы :
х – 30%
266г – 100%
х= 266г∙30% / 100%= 79,8 г NaOH
Алынған ерітінді массасы :
х– 100%
79,8г – 10%
х =79,8г ∙ 100% / 10% = 798 г ерітінді
Ал су массасы :
MН2О=798г-266г =532 г
5-мысал. 15%(массасы бойынша) күкірт қышқылы (ρ =1,10г/мл) ерітіндісінің мольдік, молярлық,нормальдық концентрациясын есепте.
Шешуі Мольдік концентрацияны есептеу үшін,ең алдымен 1000г суға
сәйкес күкірт қышқылының массасын есептейміз:
85г су – 15г күкірт қышқылы
1000г су- х г
х=176,5 г
Мольдік концентрациясы :
М(H2SO4)= 98 г/моль
m=176,5г / 98г/моль= 1,80моль/ г
Нормальдық концентрациясы:
Э(H2SO4)=98г/моль / 2=49г/моль
1000мл күкірт қышқылының ерітіндісінің массасы:
mерт=1,10г/мл∙100мл=1100г
1100г – 100%
х – 15%
х=1100г∙15% / 100%= 165г
Формула бойынша:
СH=165г/ 49г/моль= 3,37Н
Пропорция бойынша :
1Н – 49г
х – 165г
х= 1Н∙165г / 49г= 3,37Н
1000мл күкірт қышқылының ерітіндісінің массасы:
mерт=1,10г/мл ∙ 1000мл=1100г
1100г – 100%
х - 15%
х = 1100г ∙ 15% / 100%= 165г
Формула бойынша :
СМ=165г / 98г/моль=1,68моль/ л
Пропорция бойынша:
1М – 98г
х– 165г
х =165г ·1М/ 98г = 1,68 М
6-мысал. Құрамында 150г су және 50г тұздан тұратын ерітіндідегі тұздың
массалық үлесін есепте.
Шешуі. 1 жолы формула бойынша:
W=mзат /mерт∙100%
mерт =mзат + mН2О= 50г+150г=200г
W=50г/200г∙100%=25%
2 жолы пропорция бойынша:
200г – 100%
50г – х%
х =50г∙100%/200г= 25%
7 – мысал. 500 мл 0,1М калий нитраты ерітіндісін дайындау үшін қанша
грамм калий нитраты керек.
Шешуі. М(KNO3) =101г/моль
Пропорция арқылы калий нитратының массасын есептейміз:
1М- 101г
0,1М – х
х =0,1М∙101г/ 1М=10,1г KNO3
Енді 500мл 0,1М ерітіндідегі еріген зат массасын келесі пропорция арқылы анықтаймыз:
1000мл – 10,1г
500мл – х
х= 500мл∙10,1г /1000мл =5,05 г KNO3
8- мысал. Көлемі 500мл 0,5Н ерітінді дайындау үшін 96%-тік(массасы бойынша) H2SO4 (ρ=1,84г/мл)ерітіндісінің қанша көлем қажет.
Шешуі. 500мл 0,5Н ерітіндідегі қышқыл массасы:
М(H2SO4)=98г/моль
Э(H2SO4) = 49 г/моль
1000мл – 49 г
500 мл – х
х =49г∙500мл /1000мл= 24,5г
1H – 24,5г(H2SO4)
0,5Н – хг
х= 0,5Н∙24,5г/1H= 12,25г H2SO4
Ерітінді массасын пропорция арқылы есептейміз:
Х – 100 %
12,25г – 96%
х =12,25г∙100%/96%= 12,8 г ерітінді
Көлемді формула арқылы анықтаймыз:
mерт=ρ∙v
v=mерт / ρ=12,8г / 1,84г/мл=7 мл
26 - 27 сабақ
Электролит ертінділері
Әлсіз электролиттер. Диссоциациялану константасы және дәрежесі
Электролиттердің иондарға ыдырау қабілетін сандық
жағынан диссоциациялану дәрежесін анықтайды. Электролиттік диссоциациялану дәрежесі α дегеніміз иондарға ыдыраған молекулалар санының жалпы ерітілген молекулалар санына қатысы.
Ал еріткенде иондарға толық ыдырамайтын заттарды әлсіз электролиттер деп атайды. Оның ертінділерінде диссоциацияланбаған молекулалар мен оның өнімі – диссоциациялану ионы арасында тепе-теңдік орнайды. Мысалы, сірке қышқылының ертіндісіде мына тепе-теңдік орнайды:
СН3СООН ↔ Н+ + СН3СОО-
Мұның константасы сәйкес бөлшектердің концентрацияларының қатынасымен байланысты:
К = [Н+][СН3СОО-] / [СН3СООН]
АХ электролиті А+ және Х- иондарына диссоциацияланғандықтан, диссоциациалану дәрежесі мен константасы мына қатынаспен байланысты (Оствальдытың сұйылту заңы):
К = α2См / (1- α)
Мұндағы См – электролттік мольдік концентрациясы, моль/л.
Әлсіз электролиттедің диссоциациялану дәрежесі өте аз болғандықтан, 1– α ≈ 1. Сондықтан диссоциациялану константасы мынадай болады:
К = α2См, бұдан α=√К / См.
Бұл теңдеу электролит ертіндісінің концентрациясының азаюына, яғни сұйылуына байланысты оның диссоциациялану дәрежесінің артатынын көрсетеді.
Егер ертіндідегі АХ электролитінің диссоциациясы α тең болса, онда ертіндідегі А+ және Х- иондарының концентрациясы бірдей:
[А+] = [Х-] = αСм
мұнда жоғарыдағы қатынасқа α мәнін қойып, анықтаймыз:
[А+] = [Х-] = См√К/См =√КСм
Қышқылдың дисоциациясы мен байланысыт есептеулерде көбінесе К константасынын емес константасының диссоциациялану көрсеткішін қолданған қолайлы, олл мына қатынаспен анықталады:
рК = lgК
1-мысал. 0,1 М ертіндідегі сірке қышқылының диссоциациялану константасы 1,32 · 10-2 тең. Қышқылдың диссоциациялану константасы мен рК мәнін анықта.
Шешуі. Берілген есепті, сұйылту заңының теңдеуіне қойып:
К = α2См / (1 – α) = (1,32 · 10-2)2 · 0,1 / (1 – 0,0132) = 1,77 · 10-5
Бұдан рК =lg(1,77 · 10-5) = 5 lg1,77 = 5 – 0,25 = 4,75
К = α2См теңдеуіне жақын есептеу К мәніне әкеледі:
К = (1,32 · 10-2)2 · 0,1 = 1,74 · 10-5
Бұдан рК = 4,76.
2-мысал. Цианосутектің (синиль қышқылы) диссоциациялану константасы 7,9 · 10-10 тең. 0,001 М ертіндідегі НСN диссоциациялану константасын анақта.
Шешуі. НСN диссоциациялану константасы өте аз болғандықтан, есептеу үшін мына теңдеуді қолдануға болады:
α =√К/См = √7,9 ∙ 10-10 / 10-3 = 8,9 · 10-4
3-мысал. 0,1 М НОСІ хлордау қышқылы ертіндісіндегі сутек ионының концентрациясын есепте (К = 5 · 10-8).
Шешуі. НОСІ диссоциациялану дәрежесін анықтаймыз:
α = √ К/См = √ 5 ∙ 10-5 / 0,1 = 7 · 10-4
бұдан: [Н+] = α См = 7,4 ∙ 10-4 · 0,1 = 7 · 10-5
[Н+] = √ КС қатынасын пайдалана отырып, есепті басқа әдіспен де шешуге болады. Онда [Н+]= √ 5 ∙ 10-8 · 0,1 = 7 · 10-5 моль/л.
28 - 29 сабақ
Күшті электролиттер. Иондар активтілігі
Сулы ертінділерінде толық диссоциацияға түсетін электролиттер күшті электролиттер деп аталады, оларға көптеген тұздар, сілтілік және сілтілік жер металдар гидрооксидтер, кейбір қышқылдар HCl,HBr, HІ, HСlO4, HNO3, H2SО4.
Күшті электролиттерде иондар концентрациясы көп болғандықтан, ионаралық тартылыс күші өте аз концентрацияда да байқалады. Нәтижесінде иондар еркін қозғала алмайды да толық диссоциацияға сәйкес қассиетті көрсете алмайды. Сондықтан ионның ертіндідегі жағдайын көрсету үшін, иондар концентрациясымен қатар, активтілікті, яғни шартты концентрацияны қолданады.
Ион активтілігі а (моль/л) ертіндінің молярлық концентрациясымен См байланысы келесі өрнекпен беріледі:
а = f · Cм,
а – ион активтілігі
f - активтілік коэффициенті
Активтілік коэффициенті ертінді құрамы мен концентрацияға, ионның заряды мен табиғатына тығыз байланысты.
Бірақ сұйытылған ертінділерде ион табиғаты оның активтілік коэффициентіне әлсіз әсер етеді.
Иондық күш -
ал, активтілік коэффициенті сұйытылған ертінділерде келесі формуламен есептеледі:
1-мысал. Құрамында 0,01 моль/л және 0,01 моль/л MgCl2 бар ерітіндідегі иондық күшін және активтілігін есепте.
Шешуі.
f = - 0,3 f = - 0,74
ал, активтіліктері а= f · С бойынша табылады.
30 – 31 сабақ
Судың иондық көбейтіндісі. Сутектік көрсеткіш
Судың электролит ерітінділердің айырмасы, ол электр тогын өткізбейді. Дегенмен таза су аз мөлшерде өзін құрайтын иондарға диссоциацаяланадың:
Н2О Н+ + ОН- (1)
Бұл диссоциация процесіне әрекеттесуші массалар заңын қолдануға болад (2)
мұндағы К-судың диссоцациация тұрақтысы, оның 220 С – дағы мәні 1,8 · 10-16 шамасына тең, яғни
К = 1,8 · 10-16
Судың аз мөлшері ғана иондарға ыдырайтындықтан, теңдеудегі (2) судың концентрациясын тұрақты шама деп есептеуге болады, ол 1 л массасын судың молярлық массасына бөлгенге тең:
[H2O] = 1000/18 = 55,56 моль
Енді жоғарыдағы теңдеуді (2) былай жазуға болады:
[H+] [OH-] = K*[H2O] = KW (3)
KW –судың иондық көбейтіндісі деп аталатын тұрақты шама. Судың диссоциация тұрақтысы (К) мен оның концентрациясын Н2О мәні теңдеуге (3) қою арқылы судың иондық көбейтіндісінің сандық мәнін табамыз:
KW = [H+] [OH-] = 1,8 *10-16 * 55,56 = 10-14 яғни
KW = [H+] [OH-] =10-14
Судың иондық көбейтіндісінің мәні тұрақты температурада ғана тұрақты болады, ал температура өзгерсе оның мәніде өзгереді.
Ертіндінің қышқылдығын немесе сілтілігін анықтау үшін сутегі иондардың концентрациясы қолданылады. Бұл жағдайда нейтрал орта үшін [H+]=10-7, сілтілік орта [H+]10-7, қышқыл ортада [H+]-7 болады.
Осындай дәреже көрсеткіші теріс болып келетін сандарды қолданып есептер шығару қолайсыз болғандықтан, сутегі иондарының концентрациясын сутектік көрсеткіш (рН) арқылы белгілеу қабылданған.
Сутектік көрсеткіш деп сутек иондары концентрациясының теріс таңбамен алынған ондық логарифмін айтады:
рН = - lg[H+]
Мысалы, ерітіндідегі сутегі иондарының концентрациясы [H+]=10-6 болса, сутектік көрсеткіш 6-ға тең болады:
рН = - lg10-6 = 6
Сутектік көрсеткіштің мәніне сәйкес бұл ерітінді әлсіз қышқылдық қасиет көрсетеді. Сонымен бейтарап ортада рН=7, қышқылдық ортада рН 7 болады.
Ертіндісінің ортасын индикаторлар деп аталатын заттардың көмегімен анықтайды. Индикаторлар ерітіндіге тамызғанда немесе батырғанда сутегі немесе гидроксид иондарының әсерімен түсетін өзгерістін органикалық заттар. Мысалы, лакмус рН 5-тен төмен қарай қызыл түске, рН 8-ден жоғары қарай көк түске боялады, ал рН 5-8 аралығында оның түсі қызылдан көкке қарай өзгереді. Фенолфталеин түсін тек сілтілік ортада (рН=8,2-10), ал метилоранж түсін тек қышқылдық ортада (рН=3,1· 4,4) өзгертеді. Сілтілік ортада фенолфталеин қызыл күлгін түске, қышқылдық ортада метилоранж қызыл түске боялады.
32 сабақ
Ерігіштік көбейтіндісі
Барий сульфатының қанық ертіндідегі қатты зат пен иондардың арасында мынадай тепе-теңдік орнайды:
ВаSО4 ↔ Ва2+ + SО42-
тұнбада ертіндіде
Электролит ертіндідегі ион күйі олардың активтілігімен анықталғандықтан, соңғы процестің тепе-теңдік константасы келесі теңдеумен өрнектеледі:
К = αВа2+ + αSО42- / αВаSО4
Келтірілген теңдеу нашар еритін электролиттің қанық ертіндісіндегі оның иондарының көбейтіндісі осы температура үшін тұрақты шама болады.
Бұл шама ерігштік көбейтінді деп аталады және оны ЕК әріптерімен белгілейді.
Бұдан Ва2+ мен SО42- иондарының активтілік көбейтіндісі мынадай:
αВа2+ + αSО42- = ЕКВаSО4
Егер электролит нашар еритін болса, онда оның қанық ертіндісінің иондық күші нөлге жақын, ал ионның активтілік коэффициенті бірден айырмашылығы аз (шамалы). Осындай жағдайларда ЕК көбейтіндідегі ион активтілік көбейтіндісін олардың концентрациясының көбейтіндісіне алмастыруға болады. ВаSО4 қанық ертіндісінің иондық күші 10-5 тең ретке ие және ВаSО4 ерігіштік көбейтіндісі келесі түрде жазылады:
ЕКВаSО4 =[Ва2+][SО42-]
Егер нашар еритін электролит ертіндісіндегі иондардың көбейтіндісі ерігіштік көбейтіндісінен артық болса, онда бұл аса қаныққан ертіндідегі иондар әрекеттесіп нашар еритін электролиттің тұнбасын түзеді. Мысалы, егер барий сульфаты ертіндіснідегі иондардың көбейтіндісі [Ва2+][SО42-] ерігштік көбейтіндісінен көп болса, онда ертіндіден белгілі мөлшерде ВаSО4 тұнбаға түседі.
1-мысал. Магний гидоксиді Мg(ОН)2 ерігіштігі 18ºС температурада 1,7 · 10-4 моль/л болса, Мg(ОН)2 магний гидроксиді ертіндісіндегі осы температурадағы ерігіштік көбейтіндісін анықта.
Шешуі. Мg(ОН)2 иондарының әр молі ерігенде Мg2+ ионының 1 молі мен екі есе көп ОН- иондарына ыдырайды. Демек, Мg(ОН)2 қанық ертіндісінде [Мg2+] = 1,7 · 10-4 моль/л; [ОН-] = 3,4 · 10-4 моль/л бұдан ЕКМg(ОН)2 = [Мg2+][ОН-]2 = 1,7 · 10-4 (3,4 · 10-4)2 = 1,96 · 10-11
2-мысал. Қорғасын иодидінің 20ºС температурадағы ерігіштік көбейтіндісі 8 · 10-9 тең. Көрсетілген температурадағы тұздың ерігіштігін (моль/л мен г/л) есепте.
Шешуі. Ізделініп отырған ерігіштікті s арқылы белгілейміз (моль/л). РbІ2 қанық ертіндісінің құрамында s моль/л Рb2+ ионы мен І- ионының 2s моль/л бар. Бұдан: ЕКРbІ2 =[Рb2+][І-]2 = s(2s)2 = 4s3
s =3√ ЕКРbІ2 / 4= 3√ 8 ∙ 10-9 /4 = 1,3 · 10-3 моль/л.
РbІ2 мольдік массасы 461 г/моль тең болғандықтан, РbІ2 ерігіштігі 1,3 · 10-3· 461 = 0,6 г/л құрайды.
33 - сабақ
Курс материалдарын жинақтап қорытындылау
34 – сабақ
Оқушылардың алған дағдыларын қорытындылау.
Полезное для учителя






















