
«Кислород- это вещество, вокруг которого вращается вся земная химия»
Йенсу Якоб Берцелиус

Цель :
развить представление о кислороде и сере как химических элементах и простых веществах; формировать представление об аллотропии на примере кислорода и серы; развить понятие о водородных соединениях кислорода и серы.

Проблемные вопросы?
- Какие элементы кроме О2 находятся в VIA группе?
- Почему данные химические элементы находятся в данной группе?
3. Какие типы химической связи характерны для элементов VIAгруппы?

Кислород
Сера
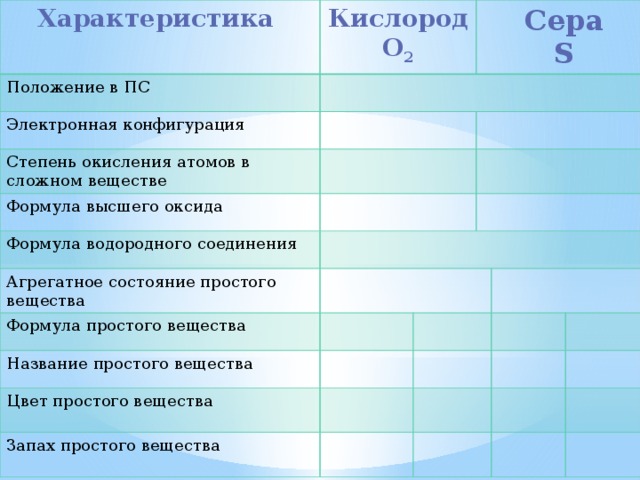
Характеристика
Кислород
Положение в ПС
О 2
Электронная конфигурация
Степень окисления атомов в сложном веществе
Сера
Формула высшего оксида
S
Формула водородного соединения
Агрегатное состояние простого вещества
Формула простого вещества
Название простого вещества
Цвет простого вещества
Запах простого вещества
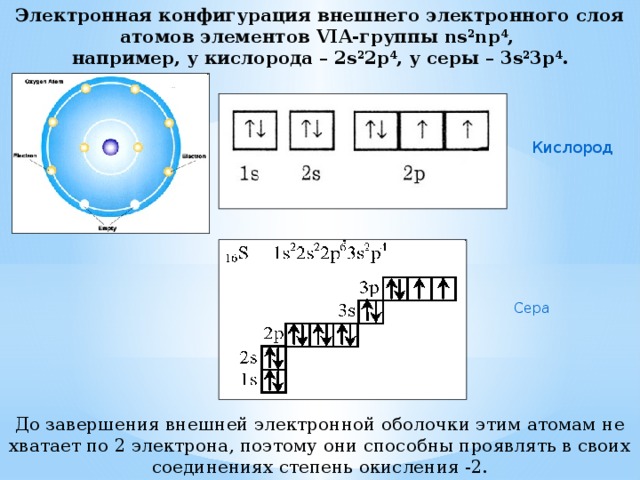
Электронная конфигурация внешнего электронного слоя атомов элементов VIA-группы ns 2 np 4 , например, у кислорода – 2s 2 2p 4 , у серы – 3s 2 3p 4 .
Кислород
Сера
До завершения внешней электронной оболочки этим атомам не хватает по 2 электрона, поэтому они способны проявлять в своих соединениях степень окисления -2.

Кислород
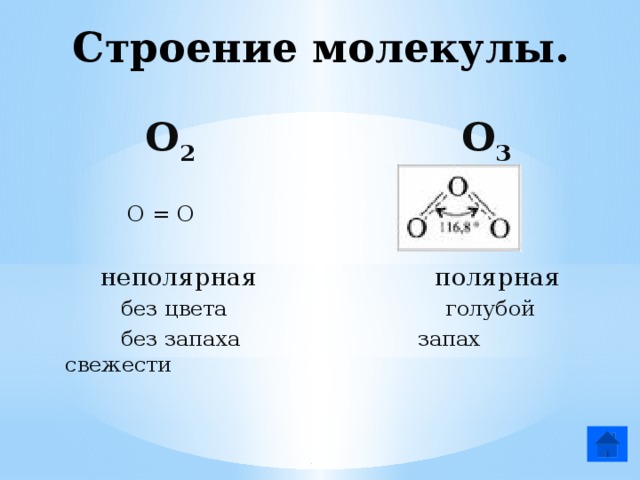
Строение молекулы.
О 2 О 3
О = О
неполярная полярная
без цвета голубой
без запаха запах свежести

Значение кислорода и озона в природе.
О 2
дыхание
(животные)
О 2
гемоглобин
Н 2 О + СО 2
хлорофилл
фотосинтез
(растения)
Равновесие всего живого в
природе.
О 3
Озоновый слой поглощает солнечные излучения, губительные для всего
живого на ЗЕМЛЕ.
О П А С Н О !!!
«озоновые дыры»
Презентация подготовлена для проведения урока « Общая характеристика неметаллов » в 9 классе по теме
« Неметаллы ». Служит для индивидуальной речи учителя.

Сера

Физические свойства.
— твердое агрегатное
состояние
— желтого цвета
— не растворима в воде
— не смачивается водой
( ФЛОТ ация)
— растворяется в
органических
растворителях

Аллотропные переходы
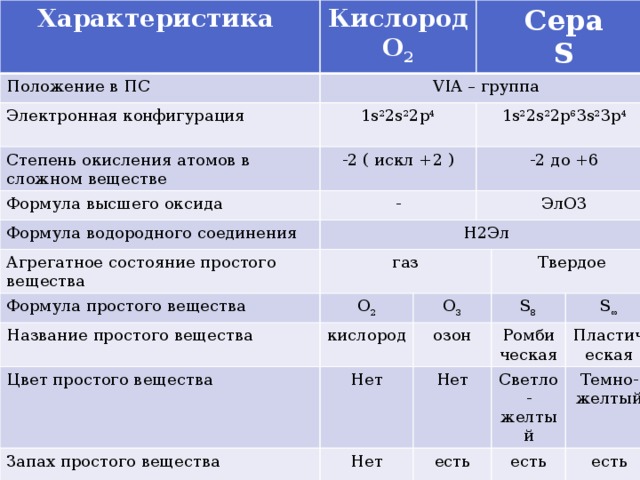
Характеристика
Положение в ПС
Кислород
О 2
VIA – группа
Электронная конфигурация
Сера
1s 2 2s 2 2p 4
Степень окисления атомов в сложном веществе
Формула высшего оксида
S
-2 ( искл +2 )
Формула водородного соединения
-
1s 2 2s 2 2p 6 3s 2 3p 4
Агрегатное состояние простого вещества
Н2Эл
-2 до +6
Формула простого вещества
газ
ЭлО3
Название простого вещества
О 2
Цвет простого вещества
О 3
кислород
Нет
озон
Запах простого вещества
Твердое
Нет
Нет
S 8
есть
Ромбическая
S ∞
Светло-желтый
Пластическая
есть
Темно-желтый
есть

Химические свойства серы и кислорода




Вывод:
- Кислород в химических реакциях выступает в роли окислителя.
2.Сера выступает как окислителем так и восстановителем, что говорит о ее окислительно-восстановительной двойственности .

Применение кислорода
Для дыхания :
- Медицинский кислород хранится в металлических газовых баллонах высокого давления. Для подачи кислорода и кислородно-воздушных смесей применяются кислородные ингаляторы различных моделей и модификаций.
- Кислород применяют и для обогащения кислородом водной среды в рыбоводстве.

- В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива.
- В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах.
- Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.

Применение серы
Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат.
Для животных

Вулкан Кава Джен , который находиться в регионе Индонезии (Восточная Ява), примерно 2,6 км высотой, имеет на вершине огромную впадину и озеро с серной кислотой (глубиной примерно 200 метров). Вулкан этот слабоактивный и своими выбросами газовых испарений во внутрь кратера, он помогает местным жителям заработать себе на жизнь. Куски которые застывают, местные шахтеры сбивают арматурой и собирают. После чего несут до пункта приема этой серы. За день делают примерно по 2-3 ходки.

Домашнее задание: Параграф §38.

«Химия в руках человека является ключом к познанию тайн природы»
И. Гете



















































