
Кислоты
Кислоты- это сложные вещества, которые состоят из кислотных остатков и водорода, способного замещаться на атом металла.
Mg + 2 H Cl = Mg Cl 2 + H 2
Магний соляная хлорид водород
кислота магния
Mg + H 2 SO 4 = Mg SO 4 + H 2
Магний серная сульфат водород
кислота магния
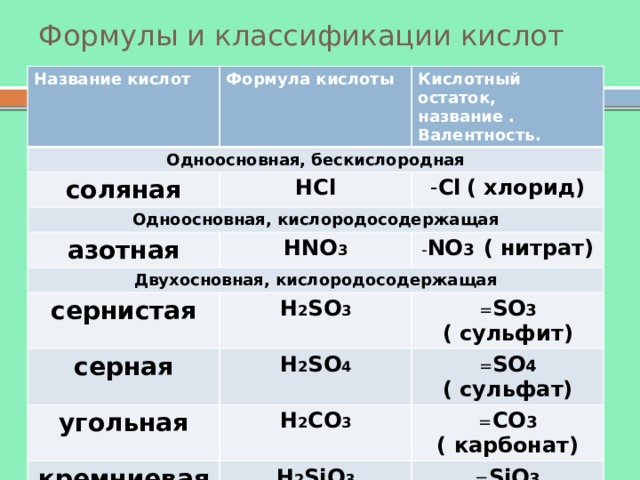
Формулы и классификации кислот
Название кислот
Формула кислоты
Одноосновная, бескислородная
Кислотный остаток, название . Валентность.
соляная
HCl
Одноосновная, кислородосодержащая
- Cl ( хлорид)
азотная
HNO 3
Двухосновная, кислородосодержащая
- NO 3 ( нитрат)
сернистая
H 2 SO 3
серная
= SO 3 ( сульфит)
H 2 SO 4
угольная
= SO 4 ( сульфат)
H 2 CO 3
кремниевая
= CO 3 ( карбонат)
H 2 SiO 3
Трехосновная, кислородосодержащая
= SiO 3 ( силикат)
ортофосфорная
H 3 PO 4
PO 4 ( фосфат)

Формулы соединений основных классов неорганической химии. Выбрать кислоты и дать им классификацию.
NaCl, MgSO 4 , H 2 S, KOH, CO 2 , H 2 SO 4 , HNO 3 ,
HBr, SO 3 ,K 2 SO 4 ,Na 2 S, H 3 PO 4 , ZnO, H 2 SO 3 ,
Сa(NO 3 ) 2 , H 2 CO 3 , AlCl 3

Проверим свои знания.
NaCl, MgSO 4 , H 2 S , KOH, CO 2 , H 2 SO 4 , HNO 3 ,
HBr , SO 3 ,K 2 SO 4 ,Na 2 S, H 3 PO 4 , ZnO, H 2 SO 3 ,
Сa(NO 3 ) 2 , H 2 CO 3 , AlCl 3
- Бескислородные: H 2 S, HBr
- Кислородосодержащие : H 2 SO 4 , HNO 3 , H 3 PO 4 , H 2 SO 3 , H 2 CO 3
- О дноосновные: HBr , HNO 3
- Двухосновные: H 2 S , H 2 SO 4 , H 2 SO 3 , H 2 CO 3
- Трехосновные: H 3 PO 4

Проверим свои знания ( устно).
- 1) Даны кислотные остатки: -F ; -ClO 4 ;= SiO 3 . Составьте формулы возможных кислот, дайте им характеристику, используя признаки классификации.
- 2) Игра «Третий лишний» В каждом ряду найдите лишнюю формулу, ответ мотивируйте: HCl; H 2 SO 4 ;H 3 PO 4 H 2 SO 3 ; H 2 SiO 3 ;H 3 PO 4

Действие индикаторов.

Химические свойства кислот. Действие индикаторов.
- Лакмус ( фиолетовый)- красный
- Метилоранжевый - красный
- Фенолфталеин- бесцветный

Николай Николаевич Бекетов.
БЕКЕТОВ Николай Николаевич (1.01.1827-30.11.1911), русский физико-химик.

Взаимодействие с металлами .

Химические свойства. Взаимодействие с металлами .
- Zn + H 2 SO 4 = ZnSO 4 + H 2
соль водород
- Cu + H 2 SO 4 = реакция не идет
самостоятельно

Химические свойства. Взаимодействие с основными оксидами.
- CaO + H 2 SO 4 = CaSO 4 + H 2 O
соль вода
Fe 2 O 3 +3H 2 SO 4 = Fe 2 (SO 4 ) 3 +3H 2 O
соль вода
Условие нагревание.
самостоятельно
- CuO + H 2 SO 4 =
- Условие нагревание.

Взаимодействие с основаниями

Химические свойства. Взаимодействие с основаниями (щелочами). Реакция нейтрализации.
NaOH + HCl = NaCl + H 2 O
соль вода
самостоятельно
KOH + H 2 SO 4 =


Химические свойства. Взаимодействие с солями.
НNO 3
H 2 SO 4 HCl H 2 SO 3 , H 2 CO 3 , H 2 S, H 2 SiO 3
H 3 PO 4
НCl + AgNO 3 = HNO 3 + AgCl
NaCl+ H 2 СO 3 = реакция не идет
самостоятельно
Na 3 PO 4 + H 2 SO 4 =
Na 3 РO 4 + H 2 СO 3 =

Проверим свои знания.
- Ca + 2 HCl = CaCl 2 + H 2
- Au + HCl = реакция не идет

Проверим свои знания.
- CuO + H 2 SO 4 = CuSO 4 + H 2 O
- Условие нагревание.

Проверим свои знания.
- 2 KOH + H 2 SO 4 = K 2 SO 4 + 2H 2 O

Проверим свои знания.
2 Na 3 PO 4 + 3 H 2 SO 4 = 3Na 2 SO 4 + 2H 3 PO 4
Na 3 РO 4 + H 2 СO 3 = реакция не идет

Методика выставления оценки.
- Три и более ошибок – оценка «2»

Стихи о кислоте
- Зубы крошатся, ожоги на коже… на преступление это похоже. Если вдруг дождик кислотный прольется, многим тогда от нее достается: Травы пожухнут, лес высыхает, рыба в озерах порой исчезает. Губит природу, и, без сомненья, это тяжелое преступление. Надо сказать, что особенно скверная - концентрированная кислота серная. Если она где-то прольется, лишь чернота вокруг остается. Она королевой себя считает, такие поступки себе позволяет! Если пролил кислоту на одежду, сам виноват, потому что – невежда, Свойства кислот не учил ты прежде, и результат – дыра на одежде.

Домашнее задание.
- Параграф 32 стр.86 до получения.
- Стр91 № 6-8 письменно, подготовка к лабораторной работе. « Химические свойства кислот» Повторить Т.Б.






































