Добрый день, уважаемые студенты!
Отправляю вам лекцию по ХИМИИ от 03.12.2020.
Лекцию законспектировать в тетрадь, и прислать фотоотчет в личные сообщения в социальную сеть ВКонтакте https://vk.com/mt_albertovna
Лекцию ВЫУЧИТЬ ВСЕМ !
А так же выполнить тест по теме «Классы неорганических соединений»
https://multiurok.ru/tests/28206/
Время на тест ограничено -10 минут, в тесте 10 вопросов.
!!!!Выполняем 1попытку, 2 попытка дается с моего разрешения.!!!
Оценка «5»- 0-1 ошибка , оценка «4» - 2-3 ошибки, оценка «3» -4-5 ошибок, оценка «2» -6 и более ошибок
!!!ЗАДАНИЕ ВЫПОЛНИТЬ ДО 16:00!!!
Объяснение темы в программе Zoom
03.12.2020
Классификация химических реакций
Химическая реакция — это превращение одних веществ (реагентов) в другие, отличающиеся по химическому составу или строению (продукты реакции).
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
Химическое превращение от физического всегда можно отличить по наличию одного или нескольких признаков:
изменение цвета;
выпадение осадка;
выделение газа;
образование слабодиссоциированных веществ (например, воды);
выделение энергии (тепловой или световой).
ТИПЫ КЛАССИФИКАЦИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
Существует несколько подходов к классификации химических реакций^
по числу и составу реагирующих и образующихся веществ
по изменению степени окисления
по агрегатному состоянию реагирующих веществ
по тепловому эффекту
по участию катализатора
по направлению протекания реакции
Рассмотрим их подробнее.
КЛАССИФИКАЦИЯ ПО ЧИСЛУ И СОСТАВУ РЕАГИРУЮЩИХ И ОБРАЗУЮЩИХСЯ ВЕЩЕСТВ
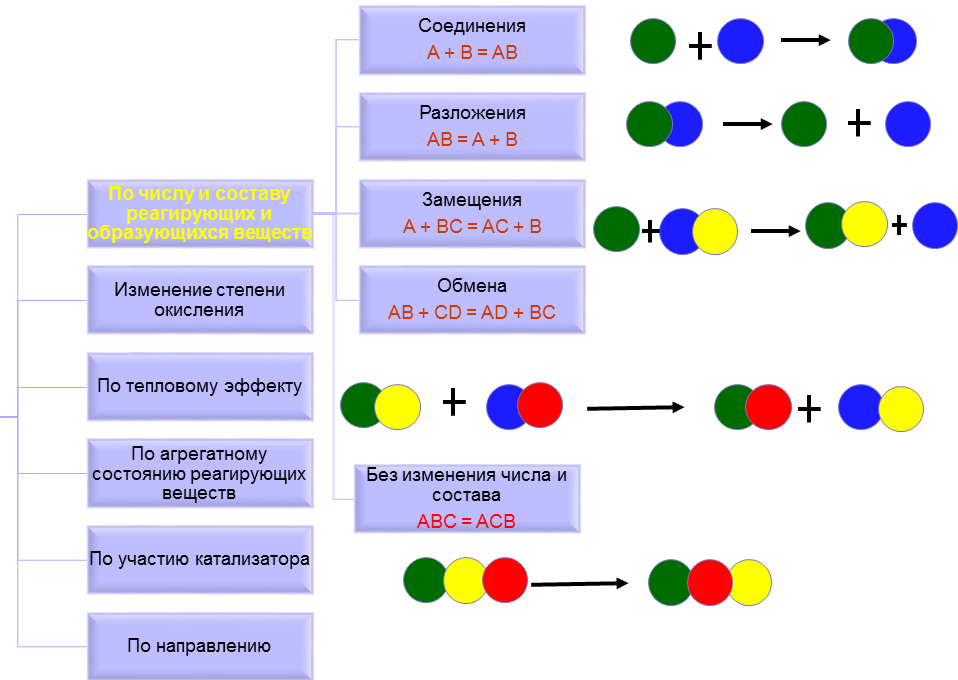
Например:
CaO+CO2=CaCO3
CaCO3=CaO+CO2
Первая реакция является реакцией соединения (иногда говорят присоединения), поскольку из двух веществ получается одно.
Во второй реакции, наоборот, из одного вещества получается два и это реакция разложения.
В реакциях замещения простое вещество замещает один из элементов в сложном веществе, в результате чего получается новое просто вещество и новое сложное вещество. Например:
2Al+Fe2O3=2Fe+Al2O3
В реакциях обмена два сложных вещества обмениваются своими составными частями и образуется два новых сложных вещества:
2NaOH+H2SO4=Na2SO4+2H2O
КЛАССИФИКАЦИЯ ПО ИЗМЕНЕНИЮ СТЕПЕНИ ОКИСЛЕНИЯ
Окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степеней окисления элемента(ов).
В любой окислительно-восстановительной реакции (ОВР) всегда должен быть как минимум один элемент, повышающий степень окисления (восстановитель), и другой — понижающий степень окисления (окислитель).
КЛАССИФИКАЦИЯ ПО ТЕПЛОВОМУ ЭФФЕКТУ
Тепловой эффект реакции — ΔQ — теплота, поглощаемая или выделяемая системой в ходе химической реакции.
Экзотермические реакции — реакции, протекающие с выделением тепла (+Q)
Самые типичные экзотермические реакции — это реакции горения:
CH4+2O2=CO2+2H2O+Q
Иногда энергетический "выигрыш" настолько велик, что происходит выделение и тепловой и световой энергии, что чаще всего принято называть взрывом. Например, горение метана в атмосфере воздуха.
В случае, если на образование новых химических связей требуется энергия большая, чем выделилась при разрыве старых связей, то системе требуется дополнительная подача тепла.
Эндотермические реакции — реакции, протекающие с поглощением тепла (-Q)
Например,
CaCO3→t,∘C CaO+CO2−Q
Термохимические уравнения — уравнения химических реакций с указанием теплового эффекта реакции.
Подробнее термохимические уравнения будут рассмотрены в соответствующем разделе.
КЛАССИФИКАЦИЯ ПО АГРЕГАТНОМУ СОСТОЯНИЮ РЕАГЕНТОВ
Напомним, что существует четыре агрегатных состояния вещества: газ, жидкость, твердое и плазма (последнее встречается крайне редко).
Реакции, протекающие в одной фазе называются гомогенными, например реакция между двумя растворами или между двумя газами. Реакции, протекающие на границе раздела фаз, называются гетерогенными.
Граница раздела фаз присутствует в системе, образованной, например, жидкостью и твердым телом (металл и кислота), твердым телом и газом (гетерогенный катализ), двумя несмешивающимися жидкостями (масло и вода). Чаще всего химические реакции являются гетерогенными.
Агрегатное состояние вещества обычно обозначается буквами русского алфавита нижним индексом в скобках : (г) — газ, (ж) — жидкость, (т) — твердое.
КЛАССИФИКАЦИЯ ПО НАЛИЧИЮ КАТАЛИЗАТОРА
Катализатор — вещество, которое ускоряет скорость химической реакции, но само при этом не расходуется.
Ингибитор — вещество, замедляющее или предотвращающее протекание химической реакции.
Следует понимать, что катализатор участвует в реакции и претерпевает ряд изменений (каталитический цикл), превращается в промежуточные соединения, которые разрушаются к концу каталитического цикла, превращаясь в исходный катализатор. Поэтому иногда в учебниках встречается формулировка: "катализатор в реакции не расходуется".
| Классификация реакций по наличию катализатора |
| каталитические | некаталитические |
| с участием катализатора | без участия катализатора |
| 2KClO3= MnO2 2KCl+3O2↑ | 2HgO=t,∘C 2Hg+O2 |
Природные катализаторы - ферменты, способны в мягких условиях (например, t тела человека равна 36,6 градуса) способствовать тому, что биохимические процессы в организме протекают с эффективностью, близкой к 100%, в то время, как выход промышленных химических процессов редко составляет более 50%.
Ингибиторы используются в быту и в промышленности для подавления протекания нежелательных процессов: старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др. Например, ортофосфорная кислота замедляет процессы окисления железа (коррозию), поэтому ее используют для предотвращения ржавления. Часто ингибиторы используются в медицине, в лекарственных препаратах, например ингибиторы образования ферментов и др
КЛАССИФИКАЦИЯ ПО НАПРАВЛЕНИЮ ПРОТЕКАНИЯ РЕАКЦИИ
Реакции, которые при заданных условиях протекают как в прямом, так и в обратном направлении, называют обратимыми.
| Классификация реакций по направлению реакций |
| обратимые | необратимые |
| протекают одновременно в двух противоположных направлениях | протекают в одном направлении (необратимо) |
| 2H2+O2= 2H2O | KOH+HNO3=KNO3+H2O |
При записи таких реакций вместо знака равенства используют противоположно направленные стрелки: "↔". В этом случае может наступить состояние равновесия. Это означает, что скорость прямого процесса становится равной скорости обратного процесса. С точки зрения получения конечных продуктов - обратимость реакции является негативным явлением, поэтому часто в промышленных химических процессах приходится смещать химическое равновесие различными способами.
К ним относятся диссоциация воды и слабых кислот, гидролиз некоторых солей, реакции водорода с бромом, иодом и азотом, многие промышленно важные реакции, такие как:
2SO2(г)+O2(г) ↔ 2SO3(г)
CO(г)+2H2(г) ↔ CH3OH(г)
2CH4(г) ↔C2H2(г)+3H2(г)
C2H4(г)+H2O(г) ↔C2H5OH(г)
C(тв)+H2O(г) ↔CO(г)+H2(г)
CH4(г)+H2O(г) ↔CO(г)+3H2(г).


















