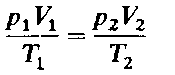Тренировочные упражнения для обучающихся по теме: «Количественные отношения в химии» часть 3
«Молярный объем газов»
Эта величина характеризует объем 1 моля газа и обозначается Vm моль/л. Все расчеты связаны с применением формул: Vm=V / ν Если брать н.у , то Vm=22,4 л/моль.
Известно, что молярная масса газа равна произведению молярного объема на плотность:
M = Vm · ρ Молярная масса газа равна произведению молярного объема на плотность.
При изучении данной темы, интересно рассказать детям фрагменты исторических открытий.
Французский химик и физик Гей-Люссак в начале 19 века начал изучать реакции с газообразными веществами и заметил, что в этих и других экспериментах неизменно обнаруживалось, что газы реагируют между собой (и образуются тоже) в простых целочисленных объемных отношениях.
H2 + Cl2 = 2 HCl (все вещества – газообразные)
Гей-Люссак опубликовал свои наблюдения, не делая из них никаких выводов. Важные выводы спустя три года сделал итальянский химик Амедео Авогадро. Он предположил, что равные объемы любых газов содержат равное количество молекул при одинаковых температурах и давлении. В этом и состоит суть закона Авогадро.
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль.
Почему только для газов?
Молекулы газов не связаны между собой крепкими связями, как молекулы или атомы твердых веществ. Объем, который они занимают, при прочих равных условиях (температуре и давлении) зависит только от числа молекул газа, но не от конкретного вида этих молекул, поскольку молекулы никак не связаны между собой. Поэтому одинаковые количества молекул разных газов должны занимать одинаковые объемы при данных температуре и давлении.
Примеры решения задач:
Какой объем займут 5 моль водорода при н.у
Применяя формулу Vm=V / ν , находим V = Vm · ν.
V(Н2) = 22,4 л/моль ·5 моль = 112 л
Какое количество углекислого газа содержится в 89,6 л.(4 моль)
Какой объем займут 0,25 моль водорода, сероводорода, хлороводорода? Почему ответы одинаковые (см ответ в теории)
Какое количество вещества метана составляют 56 л (2,5 моль)
Какой объем займет смесь газов азота и водорода количеством вещества равное по 3 моль каждый (134,4 л)
Какой объем займет смесь газов СО2 количеством вещества 0,75 моль и СО количеством вещества 1,25 моль при н.у.(44,8л)
Формулу для газов M = Vm · ρ, можно применять в решении задач:
Рассчитайте плотность (н.у) оксида углерода- IV в г/л
ρ(CO2) = 44 г/моль :22,4 моль/л = 1,96 г/л
Рассчитайте плотность сероводорода в г/л, оксида азота - IV в г/л
Если меняются условия и отличны от нормальных, то при решении задач применяется уравнение объединенного газового закона
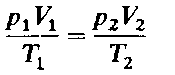
Если в условии задачи дана температура в градусах по Цельсию,
то нужно ее перевести в температуру по Кельвину, просто суммируя значения.
Если в условии дано давление кПа, то можно перевести в мм рт столба, просто
сделать пересчет так: 101,33 кПа---760 мм рт ст
93,5 кПа------х мм рт ст х= 701 мм рт ст
или наоборот, если даны мм рт ст.
Рассмотрим решение задач при изменившихся внешних условиях.
При некоторой температуре давление газа, занимающего объем 500 мл, равно 95,3 кПа. Каким станет давление, если при той же неизменной температуре, уменьшить объем газа до 450 мл?
Мы видим, что температура const, тогда преобразуем уравнение так, т е исключим из уравнения температуру и получим:
Р1V1=P2V2 отсюда выразим Р2 = Р1V1 / V2 подставим в уравнение и получим
Р2 = 95,3 кПа·500 мл /450мл Р2 = 105,8 кПа
При температуре 25°С объем газа равен 600 мл. Какой объем примет газ, если температура изменится до 60°С, а давление в системе не изменится.
Снова преобразуем формулу, исключив давление
V1/T1 = V2 /T2
Отсюда выразим V2 = V1T2 / T1 и подставим в уравнение, но при этом переведем температуру в Цельсиях в Кельвина и получим
V2 =600 мл · 333К /298 К. V2=298 мл
При температуре 15°С давление кислорода в сосуде равно 9120 кПа, меняют температуру и давление увеличивается до 10133 кПа. Определите температуру
В данной задаче видно, что объем не измен6ился, тогда исключив объем преобразуем формулу и получим
Р1/T1 = Р2 /T2 и выразим T2 = Р2 ·T1 / Р1 и подставим в уравнение, но при этом переведем температуру и получим
T2= 288К· 10133 кПа / 9120кПа. T2=319,9 К или 46,9°С
П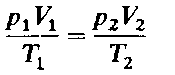 ри температуре 20°С и давлении 90,3 кПа газ занимает объем равный 140 мл. Как изменится объем газа, если температуру снизить до 0°С и давление увеличить до 101, 33 кПа.
ри температуре 20°С и давлении 90,3 кПа газ занимает объем равный 140 мл. Как изменится объем газа, если температуру снизить до 0°С и давление увеличить до 101, 33 кПа.
В данной задаче используем уравнение
и выводим значение V2 и получаем выражение
V2 = T2· Р1V1 / T1· V2, подставим значения и получим
V2=273 К· 90,3 кПа·140 / 293К·101,33 V2=116 мл