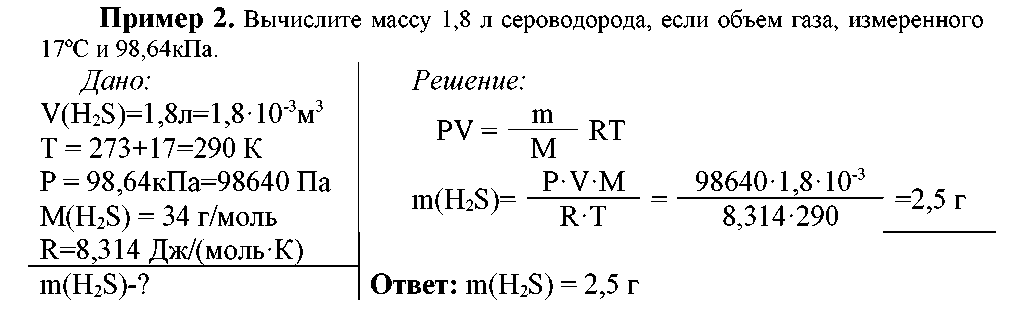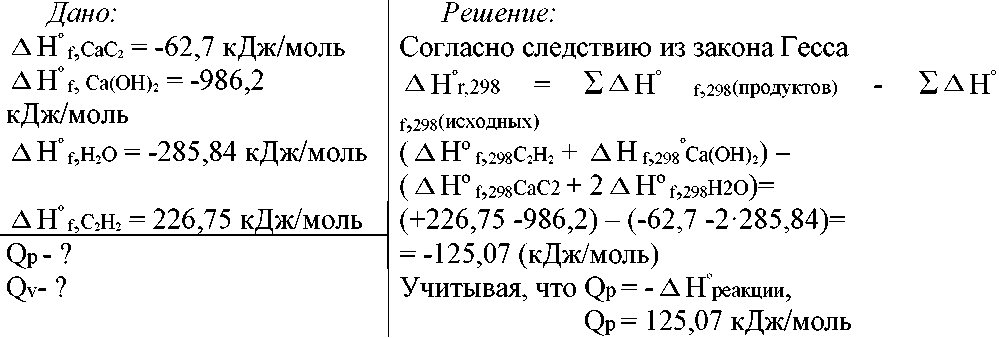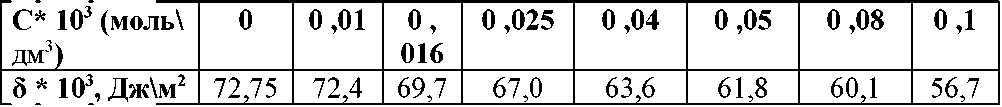ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
Тема: «Решение экспериментальных задач с использованием газовых законов, уравнения состояния идеального газа»
Цель работы: 1. Закрепление знаний о газовых законах, их математическом и графическое выражении.
2. Приобретение навыков выполнения расчетов по свойствам газов и газовых смесей, расчетов состава газовой смеси; пересчета состава газовых смесей, выраженных различными способами. 3. Формирование навыков работы со справочной литературой.
Краткие теоретические сведения
Зависимость между давлением и объемом данной массы газа при постоянной температуре выражается законом Бойля–Мариотта: при постоянной температуре давление газа обратно пропорционально его объему:
pV=const
где р - давление, V- объем, const- постоянная, значение которой зависит только от количества и вида взятого газа и температуры (но не от давления).
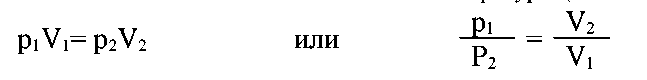
Зависимость между объемом и температурой данной массы газа при постоянном давлении выражается законом Гей–Люссака:

где const зависит от давления и массы газа, но не зависит от объема и температуры.
Зависимость между давлением и температурой данной массы газа при постоянном объеме выражается законом Шарля:

где const зависит от массы газа, но не зависит от давления и температуры.
Законы Бойля - Мариотта, Шарля, Гей-Люссака выполняются лишь для идеальных газов. Реальные газы им следуют тем точнее, чем меньше их плотность, т. е. чем ниже давление и выше температура.
Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
При нормальных условиях (р = 1 атм = 1,013 105 Па; Т= 273,15 К (t = 0ºС) один моль идеального газа занимает объем 22,4л. Число молекул, содержащихся в одном моле, называют числом Авогадро (NA = 6,022.1023 моль-1).
Объединенный газовый закон: 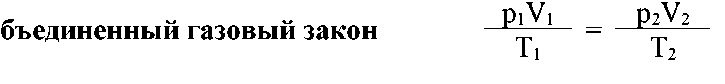
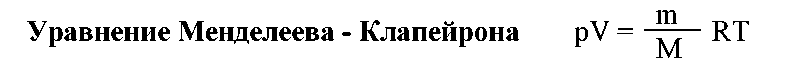
Пример 1. Определите парциальное давление азота и хлора в газовой смеси, если общее ее давление 5,6·105 Па, а состав (объемные доли): азота-0,59, хлора-0,41.

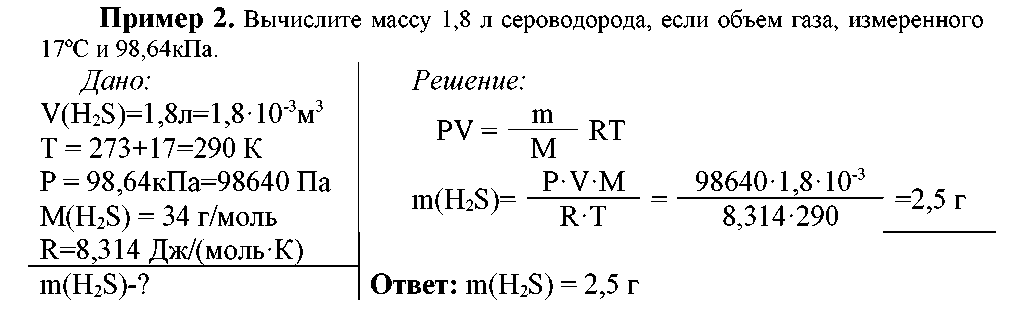
Варианты практической работы
| Вар. | № задач |
| 1. | 1,5,9,13,17,21,26,30 |
| 2. | 2,6,10,14,18,22,27,31 |
|
| 3. | 3,7,11,15,19,23,28,32 |
|
| 4. | 4,8,12,16,20,24,29,33 |
|
ЗАДАЧИ ДЛЯ РЕШЕНИЯ
1. Кислород при давлении 25 кПа занимает объем 10 л. Вычислить, какой объем займет кислород при давлении 2 кПа и постоянной температуре.
2. Какой объем займет данное количество газа при давлении 0,7·105 Па, если при давлении 1,5·105 Па это количество газ занимает объем 6 л?
3. При температуре 17° С объем газа равен 0,5л При какой температуре объем газа удвоится?
Давление газа в закрытом сосуде при 17° С равна 100 кПа. Найти давление газа, если сосуд нагрели до 400°С.
Давление газа в закрытом сосуде при 25° С равно 500 кПа. До какого значения следует понизить температуру, чтобы давление газа понизилось на 25%?
Давление газа в закрытом сосуде при 0° С равна 100 кПа. Найти давление газа, если сосуд охладили до -40°С.
Давление газа в закрытом сосуде при 25° С равно 125 кПа. При какой температуре оно станет равно 25кПа?
Найти давление газа в закрытом сосуде при 0° С , если при -23°С оно равно 101 кПа.
Давление газа в закрытом сосуде при 50° С равно 12,5 кПа. При какой температуре оно станет равно 250 кПа?
10.Найти давление газа в закрытом сосуде при 100° С , если при -0°С оно равно 78 кПа?
11.Гелий при температуре 15°С и давлении 90кПа занимает объем 4,5л. Привести объем газа к нормальным условиям.
12.Азот при нормальных условиях занимает объем 4 л. Найти его объем при температуре 25°С и давлении 180кПа.
13.Метан при температуре 27°С и давлении 150 кПа занимает объем 5л. Привести объем газа к нормальным условиям.
14.Кислород при нормальных условиях занимает объем 5,6 л. Найти его объем при температуре 100°С и атмосферном давлении.
15.Аммиак при температуре 50°С и давлении 101 кПа занимает объем 4л. Привести объем газа к нормальным условиям.
16.Хлор при нормальных условиях занимает объем 4 л. Найти его объем при температуре 25°С и давлении 80кПа.
17.Найти массу одной молекулы аммиака NH3.
18.Сколько молекул содержится в 0,0001 г воды?
19.Найти объем 2,8 г азота (н.у.).
20.Найти массу одной молекулы воды.
21.Сколько атомов содержится в 0,006г железа?
22.Найти объем 3,2 г метана (н.у.).
23.Найти массу одной молекулы кислорода.
24.Сколько атомов содержится в 0,0016 г метана?
25.Найти объем 3 г этана (н.у.).
26.Какой объем занимают 0,8 г кислорода при температуре 17° С и давлении 10 кПа?
27. 1 г водорода при 27°С занимает объем 3л. Вычислите давление газа.
28.Определить давление этилена, находящегося в количестве 45г в сосуде емкостью 8 л при 25° С.
29.Каково будет давление в сосуде емкостью 10 л, если в нем при 25°Ссодержится 35г хлора?
30.Какой объем занимают 100г хлора при 30°С и давлении 85 кПа?
31.Вычислить объем, занимаемый 4 г гелия при давлении 90 кПа.
32.Смешаны 10л кислорода и 10л водорода при давлении 1,01·102 кПа и температуре 17°С. Вычислите общее давление каждого газа, если объем смеси равен 18 л., а температура не изменилась.
33.При температуре 30°С и давлении 2,01·105 Па газ занимает объём 12 л. Какой объём займёт этот газ при нормальных условиях.
Вопросы:
Может ли вода находится в жидком состоянии при температуре при 3600С?
Укажите причины отклонения свойств реальных газов от свойств идеального газа.
Почему в таблицах температур плавления различных веществ не указана температура плавления стекла?
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
Расчет тепловых эффектов реакций различными методами
Цель работы: 1. Закрепление знаний о первом законе термодинамики, законе Гесса, термохимических уравнениях. 2. Приобретение навыков вычисления тепловых эффектов химических реакций различными методами. 3. Формирование навыка работы со справочной литературой.
Задача 1. Пользуясь табличными значениями энтальпий образования веществ, определите Qp и Qv химической реакции: СаС2(к) + 2Н2О(ж) = Са(ОН)2(к) + С2Н2(г)
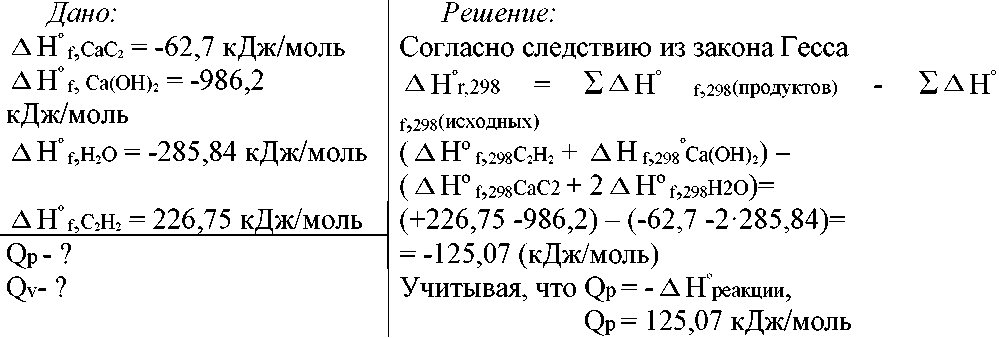
Изохорный и изобарный тепловые эффекты связаны уравнением:
Qp - Qv= - ∆nRT, где
∆n - изменение числа молей газообразных веществ в ходе реакции;
∆n = 1 - 0 =1 (т.к. СаС2 и Са(ОН)2 - твердые вещества, Н2О -жидкость)
R = 8,31410-3 кДж/(мольК); Т = 298 К
Qv= Qp + ∆nRT = 125,07 + 8,314·10-3·298 = 127,55 кДж/моль
Ответ: Qp = 125,07 кДж/моль Qv = 127,55 кДж/моль
Задача 2. Вычислить ∆Нº химической реакции 3Fe(к) + HCN(г) = FeC(к) + Fe2N(к) + 1/2H2(г)
исходя из следующих данных:
HCN(г) = 1/2H2(г) + C(к) + 1/2N2(г) ∆Нº = -130,4 кДж
Fe(к) + C(к) = FeC(к) ∆Нº = 24,2 кДж
2Fe(к) + 1/2N2(г) = Fe2N(к) ∆Нº = 8,4кДж
Решение: Найдем алгебраическую сумму уравнений 1-3 и получим:
2Fe(к) + HCN(г) = FeC(к) + Fe2N(к) + 1/2H2(г) ∆Нº = - 97,8 кДж
Методические указания
Решите указанные преподавателем задачи.
Оформите их решение в тетради для практических работ.
Сдайте результаты преподавателю.
Варианты практической работы
| Вар. | № задач | Вар. | № задач | Вар. | № задач |
| 1. | 1, 8, 13, 21 | 6. | 6, 8, 18, 21 | 11. | 4, 8, 17, 21 |
| 2. | 2, 9, 14, 22 | 7. | 7, 9, 13, 22 | 12. | 5, 9, 18, 22 |
| 3. | 3, 10, 15, 23 | 8. | 1, 10, 14, 23 | 13. | 6, 10, 13, 23 |
| 4. | 4, 11, 16, 19 | 9. | 2, 11, 15, 19 | 14. | 7, 11, 14, 19 |
| 5. | 5, 12, 17, 20 | 10. | 3, 12, 16, 20 | 15 | 1, 12, 15, 20 |
Задачи для решения
I. Пользуясь табличными значениями энтальпий образования веществ, определите ∆Нº химической реакций
1. а) СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
б) СН3СОСН3(г) + Н2(г) = СН3СН(ОН)СН3(г)
в) Fe2O3(к) + СО(г) = 2FeО(к) + СО2(г)
2. а) СН3СНО(г) + Н2(г) = С2Н5ОН(ж)
б) С6Н6(ж) + 15/2О2(г) = 6СО2(г) + 3Н2О(ж)
в) FeO(к) + СО(г) = Fe(к) + СО2(г)
3. а) С2Н4(г) + Н2О(г) = С2Н5ОН(ж)
б) С6Н5NO2(ж) + 3H2(г) = C6H5NH2(ж) + 2H2O(ж)
в) 4NH3(г) + 3О2(г) = 2N2(г) + 6Н2О(ж)
4. а) С2Н2(г) + Н2О(ж) = СН3СНО(г)
б) С2Н4(г) + 3О2(г) = 2CО2(г) + 2Н2О(г)
в) СаСО3 (к) = СаО(к) + СО2(г)
5. а) C2H5Cl(г) + Н2О(ж) = С2Н5ОН(ж.)+ НCl(г)
б) СН4(г) + Cl2(г) = СН3Cl(г) + HCl(г)
в) Ca(OH)2(к) + СО2(г) = СаСО3(к)
6. а) СН4(г) + Н2О(г) = СО(г) + 3Н2(г)
б) СН4(г) + СО2(г) = 2СО(г) + 2Н2(г)
в) N2(г) + 3Н2(г) = 2NH3(г)
7. а) С6Н6(ж) + 3Н2(г) = С6Н14(ж)
б) С2Н5ОН(ж)+ НCl(г.) = C2H5Cl(г.) + Н2О(г.)
в) N2(г) + O2(г) = 2NO(г)
II. 8. Найти количество теплоты, выделяющееся, если в реакцию СО(г) + Н2О(ж) = СО2(г) + Н2(г) вступят 5,6л СО (н.у.).
9. Найти количество теплоты, выделяющееся, если в реакции Ca(к) + Н2О(ж) = Са(ОН)2(к) образуется 7,4 г Са(ОН)2.
10. Найти количество теплоты, выделяющееся, если в реакцию 2H2S(г) + О2(г) = 2S(к) + 2Н2О(г) вступят 2,8 л О2(н.у.).
11. Найти количество теплоты, выделяющееся, если в реакции 4NH3(г) + 5О2(г) = 4NО(г) + 6Н2О(ж) образуется 5,4 г воды.
12. Найти количество теплоты, выделяющееся, если в реакцию СН4(г) + О2(г) = С(графит) + 2Н2О(г) вступят 11,2 л метана.
III. Определите Qp и Qv реакции:
13. С2Н6(г) + 7/2О2(г) = 2СО2(г) + 3Н2О(г)
14. СО(г) + Н2(г) = СН3ОН(ж)
15. С2Н5ОН(ж) = С2Н4(г) + Н2О(ж)
16. С2Н2(г) + Н2(г) = C2Н4(г)
17. 2С2Н5ОН(ж) = С2Н5 О С2Н5(г) + Н2О(г)
18. С2Н4(г) + HCl(г) = C2H5Cl(г)
IV. 19. Вычислить ∆Нº химической реакции FeO(к) + H2(г) = Fe(к) + H2O(г) исходя из следующих термохимических уравнений:
FeO(к) + CO(г) = Fe(к) + CO(г) ∆Нº =-13,18 кДж
CO(г) + 1/2O2(г) = CO2(г) ∆Нº =-283,0 кДж
H2(г) + 1/2O2(г) =H2O(г) ∆Нº =-241,83 кДж
20. Вычислить ∆Нº образования NO, исходя из следующих термохимических уравнений:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж) ∆Нº =-1168,80 кДж
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) ∆Нº =-1530,28 кДж
21. Вычислить ∆Нº образования метана, исходя из следующих термохимических уравнений:
H2(г) + 1/2O2(г) =H2O(ж) ∆ Нº = -285,84 кДж
С(г) + O2(г) = CO2(г) ∆ Нº = -393,51 кДж
CH4(к) + 2O2(к) = 2H2O(ж) + CO2(к) ∆ Нº = -890,31 кДж
22. Вычислить ∆Нº образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са(к) + 1/2О2(г) = СаО(к) ∆ Нº = - 635,60 кДж
H2(г) + 1/2O2(г) =H2O(ж) ∆Нº = - 285,84 кДж
СаО(к) + Н2О(ж) = Са(ОН)2(к) ∆ Нº = - 65,06 кДж
23. Вычислить ∆Нº образования карбоната магния, исходя из следующих термохимических уравнений:
С(г) + O2(г) = CO2(г) ∆Нº = - 393,51 кДж
2Mg(к) + O2(г) = 2MgO(к) ∆Нº = - 1203,6 кДж
MgO(к) + CO2(г) = MgCO3(к) ∆Нº = - 117,7 кДж
Практическое занятие
Зависимость скорости реакции от различных факторов
Цель работы: Изучить зависимость скорости реакции от концентрации и температуры.
Теоретическая часть
Скорость химической реакции - основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
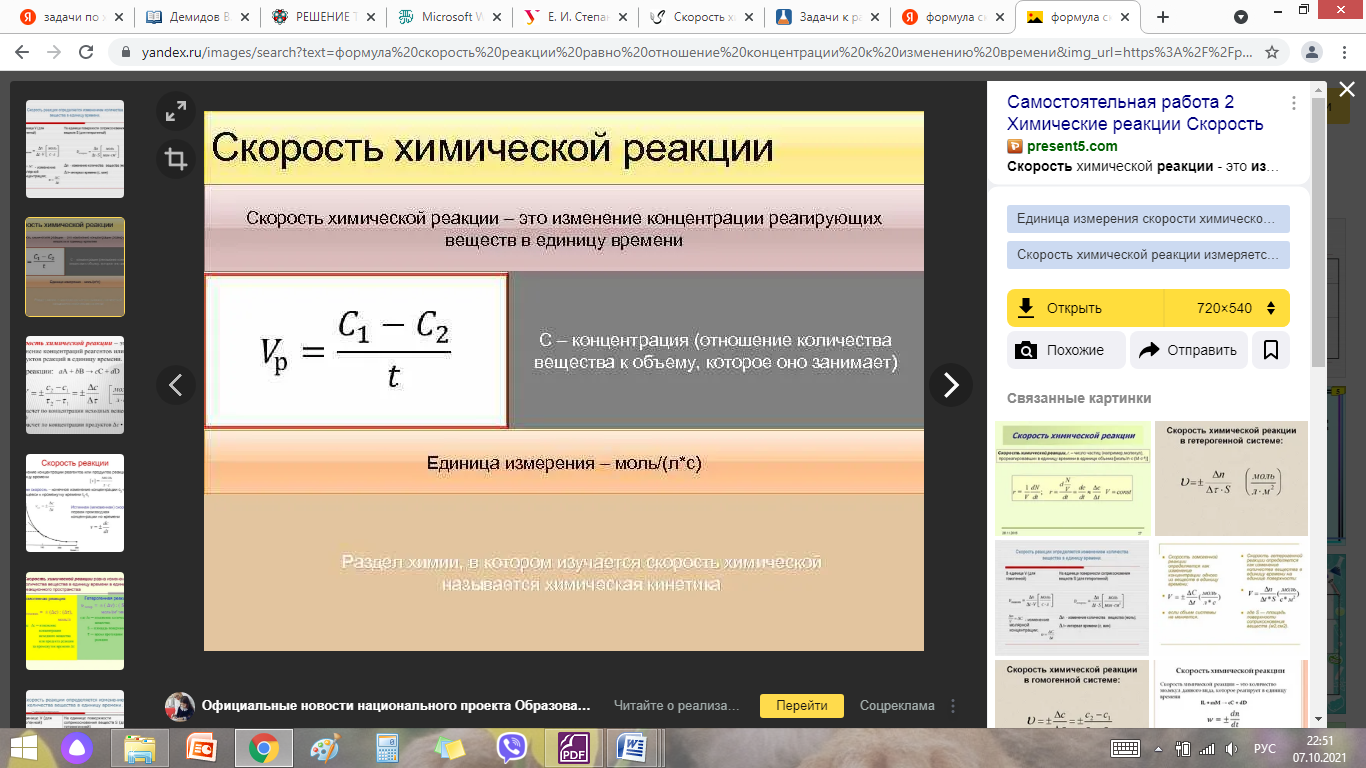
Пример 1. Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции - 3 моль/л. Реакция заняла 20 секунд. Рассчитайте скорость реакции.
Решение:

ʋр = (3-1,5)/20 =0,075 моль/л*с
Прежде всего, надо обратить внимание на основной закон химической кинетики – кинетический закон действующих масс, отражающий зависимость скорости элементарной реакции от концентрации.
Для реакции aА + bB= сС + dD закон действия масс имеет вид:

где СА или [A]- концентрация вещества А, моль/л;
СВ или [В]- концентрация вещества В, моль/л;
а и b– коэффициенты в уравнении реакции;
k – коэффициент пропорциональности, называемый константой скорости.
Если принять, что [A]=[B]=1 моль/л, то V= k, то есть константа скорости k численно равна скорости реакции, если концентрации реагирующих веществ равны единице.
Изменяя давление в системе, меняется ее объем и, следовательно, концентрация.
Пример 2. В реакции С(т)+2H2(г) CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
Решение. Согласно закону действия масс, начальная скорость реакции равна vн=k·[H2]2. После уменьшения концентрации водорода в 3 раза скорость станет равна vк=k·(1/3)2[H2]2 =1/9k[H2]2. После изменения концентрации водорода скорость изменится следующим образом:
vк/vн=1/9k[H2]2/(k[H2]2)=1/9.
Ответ: скорость реакции уменьшится в 9 раз.
Пример 3. Константа скорости реакции омыления уксусноэтилового эфира: СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р) равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и скорость реакции в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
Решение.
СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р)
Скорость прямой реакции равна:
υнач = k·[СН3СООС2Н5]·[КОН]
υнач = 0,1·0,01·0,05 = 5·10-5 моль/л·мин
В тот момент, когда концентрация эфира станет равной 0,008 моль/л, его расход составит
[СН3СООС2Н5]расход = 0,01 – 0,008 = 0,002 моль/л
Значит, в этот момент щелочи также израсходовалось [КОН]расход = 0,002 моль/л и ее концентрация станет равной
[КОН]кон = 0,05 – 0,002 = 0,048 моль/л
Вычислим скорость реакции в тот момент, когда концентрация эфира станет равной 0,008 моль/л, а щелочи 0,048 моль/л
υкон = 0,1·0,008·0,048 = 3,84·10-5 моль/л·мин
Ответ: 3,84·10-5 моль/л·мин
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два-четыре раза».

Практическая часть
Вариант 1
1. Начальная концентрация этана в сосуде для сжигания газов была равна 5 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 12 сек концентрация этана составила 1,4 моль/л. Найдите скорость данной химической реакции.
2. Как записать выражение закона действующих масс для следующих простых реакций?
2H2(г) + O2(г) = 2H2O(г);
3. Дана реакция синтеза аммиака: N2 + 3Н2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
4. Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г) 2NH3(г), если давление в системе увеличить в 2 раза?
2NH3(г), если давление в системе увеличить в 2 раза?
5. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300, если температурный коэффициент ее скорости равен 3?
6. Константа скорости реакции: СН3СООH(р-р) + КОН(р-р)→СН3СООК (р-р) +Н2O(р-р) равна 0,2 л/моль∙мин. Начальная концентрация уксусной кислоты была равна 0,5 моль/л, а щелочи – 1 моль/л. Вычислите скорость реакции в тот момент, когда концентрация кислоты станет равной 0,1 моль/л.
Вариант 2
1. Начальная концентрация аммиака в сосуде для сжигания газов была равна 4 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 3 сек концентрация аммиака составила 1 моль/л. Найдите скорость данной химической реакции.
2. Как записать выражение закона действующих масс для следующих простых реакций?
O2(г) + 2Zn(к) = 2ZnO(к).
3. Как изменится скорость реакции 2NO(г) + Cl2(г) =2NOCl(г) при увеличении концентрации NO(г) в 3 раза?
4. Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г) 2NH3(г), если давление в системе уменьшить в 3 раза?
2NH3(г), если давление в системе уменьшить в 3 раза?
5. Во сколько раз увеличится скорость реакции, для которой температурный коэффициент равен 2,5 при увеличении температуры от 40 до 900С?
6.Константа скорости реакции: СН3СООH(р-р) + КОН(р-р)→СН3СООК (р-р) +Н2O(р-р) равна 0,2 л/моль∙мин. Начальная концентрация уксусной кислоты была равна 2 моль/л, а щелочи – 2,5 моль/л. Вычислите скорость реакции в тот момент, когда концентрация кислоты станет равной 1 моль/л.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
Построение изотермы адсорбции по экспериментальным данным»
Цель работы: 1. Закрепление знаний об адсорбции и влияющих на ее величину факторах. 2. Приобретение умения построения графика изотермы адсорбции. 3. Формирование навыков расчета результатов эксперимента.
Пример решения задачи
При исследовании поверхностной активности растворов уксусной кислоты при 20°С были получены следующие данные:
| С, моль/л | 0 | 0,01 | 0,1 | 0,5 | 1,0 |
| σ·103, Дж/м2 | 72,75 | 70,02 | 66,88 | 61,66 | 57,28 |
На основе результатов опытов и расчетов построить график изотермы адсорбции х/m=f(cср) - по оси абсцисс откладывают равновесную среднюю концентрацию, по оси ординат - величину адсорбции.
Решение: 1. Найдем величину адсорбции Г. Чтобы найти величину адсорбции аналитическим способом воспользуемся уравнением:
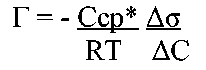
2. Рассчитаем среднее значение концентрации Сср, а также значения ΔС, Δσ и Δσ/ΔС.
Полученные данные занесем в таблицу
| Сср, моль/л | ΔС, моль/л | Δσ·103, Дж/м2 | Г, моль\м2 |
|
|
|
|
|
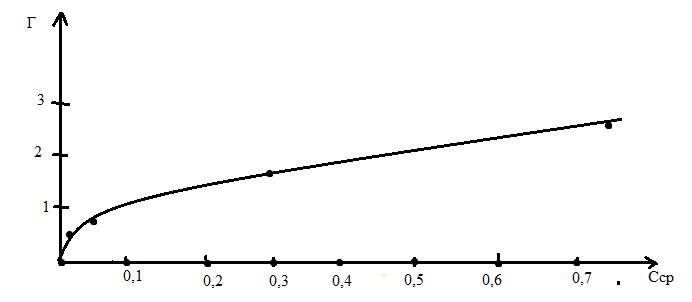
3. По полученным результатам расчетов, приведенных в таблице, строим изотерму адсорбции Лэнгмюра в координатах Г=f(C).
ХОД РАБОТЫ
На основании опытных данных, полученных при исследовании поверхностного натяжения указанного водного раствора ПАВ при определённой температуре, на основе ваших расчетов построить график изотермы адсорбции Г=f(cср) - по оси абсцисс откладывают равновесную среднюю концентрацию, по оси ординат - величину адсорбции.
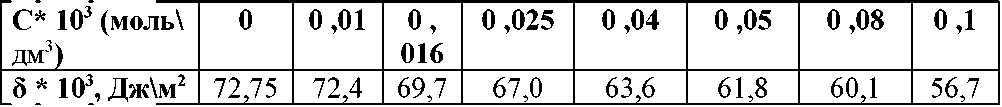
Вариант 1 (при 20°С)
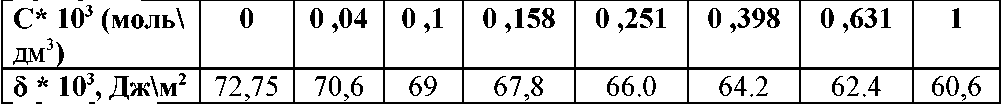
Вариант 2. (при 20°С)


Контрольные вопросы
Дайте определение адсорбции.
Какие факторы влияют на величину адсорбции?
Как строится график изотермы адсорбции?